茵陈蒿水提液对脑出血大鼠TNF-a、IL-1β表达的研究
李培育,和 梅,左寒璐
(佳木斯大学附属第一医院,黑龙江佳木斯154003)
茵陈蒿[1,2]为多年生草本艾科植物,目前对其治疗脑出血具体机制方面的研究报道很少。肿瘤坏死因子 α[3~5](Tumor necrosis factor TNF-a)各种病因所致脑水肿均可观察到TNF-a的过度表达。脑出血时局部脑组织释放促凝血酶原激酶,激活补体的级联反应,生成C5a,在C5a存在的情况下,巨噬细胞被激活产生TNF-a。细胞因子中白细胞介素-1β(Interleukin-1βIL-1β)是一种重要的炎性细胞因子,IL-1β[6,7]可能参与了缺血性脑损伤引起的神经元的死亡,在缺血性病理损伤中起重要的作用。其可以通过刺激内皮细胞表达白细胞黏附分子,使白细胞聚集在缺血脑组织,加重脑组织损害。本文旨在研究茵陈蒿水提液对脑出血模型大鼠脑出血周围组织IL-1β、TNF-a的表达的影响,为茵陈蒿提取液在临床的应用提供理论基础和技术支持,让其更广泛地应用于脑出血患者。
1 材料与方法
1.1 实验动物
纯系Wistar大鼠100只,雌性50只,雄性50只,2~3月龄,体重200~250g,由佳木斯大学动物实验中心提供。
1.2 实验中药
茵陈蒿由药店采购,经鉴定符合药典标准。RT-PCR试剂盒(大连宝生物有限公司);TNF-a免疫组化试剂盒(武汉博士德生物工程有限公司);IL-1β免疫组化试剂盒(武汉博士德生物工程有限公司);SABC试剂盒(武汉博士德生物工程有限公司)。
1.3 实验方法
将100只Wistar大鼠随机分成4组,即正常对照组、创伤模型组、低剂量组(50mg/kg·d)、高剂量组(150mg/kg·d),参照 Rosenberg等[8]报道的方法采用注射胶原酶Ⅶ造模。模型成功判断按Bederson[42]的评定方法分成三级,具体为:I级:将大鼠尾巴提起瘫痪侧前肢回收屈曲于腹下,正常侧前肢向地面伸展;Ⅱ级:除I级体征外向瘫痪侧推大鼠时阻力较对侧明显降低;Ⅲ级:除以上体征外大鼠有向瘫痪侧旋转的行为。茵陈蒿水提液高、低剂量组于造模后立即灌胃给药。高剂量组0.1mL/g·d,低剂量组0.05mL/g·d,均每日分两次灌服,用药到相应时间点。ICH对照组:造模后立即灌服等体积生理盐水,与用药组时间相同。于造模成功后1d、3d、7d分时间点处死,取动物出血部位脑组织进行实验检测。
1.4 检测方法
免疫组织化学法检测肝组织TNF-a、IL-1β,按试剂盒说明书操作。用β-actin作为内参。按照按PCR试剂盒说明操作。
1.5 统计学处理
采用SPSS 17.0统计分析软件对实验数据进行统计学处理,进行方差分析、组间差异性检验用q检验。以均数±标准差()表示。
2 结果
2.1 IL-1β免疫组化结果
见表1。
表1 各组间不同时间点IL-1β显色指数()

表1 各组间不同时间点IL-1β显色指数()
注:各组与正常组比*P <0.05,**P<0.01。与模型组相比#P<0.05,与模型组相比## P<0.01,与低剂量组相比&P<0.05
组别1d 3d 7d正常组6.63±0.31 8.26±0.22 4.32±0.12模型组 92.33±3.52** 84.26±2.71** 70.43±3.35*低剂量组 84.54±4.13** 74.63±3.15* 60.54±2.53*#高剂量组 77.37±3.72* 54.65±3.28*# 35.55±2.02**##&
治疗1d后正常对照组比较模型组IL-1β免疫组织化学显色指数明显升高(P<0.01);高剂量组低剂量组显色指数与模型组相比无统计学意义(P>0.05)。治疗3d后正常对照组比较模型组IL-1β免疫组织化学显色指数明显升高(P<0.01),治疗高、低剂量组IL-1β显色指数明显低于模型组(P<0.05),高、低剂量组之间无显色指数无差异(P>0.05);治疗7d后正常对照组比较模型组IL-1β免疫组织化学显色指数明显升高(P<0.01),治疗高、低剂量组IL-1β显色指数明显低于模型组(P<0.05或P<0.01),高剂量组IL-1β显色指数明显低于低剂量组(P<0.05)。
2.2 TNF-a免疫组化结果
见表2。
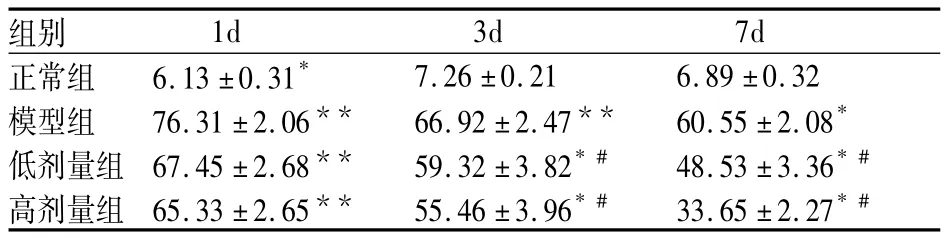
表2 各组间TNF-a显色指数比较(x± s,%)
治疗1d后正常对照组比较模型组TNF-a免疫组织化学显色指数明显升高(P<0.01);高剂量组、低剂量组显色指数与模型组相比无统计学意义(P>0.05)。治疗3d后正常对照组比较模型组TNF-a免疫组织化学显色指数明显升高(P<0.01),治疗高、低剂量组TNF-a显色指数明显低于模型组(P<0.05),高、低剂量组之间无显色指数无差异(P>0.05)。
2.3 RT-PCR结果
2.3.1 茵陈蒿水提液对大鼠血肿周围脑组织IL-1βmRNA表达的结果,见表3。
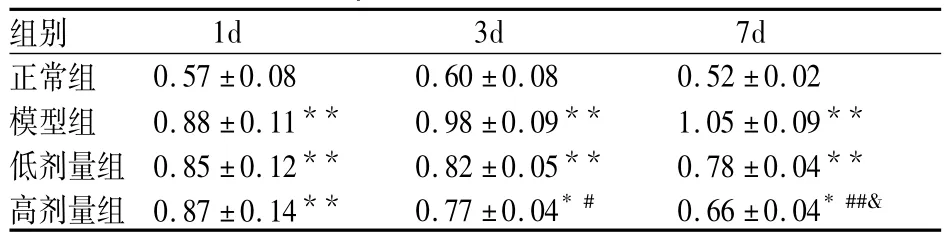
表3 茵陈蒿水提液对大鼠血肿周围脑组织IL-1βmRNA表达的影响(n=8)
治疗1d后脑出血模型组大鼠脑血肿周围组织IL-1β mRNA表达水平比正常对照组明显增多,茵陈蒿水提液高剂量组、低剂量组大鼠脑血肿周围组织IL-1βmRNA表达水平较模型组无明显差异,结果无著性意义。治疗3d后脑出血模型组大鼠脑血肿周围组织IL-1βmRNA表达水平比正常对照组明显增多,茵陈蒿水提液高剂量组、低剂量组大鼠脑血肿周围组织IL-1βmRNA表达水平较模型组下调,差异有极显著性意义(P<0.05)。提示茵陈蒿水提液高、低剂量在治疗3d后可降低大鼠脑血肿周围组织IL-1βmRNA表达。治疗7d后茵陈蒿水提液高剂量组、低剂量组大鼠脑血肿周围组织IL-1βmRNA表达水平较模型组下调,差异有极显著性意义(P<0.05或P<0.01)。提示茵陈蒿水提液高、低剂量在治疗7d后可降低大鼠脑血肿周围组织IL-1βmRNA表达。
2.3.2 茵陈蒿水提液对大鼠血肿周围脑组织TNF-αmRNA表达的结果,见表4。
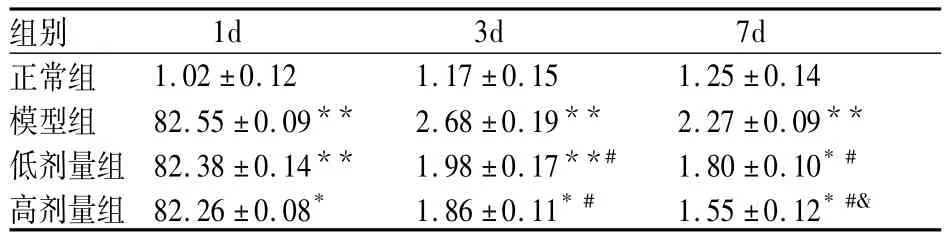
表4 茵陈蒿水提液对大鼠血肿周围脑组织TNF-αmRNA表达的影响(n=8)
治疗1d后脑出血模型组大鼠脑血肿周围组织TNF-α mRNA表达水平比正常对照组明显增多,茵陈蒿水提液高剂量组、低剂量组大鼠脑血肿周围组织TNF-αmRNA表达水平较模型组无明显差异,结果无著性意义。治疗3d后茵陈蒿水提液高剂量组、低剂量组大鼠脑血肿周围组织TNF-α mRNA表达水平较模型组下调,结果有著性意义(P<0.05)。高剂量组与低剂量组TNF-αmRNA表达无显著意义。治疗7d后茵陈蒿水提液高剂量组、低剂量组大鼠脑血肿周围组织TNF-αmRNA表达水平较模型组下调,差异有极显著性意义(P<0.05或P<0.01)。提示茵陈蒿水提液高、低剂量在治疗7d后可降低大鼠脑血肿周围组织IL-1βmRNA表达。茵陈蒿水提液高剂量组IL-1βmRNA表达较低剂量下调,差异有显著意义(P<0.05)。
3 讨论
在脑出血中,炎症反应是其中的重要环节,在引起脑血肿占位效应的同时还可以继发破坏周围组织。引起一系列反应进而加重组织损害。IL-1β炎症反应中的关键因子,它是由脑实质内的炎症细胞激活脑神经小胶质细胞分泌的一种细胞因子,它可以激活过释放脂源性介质促进脂质过氧化反应,进而产生氧自由基,用来破坏神经元的细胞膜加重脑组织坏死,同时IL-1β能释放大量毒性产物和破坏性蛋白酶,致使神经细胞遭到损害[9,10]。
TNF-α是一种炎症前体细胞因子,在炎症反应中起着重要作用[11]。它可以促进IL-1分泌,还能促进白细胞分泌,同时参与炎症损伤的过程,TNF-α、IL-1β也可诱导趋化因子(chemokines)表达“趋化因子可直接或间接诱导另一些细胞的活动,为炎症细胞直接进入损伤组织提供化学梯度”,加重炎症反应,破坏脑组织。
在本实验中,造模后1d模型组大鼠脑血肿周围组织的TNF-α、IL-1β免疫组化显色指数均较正常对照组明显上调(P<0.05或P<0.01);模型组大鼠脑血肿周围组织TNF-α、IL-1β的 mRNA表达也均较正常组上调(P<0.05或P<0.01)。
从以上结果表明,茵陈蒿水提液可以对脑出血的大鼠有一定的治疗作用,其可能的的机制为抑制IL-1β、TNF-α的表达,从而减轻炎症反应,减小对脑组织的伤害来实现,在治疗的3d后高剂量组和低剂量组IL-1β、TNF-αmRNA及蛋白表达无明显差异性(P>0.05)。随着治疗时间的延长发现,治疗7d后高剂量组IL-1β、TNF-αmRNA及蛋白表达较模型、正常组、低剂量组明显增高。因此可以说明随着治疗时间的延长,茵陈蒿水提液高剂量的治疗效果较低剂量效果要好。
[1]中华人民共和国药典2000年版一部.北京:化学工业出版社,2000,192
[2]阴健.中药现代研究与临床应用[M].北京:学苑出版社,1995,484
[3]Kim JS.Cytokines and adhesion molecules in stroke and related diseases[J].JNeurol Sci,1996,137(2):69 78
[4]Frijns CJ,Kapplle LJ,Van Gijn J,et al.Soluble adhesion molecule Reflect endothelial cell aetiation in ischemie stroke and in carotid atheroselerosis[J].Stroke,1997,28(2):2214 2218
[5]Kimelberg HK.Current concepts of brained ema.Review of laboratory investigations[J].JNeurosugr,2011,83(6):1051 1059
[6]Rosengar TK,LeeLPatel SR.Angiogenesis gene therapy:phase Iassessment of direct intramyocardialadministration of an adenovirus vector expressing VEGF 121 cDNA to individuals with clinically significant severe coronary disease[J].Circulation,1999,100:468 474
[7]Wang Rq,Zhu XZ.Expression of angiopoietin-2 and vascular endothelial growth factor inmice cerebral cortex after permanent focal cerebral ischemial[J].Acta Pharmacol Sin,2002,23(51):405 411
[8]Ddard-Fineglod.Moderate Hyperlgcernia worsene AcuteBlood Brain Barrier injury after forebrain ischemia in rats[J].Res,1984,18(1):7
[9]Barone FC,Feuerstein GZ.Inflammatory mediators and stroke:new opportunities for novel therapeutics[J].JCereb Blood Flow Metab,1999,19:819 834
[10]Bestue-Cardiel M,Martin-Martinez J,Iturriaga-Heras C,et al.Leukocytes and primary intracerebral hemorrhage[J].Rev Neurol,1999,29:968 971
[11]Gong C,Hoff JT,Keep RF.Acute inflammatory reaction following experimental intracerebral hemorrhage in rat[J].Brain Res,2000,871:57 65

