细胞色素P450 2E1在尼古丁致神经细胞氧化损伤中的作用
党帅,张红梅
(1.河南省南阳市中心医院神经外科,河南南阳473009;2.山西医科大学,山西太原030001)
细胞色素P450 2E1在尼古丁致神经细胞氧化损伤中的作用
党帅1,张红梅2
(1.河南省南阳市中心医院神经外科,河南南阳473009;2.山西医科大学,山西太原030001)
目的本文拟采用体外实验,探讨脑细胞色素P450 2E1(cytochrome P450 2E1,CYP 2E1)在尼古丁致神经细胞氧化损伤中的可能作用。方法实验选用IMR-32人神经母细胞瘤细胞系,设置对照组,尼古丁小剂量组(0.1 nM)、中剂量组(1 nM)和大剂量组(10 nM),并选用中剂量尼古丁加入不同剂量CYP2E1特异性抑制剂二丙烯基硫醚(diallyl sulfide,DAS)(0.025、0.05、0.075 nM)。尼古丁或尼古丁与二丙烯基硫醚处理细胞48 h。取处理后细胞,分别检测乳酸脱氢酶(lactate dehydrogenase,LDH)、超氧化物歧化酶(superoxide dismutase,SOD)、活性氧(reactive oxygen species,ROS)、CYP2E1mRNA和蛋白水平的变化,并对CYP2E1蛋白表达水平与LDH活力、SOD活力、ROS含量进行相关性分析。结果与对照组相比,经低、中、高剂量尼古丁处理后,IMR-32细胞增殖受抑制,抑制率分别为39%、47%、52%(均P<0.05);细胞受到损伤,培养基LDH活力分别升高14%、50%、70%(均P<0.05);SOD活力下降至对照组的76%、58%、44%(均P<0.05);细胞CYP2E1蛋白表达水平显著升高至2.19、2.65及2.76倍(均P<0.05),未见CYP2E1mRNA水平改变;ROS生成量升高48%、65%、136%(均P<0.05)。与尼古丁(1 nm)组相比,加入低、中、高剂量抑制剂后,SOD活力升高24%、47%、52%(均P<0.05);ROS含量下降至77.8%、57.8%、44.3%(均P<0.05)。相关性分析显示,CYP2E1含量与LDH活力呈正相关,与SOD活力呈负相关,相关系数分别为0.740和-0.584,与ROS含量呈正相关,相关系数为0.695(均P<0.01)。结论尼古丁处理可抑制IMR-32细胞增殖,诱导脑CYP2E1表达,明显诱导ROS生成,致神经细胞损伤。
尼古丁;细胞色素P450 2E1;自由基;神经细胞
尼古丁,又名烟碱,主要存在于烟草中,是广泛滥用的物质之一。近年来吸烟的危害越来越受到人们重视。大量科学研究证明,吸烟对人体的循环系统、呼吸系统、消化系统、内分泌系统等,均产生有害作用,其致病机理正在研究[1]。中国是世界上最大的烟草生产国和消费国,烟草产量占世界总量的1/3。至2006年末,我国吸烟者达3.5亿,占全球吸烟总人数的1/3,被动吸烟者5.4亿,每年约有100万人死于吸烟相关疾病。预计到2020年我国每年有200万人死于吸烟相关疾病[2]。IMR-32细胞来源于人神经母细胞瘤细胞系,可表达CYP2E1,也用于乙醇和尼古丁的靶位——GABAA受体和烟碱型乙酰胆碱受体的研究[3-4]。本文采用IMR-32细胞系,研究不同浓度的尼古丁对神经细胞的氧化损伤与CYP2E1表达水平的影响,探讨脑CYP2E1在神经细胞氧化损伤中的毒理学作用。
1 材料与方法
1.1 药品与试剂 尼古丁,DCF-DA,DAS,DMSO,多聚赖氨酸均购于美国sigma公司;胎牛血清购于美国Gibco公司;抗生素(青霉素+链霉素)购于碧云天生物技术研究所;MEM培养基,胰酶(含EDTA)购于杭州吉诺生物医药技术有限公司;乳酸脱氢酶(LDH)测定试剂盒,超氧化物歧化酶(SOD)测定试剂盒购于南京建成生物工程研究所;量子点超敏荧光试剂盒购于武汉珈源量子点技术开发有限公司;吐温-80购于湖北大学化工厂;冰乙酸购于郑州市化学试剂三厂;磷酸二氢钠、磷酸氢二钠购于上海市新华化工厂;氯化钠购于开封市化学试剂二厂。
1.2 主要仪器 CO2恒温培养箱(美国Thermo Fisher Scientific);倒置显微镜(日本Olympus);超净工作台(苏州净化设备厂);立式压力蒸汽灭菌器(上海申安医疗器械厂);UV-1601紫外可见分光光度计(日本岛津);电热恒温鼓风干燥箱(上海跃进医疗器械厂);SHZ-82型水浴恒温振荡器(江苏太仓市实验设备厂);-80℃超低温冰箱(海尔集团);激光共聚焦显微成像系统(德国Leica);荧光显微镜(日本Olympus);Real-time PCR Detection System(SLAN,HONGSHI);ReverTra Ace-α-反转录试剂盒(日本TOYOBO公司)。
1.3 实验方法 实验选用IMR-32人神经母细胞瘤细胞系,设置对照组,尼古丁小剂量组(0.1 nM)、中剂量组(1 nM)和大剂量组(10 nM),并选用中剂量尼古丁(1 nM)加入不同剂量CYP2E1特异性抑制剂二丙烯基硫醚(0.025,0.05,0.075 nM)。尼古丁或尼古丁与二丙烯基硫醚处理细胞48 h。取处理后细胞,分别检测LDH、SOD的变化。
ROS:细胞爬片,药物处理48 h后,用PBS缓冲液洗细胞1次,加入含0.05 nM DCF-DA的无色培养基孵育,体积以能充分盖住细胞为宜。培养箱内37℃,5%CO2培养1.5 h,吸弃负载液,PBS漂洗(3×3min)。在LSCM上,用488 nm激光激发,发射波长525 nm,扫描20 s左右待细胞内荧光强度平稳后,记录此时荧光值。用不含DCF-DA的细胞作为空白对照,以排除自发荧光的干扰;以样品的荧光强度值减去空白值作为绝对荧光强度值,未经处理的细胞的绝对荧光强度值记为100%,其余各组荧光强度值与之相比得到各自的相对活性氧强度值。
CYP2E1mRNA:参照ReverTra Ace-α-反转录试剂盒(日本TOYOBO公司)将总RNA逆转录为cDNA链,反应总体积为20μL,其中样品RNA 2μL,ReverTra Ace 1μL。42℃反应20min,95℃灭活逆转录酶5 min,反应产物-20℃保存待用。Real-time PCR扩增反应,反应体系25μL,其中SYBR Green mix 12.5μL,cDNA(5倍稀释)2.5μL。95℃变性15 s,58℃退火15 s,72℃延伸45 s,40次循环扩增,以β-actin作内参。扩增产物经含溴化乙锭的琼脂糖凝胶(1.5%)电泳分离,80V电压电泳35min,结束后用凝胶成像系统观察有无目标条带,拍照。运用2-△△CT法分析荧光定量PCR结果,并对CYP2E1蛋白表达水平与LDH活力、SOD活力、ROS含量进行相关性分析。
1.4 统计学方法 采用SPSS 17.0统计学软件进行实验数据分析,正态计量数据用“±s”表示,正态资料组间比较采用t检验,对CYP2E1表达水平与LDH活力、SOD活力以及ROS水平进行相关性分析,计算皮尔逊相关分析系数,并采用Fisher检验;以P<0.05为差异有统计学意义。
2 结果
2.1 尼古丁对IMR-32细胞损伤及对LDH水平的影响正常IMR-32细胞呈长梭形,贴壁生长,有聚集生长的特性,培养瓶底部干净清晰;经尼古丁处理后,细胞有回缩为圆形的趋势,部分细胞脱落,瓶底出现细胞碎片或其他杂质(见图1)。与对照组相比,经低、中、高剂量尼古丁处理,培养基LDH活力显著升高。经0.1、1、10 nM尼古丁处理细胞48 h后,培养基中LDH活力分别是对照组的1.14、1.50和1.70倍(均P<0.05)。
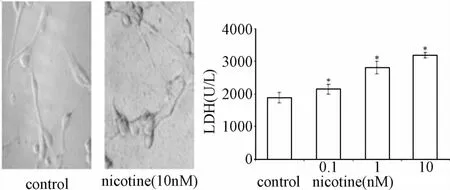
图1 尼古丁对IMR-32细胞损伤及对LDH水平的影响Fig.1 Effects of nicotine treatment on LDH levels in IMR-32 neuroblastoma cells
2.2 尼古丁抑制IMR-32细胞增殖 MTT实验显示,尼古丁可明显抑制细胞增殖,浓度为0.1、1、10 nM时的活跃度依次为61%,53%,48%(均P<0.05,见图2)。
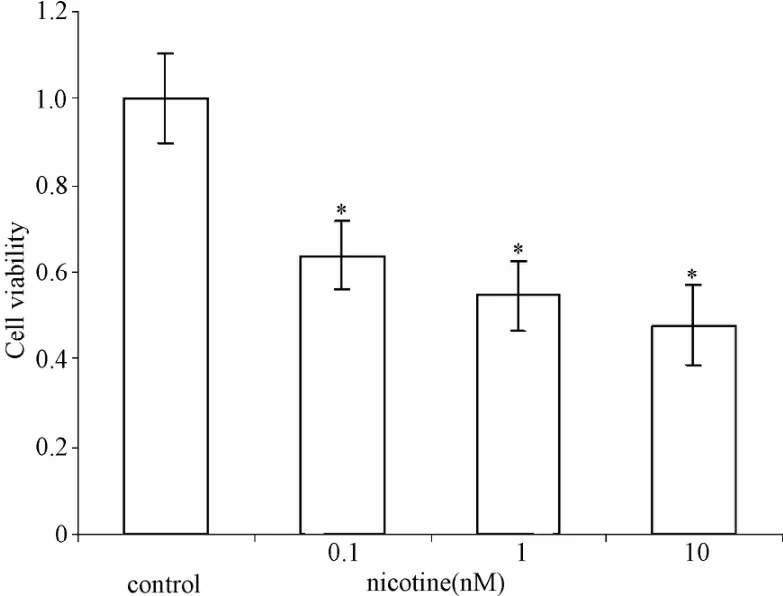
图2 不同剂量尼古丁对IMR-32细胞增值的影响Fig.2 Effects of nicotine on proliferation of IMR-32 neuroblastoma cells in a dose-dependentmanner
2.3 尼古丁/尼古丁+DAS对IMR-32细胞SOD活性的影响 实验结果表明,低、中、高剂量的尼古丁均可使细胞SOD活力下降,经0.1、1、10 nM尼古丁处理后,培养基中SOD活力分别是对照组的76%、58%和44%(均P<0.05);加入低、中、高剂量的DAS处理后,细胞SOD活力升高,经0.025、0.05、0.075 nM DAS处理后,SOD活力分别升高至尼古丁(1 nM)组的1.24、1.47和1.52倍(均P<0.05)。
2.4 尼古丁对IMR-32细胞CYP2E1蛋白水平的影响 免疫荧光化学检测显示,经0.1、1、10 nM尼古丁处理细胞48 h后,IMR-32细胞CYP2E1表达明显增加,分别升高至对照组的2.19、2.65及2.76倍(均P<0.05,见图3)。
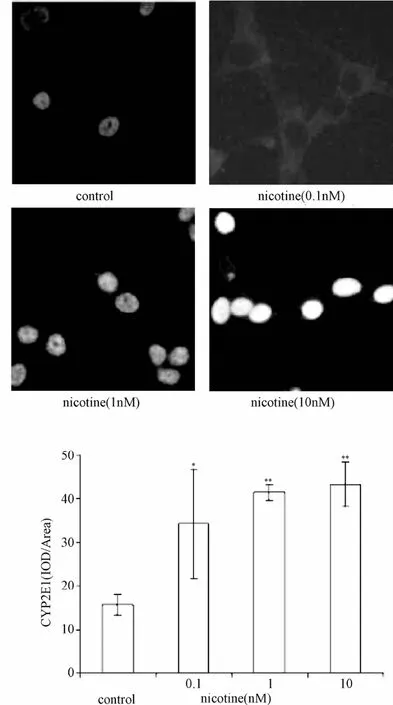
图3 尼古丁对IMR-32细胞CYP2E1蛋白水平的影响Fig.3 Effects of nicotine treatment on CYP2E1 levels in IMR-32 neuroblastoma cells
2.5 尼古丁对IMR-32细胞CYP2E1 mRNA水平的影响实验结果显示,与对照组比较,尼古丁0.1、1、10 nM处理IMR-32细胞48 h,CYP2E1 mRNA表达水平未见升高(见图4)。

图4 尼古丁对IMR-32细胞CYP2E1 mRNA水平的影响Fig.4 Effects of nicotine treatment on CYP2E1 mRNA levels in IMR-32 neuroblastoma cells
2.6 尼古丁及DAS对细胞内ROS水平的影响 与对照组相比,经0.1、1、10 nM尼古丁处理48 h后,IMR-32细胞中ROS含量分别升高1.48、1.65、2.36倍(均P<0.05);与尼古丁(1 nM)组相比,经0.025、0.05、0.075 nM DAS处理后,ROS含量降低至77.8%、57.8%、44.3%(均P<0.05)。
2.7 相关性分析 相关性分析可知,CYP2E1含量与LDH活性呈正相关,与SOD活性呈负相关,相关系数分别为0.740(P<0.01)和-0.584(P<0.01),与ROS含量正相关,相关系数为0.695(P<0.01)。
3 讨论
本文观察了不同剂量尼古丁对IMR-32细胞CYP2E1 mRNA和蛋白表达水平的影响,并观察了CYP2E1特异性抑制剂DAS,对尼古丁诱导ROS产生以及细胞氧化损伤的影响。结果表明,尼古丁处理可抑制IMR-32细胞增殖,产生细胞损伤,诱导ROS生成及CYP2E1表达,且均表现出剂量依赖性,但对mRNA水平无影响;抑制CYP2E1活性,可明显减少ROS生成。尼古丁诱导细胞ROS生成机制尚不清楚[5-7],本研究结果提示尼古丁致细胞ROS升高可能与其诱导CYP2E1水平相关。尼古丁可剂量依赖性诱导IMR-32细胞ROS生成。相对于其他CYP亚型,CYP2E1具有较高的NADPH氧化活性,这是由于CYP2E1蛋白空间结构具有可变性,由于CYP2E1蛋白构型的高速变化,底物与活性位点仅有短暂结合时间以进行活性氧转移。尼古丁诱导CYP2E1后ROS产生增多,是否与上述信号通路激活有关需进一步研究[8-11]。当ROS生成增多时,机体会调动复杂的抗氧化系统来保证生物体内氧化——抗氧化的平衡,抗氧化系统主要由抗氧化酶类和抗氧化剂组成,如SOD。IMR-32细胞经尼古丁处理后,SOD活力下降,提示尼古丁产生的ROS引起了SOD的耗损[12-14]。当ROS含量超过机体清除能力时,则产生氧化损伤[15]。本实验观察到培养基LDH活力升高,提示IMR-32细胞经尼古丁处理后细胞膜受到损伤。尼古丁处理可抑制IMR-32细胞增殖,导致细胞损伤,诱导CYP2E1蛋白表达,ROS生成增多,并表现出剂量依赖性,相关性分析提示,CYP2E1表达水平与IMR-32细胞ROS含量显著相关;尼古丁通过CYP2E1对细胞产生氧化损伤的机制以及诱导神经细胞CYP2E1表达的机制,以及尼古丁暴露时间对CYP2E1作用的差异尚需进一步研究。
本文结果表明,尼古丁可剂量依赖性抑制IMR-32细胞增殖,在转录后水平诱导CYP2E1蛋白表达,ROS生成增多;抑制脑CYP2E1活性,可明显减少ROS生成量。相关性分析提示,CYP2E1可能参与尼古丁致神经细胞氧化损伤。
[1]Wu BY,Liang HY,Chen DF.AssociationsofRsa Ipolymorphism at the 5′flanking region ofCYP2E1 and PON2 148 polymorphism in neonates with preterm delivery[J].Journal of Genetics and Genomics,2003,30(6):577-583.
[2]Gonzalez FJ.Role of cytochromes P450 in chemical toxicity and oxidative stress:studies with CYP2E1[J].Mutat Res,2005,569(1-2):101-110.
[3]Upadhya SC,Tirumalai PS,Boyd MR,et al.Cytochrome P4502E(CYP2E)in brain:constitutive expression,induction by ethanol and localization by fluorescence in situ hybridization[J].Arch Biochem Biophys,2000,373(1):23-34.
[4]Howard LA,Miksys S,Hoffmann E,et al.Brain CYP2E1 is induced by nicotine and ethanol in ratand is higher in smokers and alcoholics[J]. Br JPharmacol,2003,138(7):1376-1386.
[5]Lee AM,Yue J,Tyndale RF.In vivo and in vitro characterization of chlorzoxazonemetabolism and hepatic CYP2E1 levels in African Green monkeys:induction by chronic nicotine treatment[J].Drug Metab Dispos,2006,34(9):1508-1515.
[6]Cederbaum AI,Lu Y,Wu D.Role of oxidative stress in alcoholinduced liver injury[J].Arch Toxicol,2009,83(6):519-548.
[7]乔国伟,吸烟对人体的危害及其发病机理研究进展[J].中外健康文稿,2009,6(01X):16-18.
[8]俞银姣,吸烟的危害与尼古丁替代疗法[J].药物不良反应杂志,2008,10(5):346-351.
[9]Hukkanen J,Jacob P,Benowitz NL.Metabolism and disposition kinetics of nicotine[J].Pharmacol Rev,2005,57(1):79-115.
[10]Wilkinson BL,Landreth GE.The microglial NADPH oxidase complex as a source of oxidative stress in Alzheimer's disease[J].J Neuroinflammation,2006(2),3:30.
[11]Crowley-Weber CL,Dvorakova K,Crowley C,et al.Nicotine increases oxidative stress,activates NF-kappaB and GRP78,induces apoptosis and sensitizes cells to genotoxic/xenobiotic stressesby amultiple stress inducer,deoxycholate:relevance to colon carcinogenesis[J].Chem Biol Interact,2003,145(1):53-66.
[12]Nelson ME,Wang F,Kuryatov A,et al.Functional properties of human nicotinic AChRs expressed by IMR-32 neuroblastoma cells resemble those of alpha3beta4 AChRsexpressed in permanently transfected HEK cells[J].JGen Physiol,2001,118(5):563-582.
[13]Sapp DW,Yeh HH.Heterogeneity of GABA(A)receptor-mediated responses in the human IMR-32 neuroblastoma cell line[J].JNeurosci Res,2000,60(4):504-510.
[14]Hu Y,Oscarson M.Johansson I,et al.Genetic polymorphism of human CYP2E1:characterization of two variant alleles[J].Mol Pharmacol,1997,51(3):370-376.
[15]Zuber R,Anzenbacherova E,Anzenbacher P.Cytochromes P450 and experimentalmodels of drug metabolism[J].JCell Mol Med,2002,6(2):189-198.
(编校:谭玲,刘路路)
Roles of cytochrome P450 2E1 in neural cell of nicotine-induced oxidative injury
DANG Shuai1,ZHANG Hong-mei2
(1.Department of Neurosurgery,Center Hospital of Nanyang,Nanyang 473009,China;2.ShanxiMedical University,Taiyuan 030001,China)
ObjectiveTo investigate roles of CYP2E1 in neural cell damage induced by nicotine treatment.MethodsIn this study,IMR-32 neuroblastoma cells were cultured.Those cellswere ramdom ly divided into control group,low dose ofnicotine group,middle dose of nicotine group,and high dose of nicotine group.Those nicotine groupswere treated with nicotine(0.1,1 and 10 nM),whilemiddle dose of nicotine group was co-treated with nicotine(1 nM)and dially sulfide(0.025,0.05 and 0.075 nM)for48 hours.After treatment,levels of ROS,SOD,CYP2E1 protein and CYP2E1 mRNA were detected.The relationship between CYP2E1 protein levels and LDH,SOD,ROS levels were analysed by correlation analysis.ResultsCompared with control group,the results of nicotine groups showed that proliferation of IMR-32 neuroblastoma cells were suppressed after the treatment of low dose of nicotine,middle dose of nicotine and high dose of nicotine,and the suppression ratios were 39%,47%,52%respectively(all P<0.05).The lactate dehydrogenase significantly increased(1.14-fold,1.5-fold,1.7-fold,all P<0.05),and superoxide dismutase significantly decreased to 76%,58%and 44%of control group(all P<0.05).The expression of CYP2E1 protein significantly increased(2.19-fold,2.65-fold,2.76-fold),and the levels of ROS significantly increased(1.48-fold,1.65-fold,2.36-fold)(all P<0.05),while CYP2E1 mRNA did not change significantly.Compared withmiddle dose of nicotine group(1 nM),the levels of ROS decreasd(88.5%,79.9%,51.2%)and SOD increased(1.24-fold,1.47-fold,1.52-fold)after treatmentwith DAS(0.025,0.05 and 0.075 nM).Correlation analysis demonstrated that CYP2E1 levelwas correlated to LDH(0.740),SOD(-0.584)and ROS(0.695)levels(all P<0.01).Conclusion Nicotine treatment could inhibit the proliferation of IMR-32 cells,induce brain CYP2E1 expression,induce ROS generation,and induce damage to nerve cells.
nicotine;cytochrome P450 2E1(CYP2E1);ROS;neural cell
R966
A
1005-1678(2014)08-0034-04
高等学校博士学科点专项科研基金(20091417120003)
党帅,男,硕士,副主任医师,研究方向:颅脑损伤及脑血管病临床研究,E-mail:dangs@126.com。

