肿瘤坏死因子-α、白细胞介素-1β在淀粉样蛋白致阿尔茨海默病大鼠神经元损伤中的作用
邢恩鸿 田建丽 王爱霞 王瑞婷
(承德医学院附属医院,河北 承德 067000)
淀粉样蛋白(Aβ)作为阿尔茨海默病(AD)发病的始动因子已得到认可。炎症反应在AD中的作用越来越受到关注。流行病学研究发现,长期服用非甾体抗炎药(NSAIDs)的老年人AD发生率明显降低。Leuchtenberger等〔1〕研究发现,给予NSAIDs后AD模型动物脑内Aβ沉积和活化态小胶质细胞的数量均明显减少,脑内炎性反应明显减轻。本实验通过大鼠双侧海马注射Aβ制作痴呆模型,采用免疫组化、ELISA等技术探讨炎症因子、胶质细胞在AD发生中的作用,为抗炎药物用于AD的治疗提供实验依据。
1 材料与方法
1.1实验动物分组及处理 雄性Wistar大鼠20只,10~12 w,体质量(280±20)g,动物证号712123,由河北省实验动物中心提供,清洁级。分笼饲养,每笼5只动物室温度(22±2)℃,自然光线,自由食水,普通饲料,适应性喂养1 w,随机分为对照组、实验组,各10只,对照组大鼠海马注射生理盐水,模型组大鼠双侧海马各注射Aβ 5 μl含10 μg,注射7 d后进行水迷宫实验,连续测6 d,于第14天,处死,取血、脑组织。
1.2试剂 Aβ25~35购自Sigma公司,HPLC≥97%,1 mg溶于500 μl无菌生理盐水(2 g/L),-20℃保存,临用前置于37℃孵育7 d成凝胶态。大鼠血清TNF-α(RRA00),IL-1β(RTA00)ELISA试剂盒由R&D提供,山羊抗兔GFAP 多抗(G9269)购自中杉公司,其他试剂为分析纯。
1.3痴呆动物模型制作 4%的水合氯醛腹腔麻醉(1 ml/100 g)大鼠,固定于大鼠脑立体定位仪,于大鼠AP -3.5 mm,ML ±2 mm,DV 2.7 mm定位海马CA1区,微量注射器10 min内缓慢注入Aβ。
1.4Morris水迷宫行为学实验 圆形不锈钢水池,直径120 cm,高60 cm,将水池等分为4个象限,目标象限的中央放置一直径为10 cm,高23.5 cm的圆形隐藏平台,每天将大鼠从4个象限点面向池壁各测验2次,记录动物寻找并爬上平台所需时间,如果动物在60 s内未找到平台,潜伏期记为60 s。第1~2天为训练,后4 d数据作为学习、记忆成绩。
1.5血清制备 每组取6只大鼠,麻醉后经心脏取血,室温放置30 min,于4℃,4 000 r/min离心10 min,取上清,冻存于低温冰箱。血清TNF-α、IL-1β检测严格按试剂盒说明书进行。
1.6光镜标本制作 每组选4只大鼠脑组织制作光镜标本。动物麻醉取血后,经左心室快速灌注250 ml的生理盐水,然后灌注含4%多聚甲醛的PB液250 ml进行内固定,1 h后取脑,在海马注射部位沿冠状面切开,在4%多聚甲醛中外固定过夜,PBS液冲洗,梯度酒精脱水,二甲苯透明,浸蜡,包埋,冠状面连续切片,片厚5 μm,切片取含海马部位,做硫堇染色和免疫组化研究。
1.7硫堇染尼氏体 切片经二甲苯脱蜡,梯度酒精水合,蒸馏水冲洗,0.2%硫堇60℃水浴30~60 min,冷却后梯度酒精脱水,二甲苯透明,中性树胶封片。
1.8免疫组化 用处理过的载玻片捞片,(75±5)℃烤片40 min,二甲苯脱蜡,梯度酒精水合,PBS洗,95℃水浴抗原修复10~15 min,PBS冲洗,3%甲醇-H2O2去除过氧化物,PBS洗,10%山羊血清封闭37℃ 15 min,滴加Ⅰ抗(GFAP1∶80)孵育37℃ 2.5 h,PBS洗,Ⅱ抗孵育37℃ 15 min,PBS洗,Ⅲ抗孵育37℃ 15 min,DAB显色,终止显色,苏木素复染,梯度酒精脱水,二甲苯透明,中性树胶封片,用PBS液代替一抗为阴性对照。
1.9细胞计数 每组选取2个标本,光镜下每个标本选海马CA1区细胞损伤最严重的连续4张切片,400倍视野下计数CA1区损伤段的细胞数。
1.10统计学处理 采用SPSS11.5软件进行t检验。
2 结 果
2.1Aβ对大鼠水迷宫实验结果的影响 对照组大鼠第3、4、5、6天寻找平台潜伏期呈现缩短趋势,模型组大鼠寻找平台潜伏期也呈现缩短趋势,但潜伏期与对照组相比明显延长(P<0.01,见表1)。
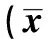
表1 Aβ对大鼠水迷宫实验结果影响±s,s)
2.2Aβ对大鼠海马神经元的影响 对照组海马CA1区有3~4层细胞,排列整齐、形态清晰、结构完整,尼氏体呈紫色,核不着色,核仁清晰,居中,可见大量树突;模型组大鼠海马CA1区仅有1~2层细胞,排列不规整,局部出现大段神经元缺失、神经元缺失部分有大量胶质细胞浸润,细胞形态异常,结构不完成,部分树突断裂。模型组大鼠海马CA1区神经元数量明显减少(P<0.01,见图1,表2)。
2.3GFAP免疫组化染色结果 GFAP是胶质细胞特异性分泌的一种酸性蛋白,镜下可见胶质细胞突起呈棕黄色(图2),模型组海马GFAP阳性细胞数明显高于对照组(见表2)。

A:对照组(×40);B:模型组(×100);C:对照组(×400);D:模型组(×400)


组别尼区染色GFAP阳性细胞对照组151.25±20.096.5±2.4模型组60.88±9.231)16.7±4.21)

对照组 模型组
2.4大鼠血清TNF-α、IL-1β含量 模型组大鼠血清中TNF-α明显高于对照组〔(86.72±25.37)pg/ml,P<0.05〕;大鼠血清中IL-1β〔(13.21±3.56)pg/ml〕明显高于对照组(P<0.05)。
3 讨 论
体外凝聚态Aβ与AD患者脑中的Aβ有相似的结构,其中25~35位氨基酸序列的多肽片段是Aβ的生物活性片段〔2〕,有报道Aβ25~35体内外实验研究显示能引起海马神经元损伤、学习、记忆能力下降〔3,4〕。
本实验结果提示胶质细胞参与了Aβ引起的神经元损伤。有文献报道胶质细胞可被Aβ激活,吞噬清除过多的Aβ,在中枢免疫过程是主要介体,其激活是AD发病的重要环节。GFAP在胶质细胞激活中表达增加,最后成为胶质疤痕的主要成分。GFAP特异性的存在于星形胶质细胞(Ast),研究发现GFAP的表达与Ast的活性成正比,GFAP表达增强标志中枢神经系统损害时反应性Ast增生〔5,6〕。
本实验结果提示Aβ神经毒性作用通过Aβ激活胶质细胞分泌细胞因子,参与神经元损伤,促进Aβ沉积,加速病程的发展。AD患者脑内细胞因子水平持续增高,主要由处于持续激活状态的胶质细胞(星形胶质细胞、小胶质细胞等)产生,主要包括TNF-α、IL-1β等的表达增加〔7〕。徐书雯等〔8〕研究发现补体C1q可能通过促炎性因子TNF-α增强Aβ诱导MG炎症反应。邬烈铭等〔9〕研究发现TNF-α浓度可能是反映痴呆严重程度的状态指标。高浓度TNF-α对神经元具有毒性作用,Takeuchi等〔10〕研究发现TNF-α诱导神经毒性是通过激活的小胶质细胞(MG)自分泌谷氨酸盐实现的。TNF-α与神经元膜上的受体TNF-R结合,而TNF-R与神经营养素受体具有同源性,能激活相似的信号转导系统,引起TNF-α与神经营养素的相互竞争,诱导神经元凋亡。TNF-α可协同IL-1强烈诱导IL-6产生,加速Aβ沉积。有研究发现在AD患者脑中,IL-1β浓度增高与MG活化密切相关,MG在Aβ作用下可分泌大量的IL-1β〔11〕。IL-1β的过度表达诱导神经细胞凋亡〔12〕,促进Aβ沉积,加速AD的恶化。宴燕等〔13〕研究发现AD患者血清TNF-α、IL-1β显著高于正常对照组,TNF-α、IL-1β水平的检测可以成为临床辅助诊断的生物学指标。最近有研究发现替米沙坦可以抑制炎症反应,降低脑脊液内致炎细胞因子水平,减少对神经元的损害,改善认知功能〔14〕。
慢性激活状态的胶质细胞所产生的细胞因子在AD发病的不同环节主要起放大炎症过程和细胞毒性作用。细胞因子可兴奋神经元,抑制胆碱能神经元传递,通过慢性局部炎症导致选择性脑区胆碱能神经元的变性死亡。因此,AD患者通过抗炎药物抑制脑内炎症反应的不适当激活,减少脑内细胞因子的量,可能延缓病程的发展。
4 参考文献
1Leuchtenberger S,Beher D,Weggen S.Selective modulation of A beta42 production in Alzheimer’s disease: non-steroidal anti-inflammatory drugs and beyond〔J〕.Curr Pharm Des,2006;12(33):4337-55.
2Chen QS,Kagan BL,Hirakura Y,etal.Impairment of hippocampal long-term potentiation by Alzheimer amyloid beta-peptides〔J〕.J Neurosci Res,2000;60(1): 65-72.
3Deshpande A,Mina E,Glabe C,etal.Different conformations of amyloid beta induce neurotoxicity by distinct mechanisms in human cortical neurons〔J〕.J Neurosci,2006;26(22):6011-8.
4Pan YF,Chen XR,Wu MN,etal.Arginine vasopressin prevents against amyloid beta(25-35) induced impairment of spatial learing and memory in rats〔J〕.Horm Behav,2010;57(4-5):448-54.
5Kuegler PB,Baumann BA,Zimmer B,etal.GFAP-independent inflammatory competence and trophic functions of astrocytes generated from murine embryonic stem cells〔J〕.Glia,2012;60(2):218-28.
6熊 鹏,吴秋霞,王继才,等.精神分裂症患者血清GFAP与MBP水平的变化〔J〕.中国神经精神疾病杂志,2013;39(1):44-7.
7Azizi G,Mirshafiey A.The potential role of proinflammatory and antiinflammatory cytokines in Alzheimer disease pathogenesis〔J〕.Immunopharmacol Immunotoxicol,2012; 34 (6):881-95.
8徐书雯,张霞辉,李东风,等.补体C1q对Aβ纤维诱导的小胶质细胞炎性反应的影响〔J〕.中华老年医学杂志,2013;32(1):96-8.
9邬烈铭,朱文芳,裴 瑜,等.老年性痴呆患者认知功能与血清炎性细胞因子浓度的相关研究〔J〕.中华临床医师杂志(电子版),2012;6(11):2970-3.
10Takeuchi H,Jin S,Wang J,etal.Tumor necrosis factor-alpha induces neurotoxicity via glutamate release from hemichannels of activated microglia in an autocrine manner〔J〕.J Biol Chem,2006;281(30):21362-8.
11Sanz JM,Paola Chiozzi,Davide Ferrari,etal.Activiation of microglia by myloid β requires P2X7 receptor expression〔J〕.J Immunol,2009;182(7):4378-85.
12刘恒颖, 康劲松, 徐 琪,等.IL-1β对大鼠胆碱能神经元的影响〔J〕.中风与神经疾病杂志.2001;18(2):87-8.
13宴 燕,王 萍.阿尔茨海默病血浆中IL-6、Aβ1-40、MCSF、IL-1β、TNF-α的临床诊断意义〔J〕.中国当代医药,2012;19(34):17-8.
14Washida K,Ihara M,Nishio K,etal.Nonhypotensive dose of telmisartan attenuates cognitive impairment partially due to peroxisome proliferator-activated receptor-gamma activation in mice with chronic cerebral hypoperfusion〔J〕.Stroke,2010;41(8):1798-806.

