小檗碱对Aβ25~35诱导的阿尔茨海默病细胞模型的保护作用
杨吉平 费 琳 张军峰 赵朝华 徐 曦
(西安医学院基础医学研究所,陕西 西安 710021)
阿尔茨海默病(AD)最显著的神经组织病理学特征是神经细胞之间存在大量的老年斑(SP)和神经细胞内存在神经原纤维缠结(NFT)。关于AD 的发病机制有淀粉样蛋白(Aβ)级联假说、tau 蛋白异常假说、凋亡假说、胆碱能假说以及自由基损伤假说等,但其确切的发病原因目前还不十分明确。小檗碱又称黄莲素,是从毛茛科植物黄连、三角叶黄、云连的干燥根茎中提取的一种异喹啉类生物碱,是我国历史悠久的传统药物的主要成分,临床上主要用于治疗胃肠道疾病。近年来随着对小檗碱药效作用的深入研究,发现小檗碱在体内、外均具有抑制多种肿瘤细胞增殖的作用〔1〕。此外,小檗碱对于治疗神经退行性疾病的潜力越来越受到关注〔2,3〕。本实验用Aβ25~35诱导损伤原代培养的大鼠海马神经元,复制AD 细胞模型,观察小檗碱的神经保护作用。
1 材料与方法
1.1主要试剂与仪器 DMEM/F12培养基购自武汉博士德生物工程有限公司,胰蛋白酶购自Beyotime 公司,噻唑蓝(MTT)购自Amresco公司,Aβ25~35及阿糖胞苷购自Sigma 公司,Annexin V-FITC/PI 细胞凋亡检测试剂盒购自上海美季生物技术有限公司,兔抗大鼠Cleaved caspase-3(Asp175)购自Cell Signaling Technology、抗 β-actin 及山羊抗兔IgG (FITC) 购自Santa Cruz公司,小檗碱购自中国药品生物制品检验所 (批号:1107132200218)。
1.2大脑海马神经元的原代培养 取出生24 h Wistar大鼠,用75%乙醇浸泡消毒,无菌条件下分离出海马组织,置于冰浴 PBS 液中,小心剔除血管及筋膜,用PBS 液冲洗干净,剪碎。然后加入30倍组织体积的2.5 g/L胰蛋白酶液,37 ℃振荡消化15 min,FBS液终止消化,过75 μm筛网。1 000 r/min离心10 min,收集细胞,加入15 ml 种植液(DMEM/F12+10%胎牛血清)重悬,以1×106个细胞将海马神经元接种于涂有多聚赖氨酸的 96 孔培养板内,置37℃、5% CO2、饱和湿度的培养箱内培养,以接种当天为培养第1天,至培养第3天加入终浓度为10 μmol/L 的阿糖胞苷以抑制非神经元的增殖,细胞培养液隔日半量换液,培养7 d 后用于各项实验。
1.3分组及药物干预 实验分为对照组、模型组、小檗碱1、2、4 μmol/L组。将海马神经元正常培养7 d 后,加入Aβ25~35使其终浓度为25 μmol/L,作用36 h,复制AD细胞模型,预先或同时按以上不同浓度加入小檗碱作用。对照组以等量的培养液代替。
1.4细胞存活率检测 用细胞增殖抑制试验(MTT比色法)测定小檗碱对Aβ25~35复制AD细胞模型细胞存活的影响。在96 孔培养板中,给培养7 d 的大鼠海马神经元小檗碱组分别加入小檗碱1、2、4 μmol/L,对照组及模型组以等量含10%血清DMEM 培养基代替,培养24 h后倒置相差显微镜下观察各组细胞的形态学变化。在模型组和小檗碱组分别加入终浓度为25 μmol/L 的Aβ25~35,继续培养36 h。每组设4个平行孔。在避光条件下,每孔加入MTT 20 μl(浓度为5 mg/ml),继续培养4 h,弃上清后每孔加 DMSO 100 μl,37℃振荡10 min,待紫色结晶充分溶解后,置于酶标仪上测波长为570 nm的吸光度(A)值。取4孔的均值计算细胞存活率。
1.5Annexin V/PI 双标流式细胞法检测小檗碱对AD模型神经元早期凋亡的影响 原代培养神经元种植于12孔板中,正常培养7 d后,加入Aβ25~35及小檗碱进行干预,共同作用36 h。离心、收集、悬浮细胞, 在细胞悬浮液中加入5 μl Annexin V-EGFP,轻轻混匀后在4 ℃避光条件下孵育15 min。 加入10 μl PI 后轻轻混匀于4 ℃避光条件下孵育5 min。在1 h内通过流式细胞仪检测小檗碱对AD 模型神经元早期凋亡的影响。实验重复3次。
1.6Western 印迹检测小檗碱对AD 模型神经元活化的Caspase-3蛋白表达的影响 原代培养神经元种植于6 孔板中,正常培养7 d后,加入Aβ25~35及小檗碱进行干预,共同作用36 h。吸去培养液,用冰PBS洗涤2次,弃去洗液并吸干残液;加入100 μl NP-40细胞裂解液 (pH7.4),收集细胞于离心管中,在冰上裂解30 min,4℃,12 000 r/min,离心20 min;上清液转至另一离心管中,采用Bradford 法蛋白定量。样品与4 ×上样缓冲液混合,煮沸5 min,取等量总蛋白上样。以SDS-聚丙烯酰胺凝胶电泳分离,首先以85 V恒压电泳,进入分离胶后将电压调到120 V,直至溴酚蓝前沿到达距底部约1 cm左右时,停止电泳。湿电转移法转移至硝酸纤维素膜,膜在室温下用5%脱脂奶粉封闭1 h,TBS漂洗5 min×2次后,加入兔抗大鼠Cleaved Caspase-3抗体(1∶500),4 ℃过夜,TBS漂洗10 min ×4次,加入1∶10 000辣根过氧化物酶标记的二抗室温孵育2 h。TBS漂洗10 min ×4次,ECL发光法显色,X-射线胶片曝光,蛋白表达条带应用Scoin Image 软件进行灰度分析。
1.7统计学方法 采用SPSS11.5软件进行单因素方差分析。
2 结 果
2.1MTT检测结果 25 μmol/LAβ25~35与大鼠海马神经细胞共同培养36 h 后,其存活率较对照组下降了52.5%。预先加入1、2 μmol/L和4 μmol/L小檗碱可显著提高细胞存活率至62.0%、67.6%和75.9%(P<0.05,P<0.01),随着剂量的增加,细胞存活率的提高有增强的趋势。见表1。
2.2小檗碱对神经元早期凋亡变化的影响 与对照组比较,模型组细胞早期凋亡率明显升高(18.58%±10.03% vs 3.02%±1.04%,P<0.01);与对照组比较,2 μmol/L及4 μmol/L小檗碱组细胞早期凋亡率明显降低(13.31%±3.98%,P<0.05,4.93%±2.96%,P<0.01)。1 μmol/L小檗碱组凋亡率无明显改变(17.74%±6.70%,P>0.05)。
2.3小檗碱对AD 模型神经元 Cleaved Caspase-3 蛋白表达的影响 由图1 可见,对照组细胞无活化的Caspase-3 蛋白表达,而模型组细胞Cleaved Caspase-3蛋白表达明显;小檗碱组均能抑制异常活化的Caspase-3 蛋白表达。与β-actin 的光密度比值统计分析显示,1 μmol/L、2 μmol/L和4 μmol/L小檗碱分别使Aβ25~35诱导的海马神经元Cleaved Caspase-3蛋白表达降低了30.4%、41.2%和 63.1%。
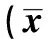
表1 小檗碱对Aβ25~35诱导的海马神经元光吸光度(A)值及细胞存活率的影响±s)

1~5:对照组,模型组,1、2、4 μmol/L小檗碱组
3 讨 论
利用Aβ诱导小鼠或大鼠海马及大脑皮层神经元或PC12细胞建立AD 的细胞模型广泛用于AD的实验研究〔4〕。该实验用浓度为 25 μmol/L的Aβ25~35与大鼠海马神经元共同培养36 h 较好地建立了AD 的细胞模型。
目前临床上,在AD的治疗中尚无特殊有效的药物。减少Aβ的生成或拮抗Aβ 的毒性是一种很重要的治疗策略。长期以来对小檗碱生化、药理,临床的研究,证明它是一种毒副作用小、具有广泛用途的药物,它除了具有抗菌、抗炎、抗疟作用外,还具有抗心律失常、抗肿瘤等活性〔5〕。近年来有研究显示,小檗碱对H2O2和6-羟基多巴胺损伤的PC12细胞发挥了明显的抗氧化作用〔6,7〕,能减少花萼海绵体诱癌素A(calyculin-A)诱导的HEK293 细胞Tau蛋白的磷酸化水平〔8〕。另外也有研究表明,在双侧海马注射Aβ1~40的AD模型大鼠中,小檗碱能够明显改善大鼠的空间学习记忆缺陷,并能增加IL-1β 和诱生型一氧化氮合酶(iNOS)的表达〔9〕。本实验发现不同浓度的小檗碱均能使AD 细胞模型神经元细胞存活率明显提高,4 μmol/L小檗碱能显著减少Aβ25~35损伤神经元早期凋亡。Caspase-3是所有细胞凋亡的最后执行者,是细胞凋亡蛋白级联反应的必经之路,随着这种蛋白酶的激活,神经元将不可逆性地发生凋亡〔10〕。本结果提示小檗碱能够抑制Aβ25~35损伤的神经元凋亡,拮抗Aβ 的毒性,具有一定的神经保护作用。因此,小檗碱有望成为治疗AD的一种药物。
4 参考文献
1Diogo CV,Machado NG,Barbosa IA,etal.Berberine as a promising safe anti-cancer agent- is there a role for mitochondria〔J〕? Curr Drug Targets,2011;12(6):850-9.
2Ji HF,Shen L.Berberine:a potential multipotent natural product to combat Alzheimer′s disease〔J〕.Molecules,2011;16(8):6732-40.
3Lin PC,Chang LF,Liu PY,etal.Botanical drugs and stem cells〔J〕.Cell Transplantation,2011;20(1):71-83.
4张云鹤,张一娜,刘 歆,等.Aβ1-42诱导原代海马神经细胞建立阿尔茨海默病细胞模型〔J〕.中国老年学杂志,2011;31(11):2027-9.
5Kulkarni SK,Ashish D.Berberine:a plant alkaloid with therapeutic potential for central nervous system disorders〔J〕.Phytotherapy Res,2010;24(3):317-24.
6Xu DH,Zhou CH.Antioxidative effects of berberine pre-treatment on hydrogen peroxide-induced PC12 cell toxicity 〔J〕.Neural Regen Res,2010;5(18):1391-5.
7Kwon IH,Choi HS,Shin KS,etal.Effects of berberine on 6-hydroxydopamine-induced neurotoxicity in PC12 cells and a rat model of Parkinson′s disease〔J〕.Neurosci Lett,2010;486(1):29-33.
8Yu G,Li Y,Tian Q,etal.Berberine attenuates calyculin A-induced cytotoxicity and tau hyperphosphorylation in HEK293 cells〔J〕.J Alzheimers Dis,2011;24(3):525-35.
9Zhu F,Qian C.Berberine chloride can ameliorate the spatial memory impairment and increase the expression of interleukin-1 beta and inducible nitric oxide syntheses in the rat model of Alzheimer′s disease〔J〕.BMC Neurosci,2006;7(1):78.
10张艳波,王 军,王 勇,等.小檗碱对大鼠脑缺血再灌注损伤脑组织bcl-2、caspase-3表达的影响〔J〕.中国老年学杂志,2011;31(13):2482-4.

