脑心通对实验性脑缺血大鼠梗死体积和神经巢蛋白的影响
杨宏武 楼小亮 胡雪勇 李晓萍 周征成 席秋江
(南昌大学第四附属医院神经内科,江西 南昌 330003)
传统观点认为,神经细胞不能再生,但越来越多的研究发现,成年哺乳动物脑组织中广泛存在神经干细胞(NSC),且具有多向分化潜能及自我更新的特性〔1,2〕。Nestin为第Ⅵ类中间丝蛋白,为大多数增生活跃的神经前体细胞表达,故被认为是NSC或神经前体细胞的标志之一〔3〕。本实验通过TTC染色测定脑缺血后大鼠梗死体积以及采用免疫组化法测定不同时间点BrdU阳性细胞及Nestin的表达,进一步来探讨缺血性脑卒中后NSC的增殖、分化情况及神经功能重建研究,了解脑心通胶囊是否能激活NSC,为缺血性脑血管病的治疗提供新思路。
1 材料与方法
1.1实验动物与分组 选用健康雄性SD大鼠,体重250~300 g,鼠龄7~8 w,购自北京华阜康生物科技有限公司,SPF级〔合格证号:scxk(京)2009-0004〕。实验分两部分进行:第一部分TTC染色及脑梗死体积测定,第二部分为BrdU及Nestin免疫组化。每一部分实验使用SD大鼠68只,随机分成四组:假手术组(8只);MCAO模型组(20只);MCAO+脑心通胶囊低剂量组(20只);MCAO+脑心通胶囊高剂量组(20只),两部分实验分组相同。每组再按照脑缺血再灌注(IR)后第3天、第7天、第14天和第21天分为四个时间点,模型组、脑心通低剂量组和脑心通高剂量组每个时间点各5只SD大鼠,而假手术组作为对照组,因不造成大脑中动脉闭塞(MCAO),故每个时间点各2只SD大鼠。
1.2动物模型制作 参照Koizumi等〔4〕线栓法并进行部分改良,使用购买的特制MCAO线栓(北京沙东生物技术有限公司),具体如下:将SD大鼠称重后按0.3 ml/100 g剂量腹腔注射10%水合氯醛麻醉,将其仰卧姿势固定在手术台上,取颈部正中切口,分离肌肉组织,暴露颈部动脉,小心剥离右侧颈总动脉、颈内动脉、颈外动脉及伴行的迷走神经,以丝线结扎右颈总动脉近心端、右颈外动脉,颈总动脉远心端近分叉处置一根线,不要系紧,动脉夹夹闭颈内动脉(ICA)近分叉处,在距颈总动脉分叉10 mm处剪一小口,将栓线插入到ICA,用绕在颈总动脉远心端的细线轻轻系牢拴线,松开ICA上的动脉夹,用镊子轻推栓线,将距头端20 mm的黑色标记送入分叉处,遇到轻微阻力时停止,并稍微回拉约1~2 mm,2 h后小心抽出栓线进行缺血再灌注,实验鼠麻醉清醒后按Berderson等〔5〕评分法进行神经功能评分。假手术组仅将栓线插至颈总动脉内,栓线深度小于10 mm,不阻断大脑中动脉血流。
1.3BrdU和脑心通给药 脑心通胶囊由黄芪、赤芍、丹参、川芎、桃仁、红花、水蛭等十六味中药制成的纯中药制剂,陕西步长制药有限公司生产,生产批号:120206。将胶囊中的脑心通粉末溶于蒸馏水中配成溶液,浓度为5 g/100 ml,根据人类和大鼠用药比例进行换算,确定脑心通高剂量组实验鼠每次按50 mg/100 g灌胃给药,2次/d,脑心通低剂量组实验鼠按每次25 mg/100 g灌胃给药,2次/d,模型组以蒸馏水灌胃。将BrdU粉末按10 mg/ml溶解于生理盐水中,置4℃冰箱备用。根据实验鼠体重,各组试验鼠在处死前2 d即造模后第1、2天,第5、6天,第12、13天,第19、20天分别按100 mg/kg剂量腹腔注射,2次/d。
1.4TTC染色 缺血再灌注后第3、7、14、21天,将实验鼠麻醉后迅速断头取脑,切除嗅球和低位脑干,标本放置于-20℃冰箱内稍冷冻后取出,自前脑额极起向后连续切片,一般切成5~6 μm厚度相近的冠状脑切片。将脑片置于2%TTC溶液中,37℃恒温箱中避光孵育30 min。正常脑组织可染成深红色,梗死灶为白色,数码照相机拍照。所得图片用Image-pro plus6.0图像分析软件计算脑梗死体积〔6〕。
1.5免疫组织化学方法 大鼠用10%水合氯醛腹腔注射麻醉,用4℃ 4%多聚甲醛固定液250 ml灌流固定,断头取脑,脑组织用4℃ 4%多聚甲醛溶液固定约12 h,后转入蔗糖(4℃)溶液中,当脑组织沉入蔗糖溶液底部后行恒冷箱冰冻切片,参考《大鼠脑立体定向图谱》,以前囟后3.14~4.52 mm为海马区部位,前囟后0.3~1.2 mm为侧脑室连续冠状切片,切片以0.1%多聚赖氨酸处理。用0.01 mol/L PBS漂洗3次,每次20 min后,加入0.3%TritonX-100/PBS液中破膜及0.3% H2O2中去除过氧化物酶,切片标本放置30 min。2N HCL 30 min后0.01 mol/L PBS漂洗3次,每次10 min。含2%正常羊血清(NGS)和3% BSA的0.01 mol/L PBS ,室温30 min;加入小鼠抗Brdu (1∶50 ZM-0013中杉金桥)和兔抗Nestin(1∶50 BA-1289 BOSTER)4℃孵育24 h,注意避光。0.01 mol/L PBS漂洗3次,每次10 min。加入山羊抗小鼠 IgG/FITC(1∶100 ZF-0312中杉金桥)和山羊抗兔 IgG/TRITC(1∶100 ZF-0316中杉金桥),室温孵育2 h,注意避光。0.01 mol/L PBS漂洗3次,每次10 min,注意避光。10%甘油/PBS封片,注意不要产生气泡,将封好的切片放入切片盒,避光荧光显微镜下拍照保存。各组另取两张片为阴性对照,一张不加入一抗,另一张不加入二抗,余步骤同上。切片标本在荧光显微镜统一放大倍数(10×20)下,设置同样面积的检测窗口,随机挑选5个视野,分别测其缺血侧SGZ、SVZ区的BrdU阳性细胞和Nestin的荧光强度值并求均值,作为此张片的平均荧光强度值。
1.6统计学方法 用SPSS16.0软件进行方差分析。
2 结 果
2.1TTC染色及脑梗死体积测定 造模后实验鼠缺血侧大脑半球均出现不同程度的梗死,TTC染色为大小不等的苍白病灶,而对侧正常脑组织被染成均匀红色(图1)。模型组、脑心通低剂量组及脑心通高剂量组大鼠不同时间点脑梗死体积,从表1可以看出,IR后第7天各组大鼠脑梗死体积最大;各组间不同时间点的变化趋势也不一样,差异有统计学意义(P<0.05)。脑心通高、低剂量组与模型组梗死体积相比较有显著差异(P<0.05),不同剂量脑心通组间差异显著(P<0.01)。

图1 各组大鼠第7天脑组织TTC染色
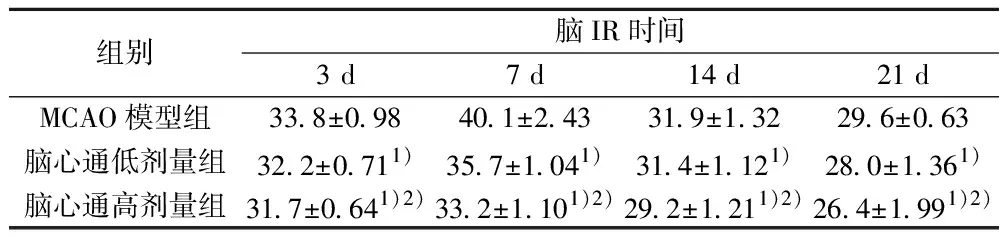
组别脑IR时间3 d7 d14 d21 dMCAO模型组33.8±0.9840.1±2.4331.9±1.3229.6±0.63脑心通低剂量组32.2±0.711)35.7±1.041)31.4±1.121)28.0±1.361)脑心通高剂量组31.7±0.641)2)33.2±1.101)2)29.2±1.211)2)26.4±1.991)2)
2.2各组实验鼠不同时间点BrdU阳性细胞和Nestin的表达 免疫荧光染色显示,脑缺血再灌注损伤后,模型组、脑心通低剂量组及脑心通高剂量组实验鼠缺血侧SVZ及SGZ区域可见BrdU标记的阳性细胞和Nestin的表达,而假手术组中未发现表达(图2)。除假手术组外,各组实验鼠不同时间点BrdU阳性细胞和Nestin的平均荧光强度值发生变化,且呈现一定的规律性:IR后第3天平均荧光强度值较低,但随时间逐渐升高,至第7天时达到最高,后又逐渐降低,至第14天时低于第7天,而第21天又较第14天低,但仍高于第3天。见表2。各组内不同时间点BrdU阳性细胞和Nestin的平均荧光强度值差异有统计学意义(P<0.01),但模型组与脑心通低剂量组、脑心通高剂量组之间比较,未发现脑心通对缺血侧BrdU阳性细胞和Nestin的表达有促进作用,差异无统计学意义(P>0.05);脑心通高、低剂量组之间比较差异亦无统计学意义(P>0.05)。
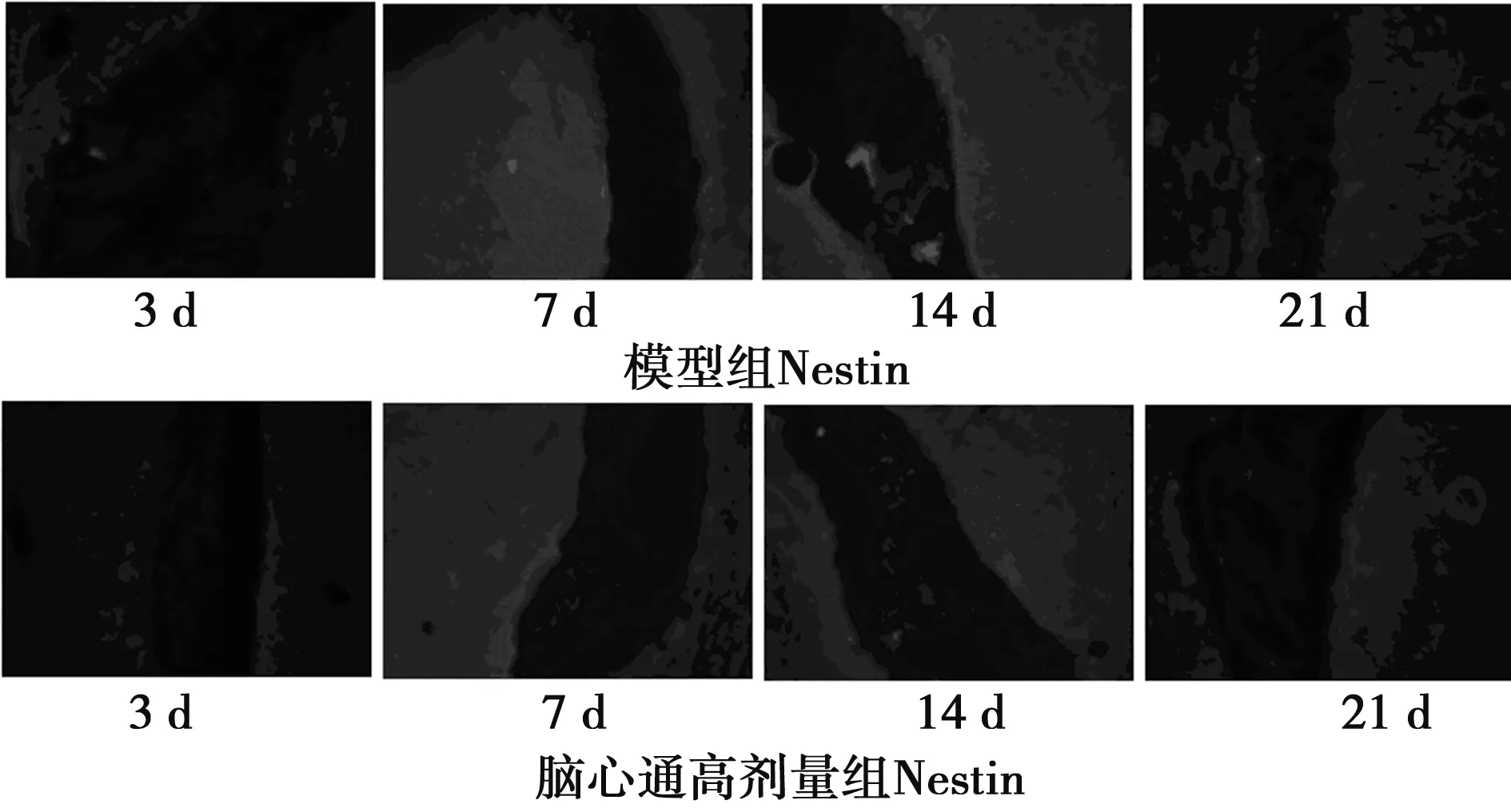
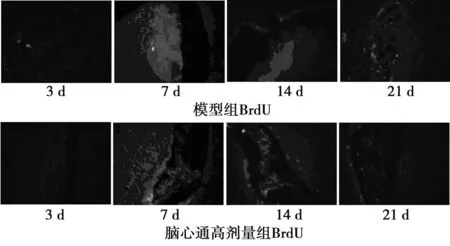
图2各组脑组织SVZ区Nestin、BrdU荧光图片(×200)
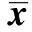
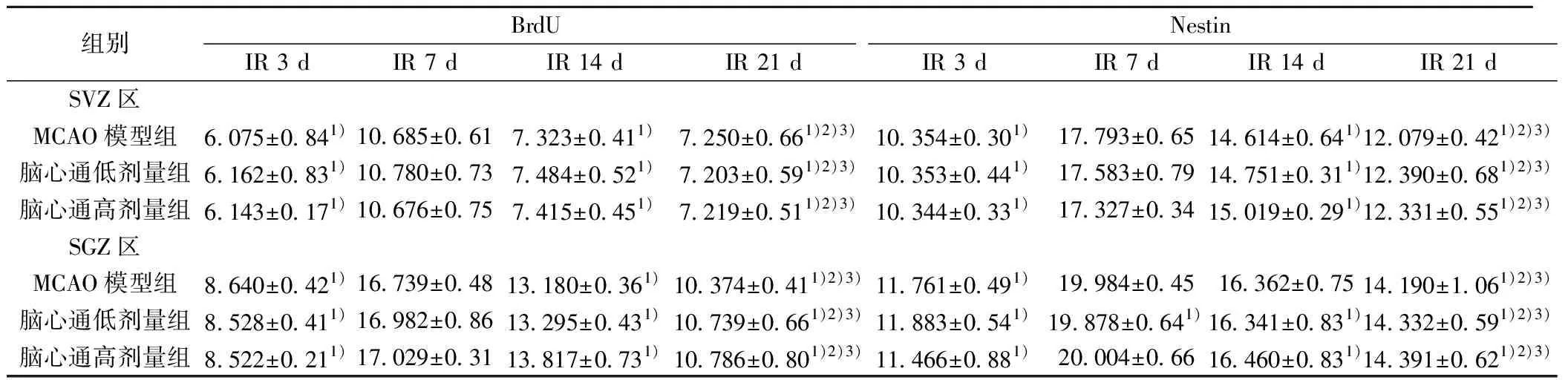
组别BrdUIR 3 dIR 7 dIR 14 dIR 21 dNestinIR 3 dIR 7 dIR 14 dIR 21 dSVZ区MCAO模型组6.075±0.841)10.685±0.617.323±0.411)7.250±0.661)2)3)10.354±0.301)17.793±0.6514.614±0.641)12.079±0.421)2)3)脑心通低剂量组6.162±0.831)10.780±0.737.484±0.521)7.203±0.591)2)3)10.353±0.441)17.583±0.7914.751±0.311)12.390±0.681)2)3)脑心通高剂量组6.143±0.171)10.676±0.757.415±0.451)7.219±0.511)2)3)10.344±0.331)17.327±0.3415.019±0.291)12.331±0.551)2)3)SGZ区MCAO模型组8.640±0.421)16.739±0.4813.180±0.361)10.374±0.411)2)3)11.761±0.491)19.984±0.4516.362±0.7514.190±1.061)2)3)脑心通低剂量组8.528±0.411)16.982±0.8613.295±0.431)10.739±0.661)2)3)11.883±0.541)19.878±0.641)16.341±0.831)14.332±0.591)2)3)脑心通高剂量组8.522±0.211)17.029±0.3113.817±0.731)10.786±0.801)2)3)11.466±0.881)20.004±0.6616.460±0.831)14.391±0.621)2)3)
3 讨 论
近年来,NSC的研究成为关注的重点,正常生理情况下,这些细胞处于静止状态,当出现缺血等脑损伤后,它们能被激活,在损伤原位或异位进行增殖后,在趋化因子的帮助下,迁移到损伤部位并进行分化〔7,8〕,参与神经再生及功能重建,但这种代偿反应的作用不明显,因此充分诱导内源性NSC活化增殖,定向分化为神经元,可能是促进脑缺血损伤后神经功能重建的有效途径之一,研究也证实,增强脑IR后神经发生可以促进神经功能恢复〔9〕。
众多国内学者报道,传统中医药如黄芪、川芎等具有促进神经干细胞增殖的作用〔10,11〕,但是不是所有的中成药都具有相同的作用呢?笔者选用脑心通胶囊来进行本次实验,它是由黄芪、赤芍、丹参、川芎、桃仁、红花、水蛭等十六味中药制成的纯中药制剂,方中以黄芪为君药,大补元气,通过补气使元气充盛,发挥益气活血之效;臣药是虫类药水蛭、地龙、全蝎,其药性善走,破血逐瘀,能搜剔络中之邪,发挥通经透络之功效;佐药为当归、川芎、丹参、赤芍、红花等九味活血化瘀药,共助君药及臣药疏通瘀阻之力;桑枝、桂枝针对上肢半身不遂,可引药直达病所,温经通脉;牛膝逐瘀血,通经络,引血下行共为使药〔12〕;诸药配伍,主次得当,标本兼治,益气活血,化瘀通络,能抑制血小板的聚集,防止血栓形成,对脑组织具有保护作用。动物实验也证实,脑心通胶囊能减少脑缺血大鼠梗死体积,对大鼠局灶性脑IR后神经细胞凋亡有保护作用〔13~15〕。本实验显示不同剂量脑心通可减少IR大鼠的梗死体积,且存在量效关系。但是,脑心通是否能促进脑缺血损伤后NSC的增殖、分化,需要继续通过动物实验来明确。
本文结果表明模型组、脑心通低剂量组和脑心通高剂量组BrdU阳性细胞及Nestin在第3天已出现表达,不同时间点的BrdU阳性细胞和Nestin平均荧光强度值发生变化,第7天时为最高,后逐渐下降,第14天时低于第7天,第21天又较第3天时低,这和其他研究结果基本一致〔16〕。而假手术组中,本文在海马齿状回及室管膜区未发现有BrdU阳性细胞和Nestin表达。另外,我们通过给予不同剂量的脑心通进行灌胃给药,而模型组给予蒸馏水灌胃,三组之间任意两组进行比较,BrdU阳性细胞和Nestin的平均荧光强度值无明显差异,未发现脑心通胶囊具有促进IR后NSC增殖的作用。这与国内其他学者的研究结果不一致,分析可能的原因有:①本文采用的是灌胃给药方式,胶囊中的药物粉末溶于蒸馏水再按不同剂量进行灌胃,经过胃吸收进入血液后透过血脑屏障的药物成分有限;②实验的样本量还不够大。当然,也不排除脑心通胶囊不具备促进IR后NSC增殖的作用。
综上所述,脑IRI后,NSC能发生反应性增殖,但作用有限,外源性干细胞又受到干细胞来源不足、移植成功率低、免疫排斥和社会伦理学等问题的限制。因此,本文希望能发现更切实有效的方法来促进内源性NSC的增殖、分化,从而恢复脑缺血损伤导致的神经功能缺损;我们也将通过更多的动物实验来进一步明确传统中医药在神经干细胞领域所发挥的作用。
4 参考文献
1Ito Y,Tanaka H,Okamoto H,etal. Characterization of neural stem cells and their progeny in the adult zebrafish optic tectum〔J〕. Dev Biol,2010;342(1):26-38.
2Okuno K,Ohta S,Kato H,etal. Expression of neural stem cell markers in malignant rhabdoid tumor cell lines〔J〕. Oncol Rep,2010;23(2):485-92.
3Gilyarov AV. Nestin in central nervous system cells〔J〕.Neurosci Behav Physiol,2008;38(2):165-9.
4Koizumi J,Yoshida Y,Nakazawa T,etal. Experimental studies of ischemia Brain Edema:a new experimental model of cerebral embolism in rats in which recirculation can be introduced in the ischemia area〔J〕.Jpn J St roke,1986(8):1-8.
5Bederson JB,Pitts LH,Tsuji M,etal. Rat middle cerebral artery occlusion: Evaluation of the model and development of a neurologic examination〔J〕.Stroke,1986;17(6): 472-6.
6王荣亮,刘小蒙,张 营,等.大鼠局灶性脑缺血后神经功能评分与脑梗死体积相关性分析〔J〕.首都医科大学学报,2013;34(2):69-74.
7Emsley JG,Mitchell BD,Kempermann G,etal. Adult neurogenesis and repair of the adult CNS with neural progenitors,precursors,and stem cells〔J〕. Prog Neurobiol,2005;75(5):321-41.
8Christophidis LJ,Gorba T,Gustavsson M,etal. Growth hormone receptor immunoreactivity is increased in the subventricular zone of juvenile rat brain after focal ischemia: a potential role for growth hormone in injury-induced neurogenesis〔J〕. Growth Horm IGF Res,2009;19(6):497-506.
9Zhang ZG,Chopp M. Neurorestorative therapies for stroke:underlying mechanisms and translation to the clinic〔J〕.Lancet Neurol,2009;8(5):491.
10张 力,罗秀成,杨石照,等. 增强大鼠神经干细胞生物活性的黄芪注射液〔J〕.中国组织工程研究,2013;17(27):5057-62.
11祁存芳,刘 勇,田玉梅,等. 川芎嗪对成体大鼠脑缺血再灌注损伤后海马齿状回细胞增殖的影响〔J〕.西安交通大学学报:医学版,2007;28(2):142-5.
12赵 涛,薛人珲,刘 娜,等. 脑心通胶囊的组方分析〔J〕.光明中医,2012;27(12):2576-8.
13郭合伏. 脑心通对大鼠脑缺血后神经细胞凋亡的影响〔J〕.中外医疗,2012;31(21):27-9.
14曲立新,宿少华,杨丽玲,等. 脑心通对局灶性脑缺血再灌注损伤大鼠的保护作用〔J〕.山东大学学报(医学版)2010;48(9):49-52.
15张微微,李远征,裘林秋,等. 步长脑心通胶囊对大鼠脑缺血再灌注损伤的神经保护作用〔J〕.临床神经病学杂志,2006;19(2):118-20.
16Zhang RL,Zhang ZG,Roberts C,etal. Lengthening the G(1)phase of neural progenitor cells is concurrent with an increase of symmetric neuron generating division after stroke〔J〕.Cereb Blood Flow Metab,2008;28(3):602-11.

