外源性碱性成纤维细胞生长因子对Ⅲ级静脉炎模型兔VEGF表达的影响
黄利全 陈 黎 毛宇飞 姜丽萍 陈桂园
(金华职业技术学院医学院,浙江 金华 321017)
碱性成纤维细胞生长因子(bFGF)能促进手术、外伤、炎症、溃疡等导致的组织和上皮的修复与再生,促进伤口的无瘢痕复原〔1,2〕。大量研究证实,bFGF在创伤领域疗效显著,对新生血管的形成起效较快〔3〕,对心脑血管的损伤具有保护作用,但对静脉炎症导致血管损伤的作用未见报道。临床资料显示,静脉炎是患者输液反应的常见并发症,发生率高达80%〔4〕,其中Ⅲ级静脉炎发生率为21.6%〔5〕。一旦发生Ⅲ级静脉炎,患者血管严重损伤,甚至导致菌血症的发生〔6,7〕,而当前对重度静脉炎的治疗效果并不理想。本研究探讨bFGF对Ⅲ级静脉炎修复的作用。
1 材料与方法
1.1试剂与仪器 一次性静脉留置针(型号24G×19 mm)及3M透明敷贴分别由美国BD公司及3M公司生产;20%甘露醇产自华润双鹤药业股份有限公司;bFGF购自美国PeproTech 公司,50 μg/支。Leica DM 2000光学显微镜产自德国Leica公司; UCMOS09000KPA显微镜CCD成像系统产自杭州图谱光电科技有限公司。
1.2建模与分组 选健康新西兰同种家兔42只,体重2.5~3.0 kg,雌雄各半,由金华市实验动物中心提供〔生产许可证号:SYXK(浙)2010-0151〕,单笼饲养,随机编号、排序。按随机数字表法分5组:bFGF组、硫酸镁组、生理盐水组各12只;正常组、模型组各3只。正常组行剃毛和双耳包扎,余4组取兔双耳外缘静脉为实验血管,由专人统一操作,用24G留置针一次穿刺成功后3M透明贴及自制兔套固定。每日在15 min内推注20%甘露醇10 ml,常规肝素盐水2 ml(25 U/ml)正压封管,观察穿刺血管情况,形成Ⅲ级静脉炎为建模成功。预实验示建模成功时间为5 d,故留置5 d后拔管,未达Ⅲ级静脉炎者废弃、重新补入。
1.3干预与标本制作 建模成功后拔静脉留置针, bFGF组于拔管日在炎症静脉右侧旁开0.25 cm处皮下注射bFGF 0.8 μg/kg 1次。硫酸镁组及生理盐水组分别用50%硫酸镁或生理盐水的六层湿纱布(以不滴水为度)覆盖静脉炎局部,3次/d,15 min/次,一旦纱布变干马上更换。正常组、模型组于拔管日,余三组在用药后24、72、120、168 h分别提取标本。各时相各取3只家兔在苯巴比妥钠腹腔麻醉下提取活体标本,以穿刺点及留置针套管末端为中心,截取长、宽各0.5 cm的两段标本,经10%中性甲醛液固定24 h 后, 常规制蜡,连续切片。每张切片厚度约2~5 μm,其中第4张切片行血管内皮生长因子(VEGF)检测,前后连续的5张切片行HE染色。
1.4病理观察与免疫组化检测 HE染色后由病理科医生镜下观察血管内皮肿胀、炎细胞浸润、管壁增厚、纤维增生、血栓形成等情况。
一抗VEGF兔抗多克隆抗体,二抗聚合HRP标记抗兔IgG,SV试剂盒(含DAB显色剂)均购自武汉博士德生物技术公司。一抗稀释倍数为1∶100,严格按照试剂说明书步骤操作。免疫组化结果判定, VEGF阳性表达位于细胞质,出现明显的黄色和棕黄色为阳性细胞。阴性对照以磷酸盐缓冲液(PBS)代替一抗,二氨基联苯胺(DAB)显色,苏木素复染。阳性细胞计数参照王艳艳等〔8〕的观察法,每组随机选取5张切片,每张切片随机选取5个不重叠的高倍视野(×200),计数视野中的阳性细胞总数,计算每组平均每个高倍视野中的阳性细胞数。
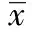
2 结 果
2.1病理学表现 bFGF组用药后24 h血管腔内少见血栓,内皮细胞增生明显;120 h新生的内皮细胞相互连接成完整的内皮,血管腔内血栓及炎性渗出物吸收,基本恢复正常。硫酸镁组120 h血管腔内炎性细胞减少,新生内皮细胞少;168 h炎症消退较明显。生理盐水组120 h管腔内炎性细胞仍明显,168 h炎症略有消退。正常组血管壁光滑,无炎症细胞浸润。模型组血管壁被大量淋巴细胞、组织细胞侵蚀,肌纤维母细胞增生,血管腔内混合血栓形成,管腔周围炎性细胞浸润(图1)。
2.2VEGF蛋白的表达 VEGF阳性表达主要集中在内皮细胞的胞质中。bFGF组VEGF表达强阳性,24 h最高,72~120 h表达处于一个较高水平,168 h VEGF阳性表达下降,与模型组、硫酸镁组及生理盐水组间两两比较均有统计学差异(P<0.05)。硫酸镁组VEGF表达量24 h较多,其余时相与生理盐水组相近均为阴性表达,与bFGF组比较有统计学差异(P<0.05)。正常组、模型组VEGF弱阳性表达,两组比较差异无统计学意义(P>0.05)(图2,表1)。

A:正常组;B:模型组;C:bFGF组(24 h);D: bFGF组(120 h);E:硫酸镁组(120 h);F:生理盐水组(120 h)

图2 静脉炎各组VEGF表达情况(SP,×200)
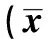

组别24 h72 h120 h168 hbFGF组73.40±1.821)2)50.40±5.131)2)57.20±5.811)2)37.20±2.781)2)破酸镁组32.00± 8.091)20.00±1.2315.80±1.4819.40±2.51生理盐水组16.60±3.5820.20±2.6821.80±0.8411.80±1.30F值158.6207.173205.131162.382 P值0.0000.0090.0000.000
3 讨 论
Ⅲ级静脉炎属于重度静脉炎,肉眼可见输液部位疼痛伴有发红或水肿,可触及条索状静脉,临床处理较棘手。本研究采用静脉留置针的机械刺激与20%甘露醇的高渗透刺激双重作用下诱导建立除疼痛因素外的Ⅲ级静脉炎动物模型,为该级静脉炎的病理观察及不同药物的干预研究提供了可能。实验发现双重因素作用下Ⅲ级静脉炎的形成时间约为5 d,与梁月香等〔9〕的临床观察结果相似。此时除肉眼变化外病理可见血管腔内大量炎症细胞浸润,混合血栓形成,内皮细胞坏死脱落,血管壁增厚。因正常内皮细胞具有抗炎抗凝属性〔10〕,一旦受损即致炎症反应发生及血栓形成,故损伤部位血管的再内皮化是静脉炎修复的关键。
本研究结果显示bFGF加速了修复的进程,缩短了治愈时间。尽管正常血管内膜损伤时也能分泌bFGF,但分泌量不足,修复进程缓慢需1~2 w。当加用外源性bFGF时,增加了局部bFGF含量并通过激活内源性生长因子活性或上调生长因子受体表达〔11〕,使VEGF分泌量骤升。VEGF作为促血管生成的生长因子,受缺氧及其他因素的影响,由内皮细胞、成纤维细胞、血小板、中性粒细胞及巨噬细胞等分泌产生,具有促进内皮细胞有丝分裂、趋化等功能。Ⅲ级静脉炎时,局部血管缺氧,再加bFGF与VEGF的正协同作用〔12〕,加速了血管内膜的内皮化,抑制了血栓的形成〔13〕。
本文VEGF的表达高峰时间与Brown等〔14〕和Frank等〔15〕报道VEGF表达高峰时间与损伤程度相关的结果相符,可见Ⅲ级静脉炎损伤较严重。本文中bFGF组高水平的VEGF维持时间显著长于硫酸镁组,分析原因可能与内源性bFGF迅速处于低值有关〔16,17〕,此时主要依赖外源性bFGF诱导VEGF表达。尽管硫酸镁组VEGF的整体表达量不高,但静脉炎症消退仍较明显,其作用机制可能是通过其高渗性及Mg2+扩张局部血管而达到消肿作用。本实验中生理盐水组VEGF分泌量低下,这与文献结果认为损伤早期以VEGF表达为主〔18〕不符合,分析原因可能与炎症早期Ⅲ级静脉炎损伤严重,导致VEGF表达欠佳有关,又可能与损伤晚期以内源性bFGF表达为主有关〔18〕。
综上所述,bFGF与硫酸镁对Ⅲ级静脉炎均有修复作用,bFGF优于硫酸镁。其作用机制可能是Ⅲ级静脉炎时血管内皮细胞严重受损,激活了巨噬细胞,导致炎症细胞浸润、内皮细胞坏死脱落。bFGF通过激活内源性生长因子活性或上调生长因子受体表达, 进而协同VEGF共同发挥促进血管内皮细胞增生的功能。
4 参考文献
1Sadanori Akita, Kozo Akino, Akiyoshi Hirano.Basic fibroblast growth factor in scarless wound healing〔J〕. Adv Wound Care,2013;2:44-9.
2Akasaka Y, Ono I, Yamashita T,etal. Basic fibroblast growth factor promotes apoptosis and suppresses granulation tissue formation in acute incisional wounds〔J〕.J Pathol,2004;203:710-20.
3Ogawa K, Asonuma K, Inomata Y,etal. The efficacy of prevascularization by basic FGF for hepatocyte transplantation using polymer devices in rats〔J〕.Cell Transplant,2001;10:7239.
4司马欣元.输液致静脉炎的防治和护理进展〔J〕.解放军护理杂志,2009;26(8A):48-9.
5Uslusoy E, Mete S. Predisposing factors to phlebitis in patients with peripheral intravenous catheters:a descriptive study 〔J〕. Am Acad Nurse Prac,2008;20:172-80.
6Lee WL. Soft tissue infections related to peripheral intravenous catheters in hospitalized patients: a case-control study〔J〕.J Hospital Inf,2010;76:124-9.
7陈莲花.循证护理在预防静脉留置针并发症中的应用〔J〕.护士进修杂志,2009;24(1):42.
8王艳艳,张纯瑜,孙 艳,等.氧化应激反应及细胞凋亡与早期压疮形成的关系研究〔J〕.中华护理杂志,2011;46(5):508-9.
9梁月香,卞素琴.使用动静脉留置针滴甘露醇的护理体会〔J〕.护士进修杂志,1997;12(9):39.
10Fuke S, Maekawa K, Kawamoto K,etal. Impaired endothelial vasomotor function after sirolimus-eluting stent implantation〔J〕. Circ J,2007;71:220-5.
11Boulfon AJM. Clinical promise of becaplermin gel:diabetic foot ulcer 18th Amual Meeting of the European〔J〕. Tissue Rapair Soc,1998;37:27-30.
12胡以信,袁 杰,邹 勇,等.富血小板血浆在促进兔烫伤创面愈合中 bFGF VEGF 的表达及意义〔J〕.重庆医学,2013;42(35):4297-8.
13邢丽菊.复脉膏防治化疗性静脉炎的临床研究及对VEGF、EGFR影响的实验研究〔D〕.南京:南京中医药大学,2012.
14Brown LF, Yeo KT, Berse B,etal. Expression of vascular permeability factor (vascular endothelial growth factor) by epidermal keratinocytes during wound healing〔J〕. J Exp Med,1992;176(5):1375-9.
15Frank S, Hubner G, Breier G,etal. Regulation of vascular endothelial growth factor expression in cultured keratinocytes. Implications for normal and impaired wound healing〔J〕. J Biol Chem,1995,26;270(21):12607-13.
16Nissen NN, Polverini PJ, Koch AE,etal. Vascular endothelial growth factor mediates angiogenic activity during the proliferative phase of wound healing〔J〕. Am J Pathol,1998;152:1445-52.
17Nissen NN, Polverini PJ, Gamelli RL,etal. Basic fibroblast growth factor mediates angiogenic activity in early surgical wounds〔J〕. Surgery,1996;119(4):457-65.
18Bao P, Kodra A,Tomic-Canic M,etal. The role of vascular endothelial growth factor in wound healing〔J〕. J Surg Res,2009;153(2):347-58.

