细胞穿膜肽抗人膀胱癌单克隆抗体载丝裂霉素白蛋白纳米微球三联体的靶向性和穿膜活性研究
李云龙,严春寅,李巧星,王伟录,王勇,郑红芳,周洁
(1.江苏大学附属昆山医院 泌尿外科,江苏 昆山 215300; 2.苏州大学附属第一医院 泌尿外科,江苏 苏州 215000; 3.广西医科大学第一附属医院 泌尿外科,广西 南宁 530021)
细胞穿膜肽(TAT-EGFP)是一种能够促进多种物质穿过细胞膜的小分子多肽,白蛋白载药微球具有载药量大、缓慢释放和无毒等特性,单克隆抗体能够实现特异性靶向结合作用。结合以上三者的长处,建立TAT-EGFP-膀胱癌单克隆抗体(BDI-1)-载药白蛋白纳米微球(MMC-Ns)三联体TAT-EGFP-BDI-1-MMC-Ns,可以实现药物缓释、靶向、促进药物内化进入肿瘤细胞的肿瘤细胞内化疗,从而达到高效低毒的治疗效果。有关三联体对人膀胱癌细胞系EJ细胞靶向结合及穿膜活性的研究,国内外均未见报道。作者就TAT-EGFP-BDI-1-MMC-Ns三联体对EJ细胞靶向结合及其穿膜活性的研究报道如下。
1 材料与方法
1.1 材料
1.1.1 试剂与材料
TAT-EGFP(本课题组构建制备),MMC-NS(本课题组采用交联固化法制备),N-琥珀酰亚胺基-3-(2-毗啶基二琉)丙酸脂(SPDP, Sigma公司),二硫苏糖醇(DTT,德国Meek公司),Amiga Uhm-15超滤离心管((Millipom公司),DyLightTM549标记的羊抗小鼠IgG (H+L)抗体(EarthOx公司),BDI-1(广西医科大学附属肿瘤医院馈赠)。
1.1.2 主要仪器
高速台式低温离心机(美国BIO-BAD公司),OLYMPUS荧光显微镜(日本),激光共聚焦显微镜(LSCM,FV100 IX81,德国OLYMPUS公司),JEOL扫描电镜JSM-T300型(日本),透视电子显微镜(TEM,日本JEO公司)。
1.2 方法
1.2.1 慢病毒红色荧光蛋白感染EJ细胞
实验前1 d,接种1×105个EJ细胞及293 T细胞于12孔培养板中,第2天细胞贴壁后,每孔换成1 ml新鲜1640完全培养基,加入0.5 μl聚凝胺(polybrene)混匀,按MOI高低组加入不同量病毒,进行病毒感染。取-70 ℃保存的病毒在冰上融化,无菌操作。在目的细胞和对照细胞中分别加入50 μl HBSS液稀释好的病毒,培养液总体积为1 000 μl,加入病毒后轻轻晃动培养板,混匀后置37 ℃培养箱中培养。如慢病毒对细胞有明显毒性作用,在感染8~12 h后,更换新鲜完全培养基(1 600 μl·孔-1)后继续培养,如果有絮状沉淀先用D-Hanks液洗涤;如慢病毒对细胞没有明显毒性作用,4~6 h后补加入600 μl完全培养基继续培养。
1.2.2 TAT-EGFP-BDI-1-MMC-Ns三联体的制备
应用异型双功能交联剂SPDP的一次偶联法,进行蛋白间的连接,进行TAT-EGFP、BDI-1、MMC-Ns连接制备三联体。
1.2.2.1 制备TAT-EGFP(M=31 kD)的SPDP衍生物TAT-EGFP-PDP (1) 先将453 μg SPDP以无水乙醇溶解,再用0.22 μm微孔滤膜过滤。将冻干无菌的融合蛋白TAT-EGFP 1.5 mg,溶于2 ml 0.01 mol·L-1PBS(pH 7.5)中,在超净台内共同加入无菌小烧杯中,投料摩尔比SPDP∶TAT-EGFP=20∶1,磁力搅拌器室温搅拌反应30 min。(2) 搅拌后出现少量沉淀,10 000 r·min-1离心30 s;(3) 取上清,加pH 7.5、0.02 mol·L-1无菌PBS缓冲液10~12 ml,一同加至经体积分数75%酒精浸泡消毒的超滤离心管中,3 500×g、4 ℃离心15 min;(4) 重复步骤(3)3次,以去除多余的SPDP;(5) 所得超滤离心管中的液体即为TAT-EGFP-PDP,将液体浓缩至2.0 ml。
1.2.2.2 制备蛋白微球的SPDP衍生物MMC-NS-PDP (1) 经60Co辐照灭菌的MMC-NS 5 mg,溶于2 ml pH 7.5、0.01 mol·L-1无菌PBS缓冲液中,与经0.22 μm微孔滤膜先滤过除菌的466 μg SPDP(无水乙醇溶解,现用现配)共同加入小烧杯中,投料摩尔比SPDP∶MMC-NS=20∶1,室温搅拌反应30 min;(2) 搅拌后出现少量沉淀,10 000 r·min-1离心30 s;(3) 取沉淀,加pH 7.5、0.02 mol·L-1无菌PBS缓冲液1 ml混匀,12 000 r·min-1,离心2 min;(4) 重复步骤(3)3次,以去除多余的SPDP;(5)取沉淀即为MMC-NS-PDP,将其均匀分散于pH 7.5、0.02 mol·L-1无菌PBS缓冲液中。
1.2.2.3 制备BDI-1的SPDP衍生物BDI-1-PDP (1) 以0.22 μm微孔滤膜先滤过227 μg SPDP,再滤过膀胱癌单克隆抗体(BDI-1)0.025 ml,用2 ml pH 7.5、0.01 mol·L-1PBS稀释,在超净台内共同加入无菌小烧杯中,投料摩尔比SPDP∶TAT=20∶1,磁力搅拌器室温搅拌反应30 min;(2) 搅拌后出现少量沉淀,10 000 r·min-1离心30 s;(3) 取上清,加pH 4.5、0.01 mol·L-1醋酸盐(含0.15 mol·L-1NaCl)缓冲液10~12 ml,一同加入至超滤离心管中,3 500×g、4 ℃离心15 min;(4) 重复步骤(3)3次,以去除多余的SPDP;(5) 所得的超滤离心管中的液体即为BDI-1-PDP,将液体分散于无菌醋酸盐缓冲液(pH 4.5)中浓缩至1.0 ml。
1.2.2.4 BDI-1-SH的制备 在超滤浓缩至1 ml的BDI-1-PDP醋酸盐缓冲液(pH 4.5)中,加入15.4 mg DTT,再经0.22 μm微孔滤膜滤过除菌,使反应体系中DTT终浓度为50 mmol·L-1,室温轻轻搅拌30 min;搅拌后出现少量沉淀,10 000 r·min-1离心30 s;取上清,加pH 7.5、0.02 mol·L-1无菌PBS缓冲液10~12 ml,一同加入至超滤离心管中,3 500×g、4 ℃离心15 min;重复步骤(3)3次,以去除多余的DTT;所得的超滤离心管中的液体即为BDI-1-SH,加入pH 7.5、0.02 mol·L-1无菌PBS缓冲液中,将液体浓缩至2.0 ml。
1.2.2.5 制备TAT-EGFP-BDI-1-MMC-NS三联偶联物 将上述所得到的0.75 mg·ml-1的TAT-EGFP-PDP、2.5 mg·ml-1的MMC-NS-PDP和1 mg·ml-1的BDI-1-SH各2 ml混合,加入至同一个经高压灭菌的小烧杯室温搅拌30 min,将混合液倒入用经灭菌的小烧杯,用消毒后的锡箔纸遮盖杯口,置于外罩一个大一号的经灭菌烧杯置于4 ℃、磁力搅拌器低速搅拌过夜(≥16 h);将上步(2)中过夜搅拌中的液体15 000 r·min-1离心45 s,取沉淀用pH 7.5、0.02 mol·L-1无菌PBS离心洗涤3~4次,沉淀即为目的三联偶联物TAT-EGFP-BDI-1-MMC-NS。
1.2.3 激光共聚焦图像显微镜检测三联体的连接情况
取对数生长期EJ细胞并调节细胞密度至1×105个·ml-1,置培养皿中培养并进行爬片,6 h后PBS洗涤3次,加入200 μl无血清培养液,置于37 ℃的载物台上,调整激光共聚焦显微镜光电倍增管电压值,使细胞图像达到最清晰。
1.2.4 电子显微镜及激光共聚焦显微镜检测三联体图像的分析
取用同种培养液培养的同一批细胞,用同一批制备的三联体微球在同一时间分别进行激光共聚焦显微镜和电子显微镜检查。
2 结 果
2.1 慢病毒红色荧光蛋白感染人膀胱癌细胞株EJ人膀胱癌细胞
见表1。
表1加入病毒的滴度、MOI及体积

病毒滴度/TU·ml-1病毒加入量/μl感染体积/ml高MOI2.00E+09101低MOI2.00E+09201
2.2 三联体靶向结合的监测
2.2.1 激光共聚焦显微镜示三联体与人膀胱癌EJ细胞靶向结合
见图1。
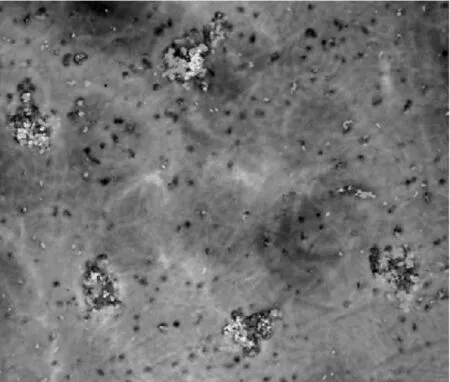
图1三联体与EJ细胞靶向结合三联体与转染了红色荧光蛋白的膀胱癌EJ(t)(红色)连接
2.2.2 扫描电镜示单纯微球和三联体与EJ人膀胱癌细胞的结合情况
见图2。

图2三联体与EJ人膀胱癌细胞的结合三联体靶向与EJ细胞结合,扫描电镜可见肿瘤细胞表面突起和微绒毛明显减少
2.3 三联体穿膜活性监测
2.3.1 激光共聚焦显微镜和透射电镜对三联体穿膜活性的监测
见图3。
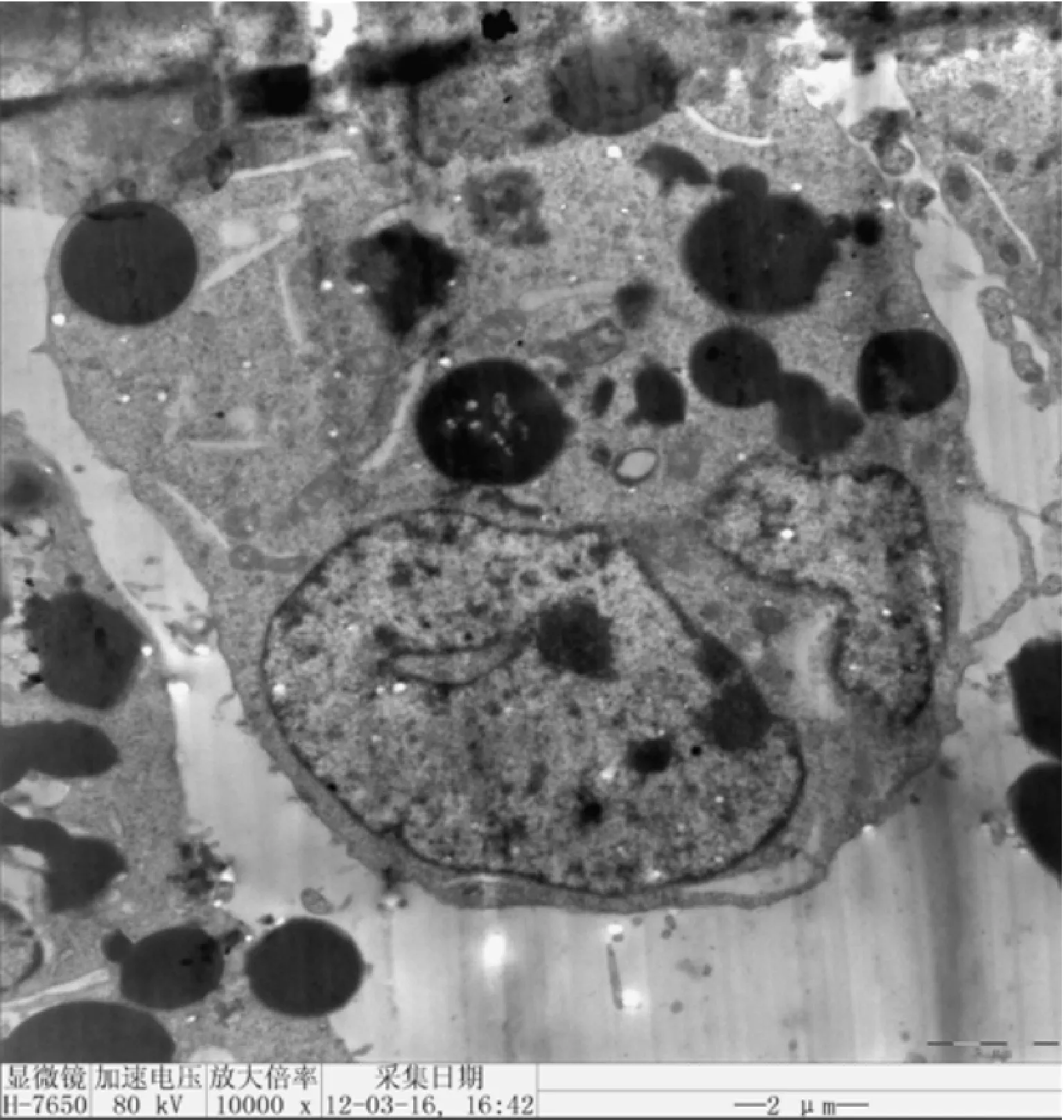
图3三联体穿膜活性的监测三联体内化入EJ人膀胱癌细胞,透射电镜可见载丝裂霉素纳米微球进入肿瘤细胞内部
2.3.2 三联体穿膜活性的动态监测
见图4。
2.3.3 透射电镜EJ人膀胱癌细胞膜微绒毛监测
见图5。
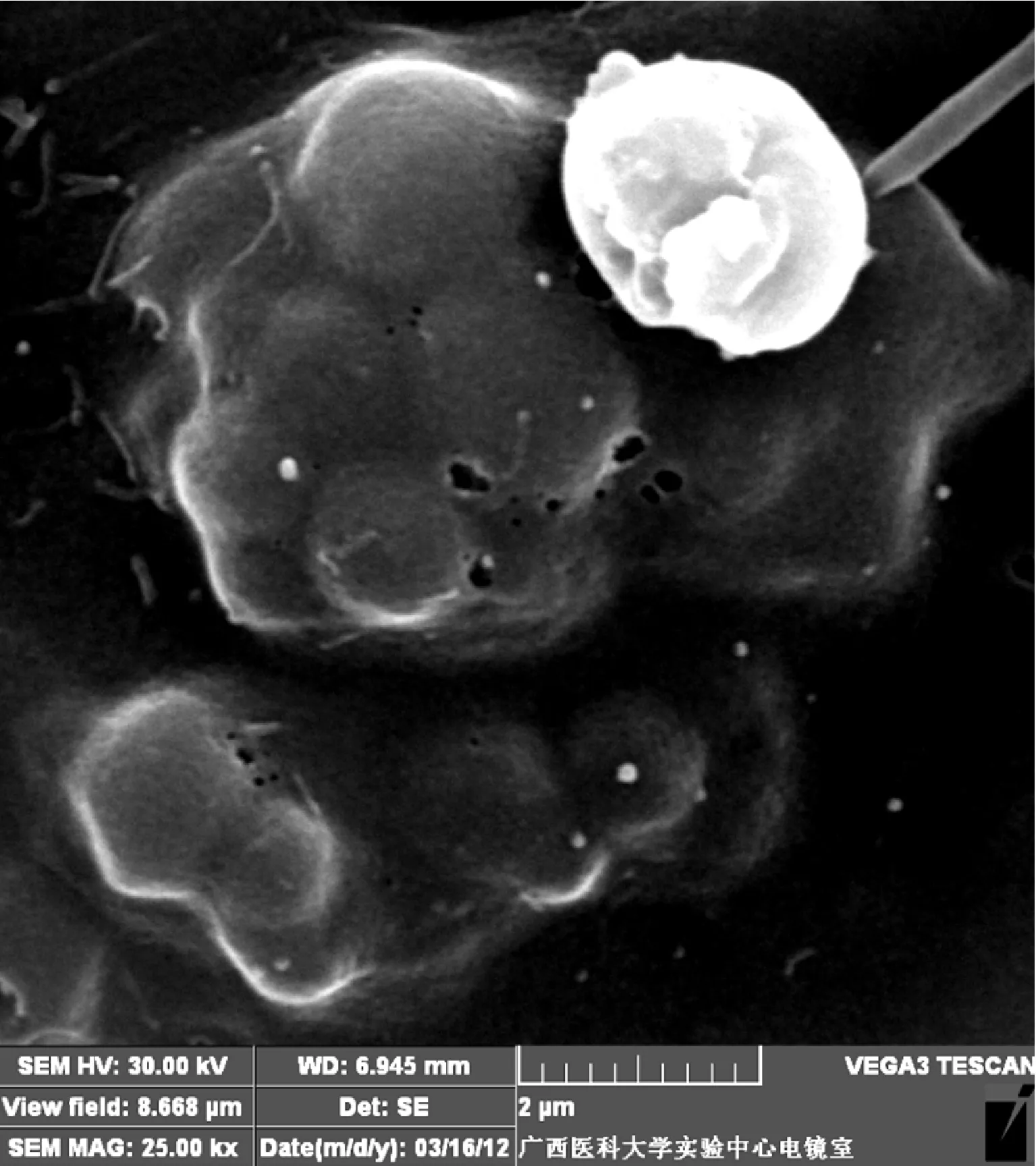
图4三联体穿膜活性的动态监测内化进入细胞内部的微球轮廓清晰可见,同时可见细胞表面微绒毛全部消失
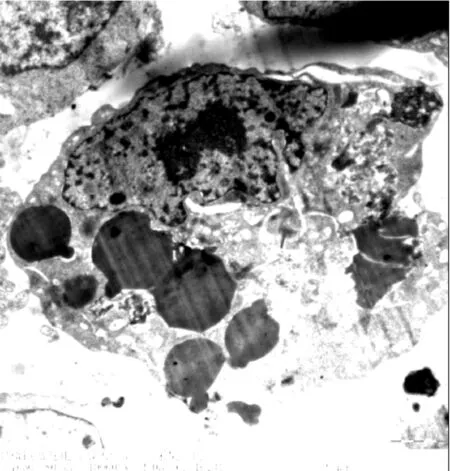
图5EJ人膀胱癌细胞膜微绒毛监测EJ人膀胱癌细胞内穿入多个载白蛋白纳米微球,细胞核固缩,细胞凋亡,穿入微球侧向外凸起,同时见细胞表面突起减少、微绒毛消失
3 讨 论
本研究是在课题组前期成功构建融合蛋白穿膜肽-增强型绿色荧光蛋白的原核表达系统、表达纯化及鉴定融合蛋白TAT-EGFP活性基础上的进一步探索。TAT-EGFP能够促进多种物质通过细胞膜,携带小分子蛋白、药物分子、抗体和微粒等多种物质进入细胞内部[1-2]。纳米药物应用的关键之一是纳米载体的设计与研发[3],白蛋白微球是目前较成熟的一类微球,具有载药量大、缓慢释放药物等特性[4-5]。单克隆抗体能够实现特异性靶向结合与杀伤作用[6]。膀胱癌是我国泌尿系统最常见的恶性肿瘤[7],70%~80%为浅表性膀胱癌[8]。北京大学谢蜀生教授课题组针对膀胱癌细胞建株的杂交瘤细胞株能够稳定分泌单抗BDI-1,可特异性结合EJ人膀胱癌细胞,已经证实该抗体作用于肿瘤细胞膜上的两个分别为53 kb和54 kb长度的膜表面蛋白,并证实其对包括炎症细胞和正常移形上皮在内的其他细胞没有交叉结合[9]。
目前已有一系列异型双功能交联试剂用于蛋白质间的交联,可以实现控制交联,提高交联反应的选择性和交联产物的均一性[10]。SPDP已经成功应用于多种肿瘤特异性的免疫毒素、免疫微球等抗体导向药物系统的制备[11-13]。其交联原理:SPDP与蛋白质中的伯氨基反应,分别引入吡啶二硫基,将其中1种含吡啶二硫基的蛋白质用DTT还原成巯基,然后在含吡啶二硫基的蛋白质与含巯基的蛋白质之间,通过巯基与二硫键的交换,进行蛋白质间偶联。本实验中使用SPDP连接蛋白,具体操作步骤:第1步,将TAT-EGFP、MMC-NS、BDI-1各自与SPDP反应引进吡啶二硫基(PDP基团),SPDP衍生物分别为TAT-EGFP-PDP、BDI-1-PDP、MMC-NS-PDP;第2步,用DTT将BDI-1-PDP还原成BDI-1-SH;第3步,将TAT-EGFP-PDP、MMC-NS-PDP和BDI-1-SH反应得到本实验的目的产物TAT-EGFP-BDI-1-MMC-NS。实验过程中需要注意的是:SPDP很容易因吸水而失活,所以根据用量分装后干燥密封存放;反应中SPDP、DTT都是过量的,以保证完全反应,并用相应的方法除去杂质。
为了进一步标记鉴别TAT-EGFP-BDI-1-MMC-NS三联体的靶向结合,我们用慢病毒对人膀胱癌EJ细胞转染了红色荧光蛋白基因,用表达的红色荧光蛋白标记EJ细胞,用其携带红色荧光在激光共聚焦显微镜下显示红色,BDI-1抗体结合抗鼠的二抗显示黄色,微球结合带有绿色荧光的TAT-EGFP显示绿色,可进一步证明了三联偶联物中抗体的存在。
本实验成功制备了三联偶联物TAT-EGFP-BDI-1-MMC-NS,并进行了初步鉴定,为下一步进行体内、体外的实验奠定了基础,也为膀胱肿瘤的治疗以及更多其它肿瘤的治疗提供了新的思路,开辟了新的方向。同时,本实验首次在电镜下观测到肿瘤细胞膜表面微绒毛在三联体内化入肿瘤细胞后消失的现象,其机制有待后续实验进一步研究。
[1] FOMECA S B,PEMIM M P,KELLEY S O.Recent advances in the use of cell-penetrating peptides for medical and biological applications[J].Adv Drug Deliv Rev,2009,61(11):953-964.
[2] NOGUCHI H,MATSUMOTO S.Protein transduetion technology:a novel therapeutic perspective[J].Acta Med Okayama,2006,60(1):1-11.
[3] 熊梦华,杜金志,王均.聚磷酸酯纳米凝胶载药系统的研究进展[J].东南大学学报:医学版,2011,30(1):262.
[4] ZHOU J,ZENG F,GAO X,et al.Preparation of arsenic trioxide albo-rain mlcrespheres and the release characteristicsinvitro[J].J Huazhong Univ Sei Technolog Med Sci,2005,25(3):310-312.
[5] 戚宁,杜明华,张东生,等.制备单抗偶联载阿霉素白蛋白免疫毫微球的初步研究[J].东南大学学报:医学版,2012,31(4):393.
[6] KHANDRE J J,MINKO T.Antibodies and peptides in csrlcer therapy[J].Crit Rev Ther Drug Carrier Syst,2006,23(5):401-435.
[7] 陈猛,郝林,韩从辉,等.双调控溶瘤腺病毒携带PM5基因靶向鼠膀胱癌的表达[J].东南大学学报:医学版,2012,31(2):167.
[8] 吴天麟,张俊杰,王甫剑,等.吡柔比星膀胱内灌注防治浅表性膀胱癌术后复发(附73例报告)[J].东南大学学报:医学版,2006,25(2):114.
[9] 马爱红,俞莉章,谢蜀生,等.抗人膀胱癌单克隆体BIU-87的制备和鉴定[J].中华泌尿外科杂志,1990,11(4):195-198.
[10] HERMANSON G T.Biocenjugate Techniques[M].2nd ed.San Diego:Academic Press,2008:277-335.
[11] SURASH S,NEMETH P,CHAKRAKRABARTY A,et al.The conjugation of an AQPI-directed immunotoxin in the study of site-directed therapy within the CNS[J].Childs Nerv Syst,2011,27(5):811-818.
[12] ZHOU J,ZENG F,LI C,et al.Preparation of arsenic trioxide loaded albumin immuno-nanospheres and its sveeifie killingeffect on bladder cancer cellinvitro[J].Chin Med J,2005,118(1):50-55.
[13] 阚和平,刘正军,谭永法,等.抗人肝癌免疫毫微球的制备及其抗癌效果观察[J].南方医科大学学报,2008,28(8):1503-1505.

