三叶因子3在实验性胃溃疡大鼠脾脏中的定位及作用
张江兰 邵素霞 邢琛琨 张 静 张文静 张 耕 吴靖芳
(河北北方学院基础医学院组织学与胚胎学教研室,河北 张家口 075000)
最近研究〔1,2〕发现三叶因子(TFF)家族在调节免疫反应方面具有重要的作用。Hirota 等〔3〕第一次在大鼠的脾脏中发现有TFF2 mRNAs和TFF3 mRNAs低水平表达,而后Cook等〔1〕在大鼠淋巴组织中发现也TFF2和TFF3 mRNA相关肽表达,并且在实验诱导的免疫反应中h TFF2和h TFF3升高1.5~3倍,并能刺激单核细胞迁移。而对TFF3阳性细胞定位目前国内外还没有进行研究。本研究观察实验性胃溃疡大鼠脾脏中TFF3的定位和表达变化规律。
1 材料与方法
1.1动物与分组 8周龄SD雄性大鼠共98只。大鼠分为实验性胃溃疡组49只,盐水对照组49只,体重180~220 g。北京维通利华实验动物技术有限公司购买。
1.2大鼠实验性胃溃疡模型的制作及取材 溃疡组大鼠按冰乙酸致实验性胃溃疡模型方法〔4〕,用3%戊巴比妥钠(40 mg/kg)腹腔麻醉。胸腹部剃毛,消毒,在无菌条件下(手术切口长约2 cm) 暴露胃。在胃前壁近胃窦处将0.01 ml冰醋酸注入胃黏膜下层。注射后,胃壁表面立即形成一个圆形或椭圆形的隆起,然后该处变为一乳白色不透明区,直径约5 mm。将大网膜覆盖于注射区后,逐层缝合腹壁切口。盐水对照组模拟手术,注射等量生理盐水代替冰醋酸。两组动物饲养条件相同。取材前禁食12 h,不限饮水。动物用30 g/L戊巴比妥钠麻醉后,迅速开胸,主动脉插管,剪开右心耳,首先灌注生理盐水100 ml,继之灌注4% 多聚甲醛250 ml,维持20 min。在造模后1、2、4、6、10、14和23 d分批迅速开腹取脾(N组7只与1 d组同时取材),从脾截取1 cm长组织条,置于Bouin′s液中固定,12 h后,将组织块放入70%、80%、90%、酒精中各1 h,95%酒精0.5 h,100%Ⅰ酒精1 h,100%Ⅱ酒精0.5 h,二甲苯Ⅰ和Ⅱ透明各20 min,60℃下浸蜡2 h。包埋,切片,片厚5 μm,每隔50~60 μm取1 片,每张载玻片贴2片,裱贴于涂有APES的载玻片,连续切片,厚5 μm,裱贴于涂有APES的载片,行苏木精-伊红染色和免疫组化染色;取与免疫组化相邻切片,连续切片,厚2 μm,裱贴于涂有APES的载片,SABC免疫组化染色。
1.3HE染色 切片经脱蜡、染色、脱水、透明和封片,进行组织学观察。
1.4免疫组织化学方法检测脾脏TFF3的定位和表达 石蜡切片常规脱蜡至水,进行枸橼酸缓冲液(pH6.0)92℃~98℃水浴锅修复10 min,室温冷却;作定位研究的邻片以枸橼酸缓冲液(pH6.0)高压修复5 min,室温冷却;30 g/L H2O2-甲醇室温20 min,100 g/L正常羊血清室温孵育30 min ,倾去多余的血清,滴加兔抗人TFF3多克隆抗体(工作浓度为1∶150,)和兔抗鼠S-100多克隆抗体(工作浓度为1∶100),购自武汉博士得生物技术有限公司,4℃湿盒中过夜;滴加生物素标记Ⅱ抗,37℃孵育30 min,滴加辣根过氧化物酶标记的链霉卵白素,37℃孵育30 min;DAB-H2O2液显色后,苏木精复染细胞核。正常兔血清代替一抗作阴性对照,其余步骤相同。在光镜下观察TFF3和S-100阳性反应物质呈棕黄色颗粒状分布于各细胞的胞质中。以胞浆内出现棕黄色颗粒视为阳性细胞。
1.5形态计量和图像分析 用OLYMPUS-CX31显微镜连接MiE显微图像处理软件在计算机上进行观察,用Motic Med6.0软件进行图像半定量分析,每张切片随机选取5个视野,每组动物随机选择30张照片,用Motic Med6.0数码医学图像分析系统测定TFF3蛋白的平均光密度值(AOD)。

2 结 果
2.1TFF3阳性细胞的定位 三组大鼠脾脏组织中均有TFF3表达。TFF3阳性细胞分布于边缘区、白髓及红髓中的脾索中(图1)。TFF3阳性反应物呈棕黄色颗粒状分布于胞质中。正常组TFF3细胞呈浅棕黄色,数量少;溃疡组和盐水组阳性细胞呈棕黄色,数量多。白髓中TFF3阳性细胞散在分布,形态不规则,一般有多个突起,核较大,位于细胞中央;边缘区和红髓中阳性细胞成群或散在分布,数量较多;而红髓中阳性细胞散在分布,主要分布于脾索中。经邻片免疫组化结果证实,部分TFF3阳性细胞与S-100表达阳性重叠,因S-100是树突细胞的标记蛋白,故脾脏中部分TFF3阳性细胞为树突细胞(图2)。
2.2TFF3在不同时期大鼠脾脏中的表达变化 不同时期盐水组(图3A)大鼠脾脏各部位TFF3表达较弱。TFF3在不同时期胃溃疡大鼠脾脏中各部位的表达不同,统计结果显示:白髓:1、2 d组TFF3表达逐渐增强、阳性细胞数量增多,4、6 d组染色强度稍有降低、数量增多,10 d 组TFF3阳性信号强度和数量达高峰(图3B),然后14、23 d组阳性细胞强度和数量逐渐降低,但明显高于盐水对照组,2~23 d各溃疡组TFF3表达均高于盐水组(P<0.01);边缘区:1 d组TFF3表达逐渐增强、阳性细胞数量增多,2、4 d各值略有降低,6 d各值增高、阳性信号强度达峰值,10、14 d各值逐渐降低,23 d有所升高,但维持在一个较高的水平,其中6 d组与盐水组相比明显增高(P<0.01)。红髓:1、2 d TFF3表达逐渐增强、数量增多,4 d各值降低,6 d各值增高、其阳性信号强度高峰,10、14、23 d各值下降,但维持较高水平,其中6 d组与盐水组相比明显增高。见表1。
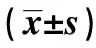
表1 TFF3阳性细胞AOD变化

图1 溃疡组TFF3及S-100阳性细胞分布

图2 溃疡组邻片TFF3和S-100免疫组化染色(×330)
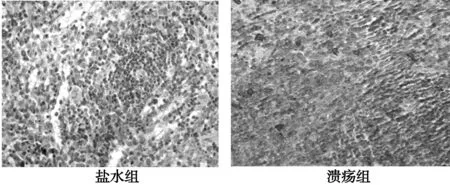
图3 盐水组与溃疡组中TFF3阳性细胞分布(×200)
3 讨 论
TFF3是Suemopr等〔5〕于1991 年在大鼠空肠黏膜中发现。TFF3存在单聚体及二聚体2种形式,其同源二聚体通过2个C末端半胱氨酸(Cys58)形成分子间二硫键连接而成,是胃肠黏膜的一个重要的保护因子,与胃肠黏膜的损伤、修复、增殖、恶变有着重要的关系〔6〕。本研究通过应用敏感的免疫组织化学SABC法发现,TFF3阳性细胞体积较大、星形或有突起,细胞核较大;也有少量表达于圆形、椭圆形的细胞中,胞核圆形或卵圆形,位于胞质中央或偏位。DC细胞质可以合成一种为S-100的胞浆蛋白,八九十年代以来,陆续有研究报道〔7,8〕S-100蛋白是郎交错突细胞的一个标志。本研究结果证实部分TFF3阳性细胞与邻片中S-100阳性DC重合,提示这部分TFF3阳性细胞是S-100阳性的DC,故认为部分TFF3是由S-100阳性的DC合成的。
研究〔9〕显示,脾脏体积增大,白髓脾小体增多,且生发中心清晰。B细胞受到特异性抗原刺激增殖活化,转化为效应细胞浆细胞,浆细胞分泌免疫球蛋白后,大部分免疫球蛋白发生糖基化比如黏合素,Cook等〔1〕用细胞质基因组共振光谱检测TFF2或TFF3与IgG或IgA有一定的相关性,提示可能通过影响浆细胞免疫球蛋白的分泌活动来提高体液免疫应答。Alision等〔10〕研究恰好解释了制模后的第1天分泌TFF3急剧增多,指出一方面可能是由于生理应激性引起,另一方面TFF3为早期反应基因。本文显示在溃疡愈合早期TFF3高表达可能提高了脾脏的免疫反应性,加快了胃溃疡的愈合,胃溃疡自愈后期,TFF3表达减弱,脾免疫作用趋于正常。
HE染色显示在溃疡组早期脾脏边缘区依次增厚,可见边缘区免疫反应在溃疡早期是增强的。DC 通过在体内迁移而发挥强大的抗原提呈功能,从外周非淋巴组织迁移进入次级淋巴组织〔11〕,如肝脏内的DC获取抗原后通过血液循环到脾脏〔12〕,激发抗原特异性的免疫反应。DC移行到脾脏T细胞区定居下来,诱导产生Th1型免疫应答,或通过激活B细胞产生特异性抗体,清除抗原性物质。本研究认为,溃疡形成和愈合早期脾的组织学改变,是由于在实验性胃溃疡早期,与冰乙酸刺激和局部溃疡形成有关,黏膜免疫细胞大量处理抗原,随淋巴细胞再循环到达脾脏,首先引起边缘区的改变。本研究还表明,在溃疡组损伤后的不同时间段,边缘区TFF3表达是不同的,总体上,边缘区TFF3的表达与损伤发生后的时间呈负相关〔9〕,可见随溃疡愈合,溃疡局部抗原成分减少,TFF3表达减少。侯国存等〔13〕证实在多器官障碍综合征早期,脾DC大量增加并从脾脏白髓边缘区向T细胞区迁移,引发过度免疫反应。Cook等〔1〕在体外培养大鼠脾脏来源的DC培养基中加入人糖基化的TFF2和TFF3重组体,实验结果发现hTFF2和hTFF3升高1.5~3倍,能刺激单核细胞迁移能力增强。所以我们推测溃疡期间脾脏TFF3能促进免疫细胞的迁移和淋巴细胞再循环,利于溃疡大鼠自身免疫力的提高。
总之,大鼠胃溃疡自愈期间,脾脏不同的部位TFF3表达水平不同,但胃黏膜损伤早期脾脏TFF3呈高水平表达,对提高机体免疫反应性及促进胃黏膜修复有重要作用。
4 参考文献
1Cook GA,Pamilari M,Thim L,etal.The TFF2 and TFF3 are expressed in rat lymphoid tissues and participate in the immune response〔J〕.FEBS Letters,1999;456:155-9.
2Raja SB,Murali MR,Devaraj H,etal.Differential expression of gastric MUC5AC in colonic epithelial cells:TFF3-wired IL1 β/Akt crosstalk-induced mucosal immune response against Shigella dysenteriae infection〔J〕.J Cell Sci,2012;125(3):703-13.
3Hirota M,Miyashita S,Hayashi H,etal.pS2 gene especially expressed in the late G1/S phase of mouse astrocytes〔J〕.Neurosci Lett,1994;171:49-51.
4吴靖芳,顾彩霞,张 静,等.大鼠实验性胃溃疡期间下颌下腺TFF3基因的变化〔J〕.中国组织化学与细胞化学杂志,2010;19:26-31.
5Suemori S,Lynch-devaney K,Podolsky DK.Identification and characterization of rat intestinal trefoil factor:tissue and cell-specific member of the trefoil protein family〔J〕.Proc Natl Acad Sci USA,1991;88:11017-21.
6Calcagno SR,Li S,Shahid MW,etal.Protein kinase C iota in the intestinal epithelium protects against dextran sodium sulfate-induced colitis〔J〕. Inflamm Bowel Dis,2011;17(8):1685-97.
7Brandtzaeg P.Immunohistochemical identification of macrophages and various dendritic cells in Paraffin embeded biopsy material〔J〕.AFMIS,1988;96:136.
8张锦坤,魏锡云,陈海滨,等.大鼠脾白髓交错突细胞和巨噬细胞的形态计量分析〔J〕.中国组织化学与细胞化学杂志,1996;5(3):321-4.
9张江兰,吴靖芳,王志勇,等.三叶因子3在胃溃疡大鼠脾脏不同部位的表达〔J〕.西安交通大学学报(医学版),2011;32(3):315-9.
10Alision MR,Chiner YR,Poulsom R,etal.Experimental ulceration leads to sequential expression of spasmolytic polypeptide,intestinal polypeptide,intestinal trefoil factor and transforming growth factor alpha mRNA in rat stomach〔J〕.Pathol,1995;175(4):405-14.
11杨俊俊,徐兴祥,钱桂生.树突状细胞引流淋巴结归巢的研究进展〔J〕.免疫学杂志,2011;27(3):263-6.
12Young JW,Inaba K.Dendritic cells as adjuvants for class Ⅰ major histocompatibility complex-restricted antitumor immunity〔J〕.J Exp Med,1996;183(1):7-11.
13侯国存,刘 茜,王宏伟,等.树突状细胞在多器官功能障碍综合征小鼠脾脏中的迁移变化及意义〔J〕.解放军医学杂志,2009;34(3):290-2.

