粒细胞集落刺激因子对脑出血大鼠的治疗机制
何晓英 付 华 袁 平 谭 华 李小刚
(泸州医学院附属医院神经内科,四川 泸州 646000)
粒细胞集落刺激因子(G-CSF) 是一种造血因子,最开始被用于治疗粒细胞减少症等血液系统疾病。研究证明G-CSF可通过血-脑脊液屏障在中枢神经系统发挥重要的非造血作用。目前越来越多研究发现G-CSF治疗缺血性脑脑卒中有多种生物活性,可通过不同病理生理途径产生神经保护作用。李健生等〔1〕报道G-CSF能通过动员骨髓干细胞改善脑卒中后神经功能受损症状;Sevimli等〔2〕、Sugiyama等〔3〕分别证实G-CSF在脑梗死模型中具有抗炎作用和抗凋亡作用;最近有研究表明,在脑缺血动物模型中G-CSF通过增强侧支血管生长而改善脑血管的储备能力〔4〕; Prasad 等〔5〕对急性期、England等〔6〕对亚急性期脑卒中的临床试验研究中也证明,G-CSF不仅能够减少梗死面积,而且具有较高的安全性。本研究从脑水肿程度、基质金属蛋白酶(MMP)-9动态表达以及星形胶质细胞活性变化角度,探讨G-CSF对脑出血(ICH)大鼠的治疗作用及可能机制。
1 材料与方法
1.1动物及分组 由泸州医学院动物实验中心提供体重为250~320 g的SD大鼠96只,随机分为假手术组(n=24)、ICH组和治疗组(n=36),其中各组又按6、24、48、72 h、7、10 d时间点分为6个亚组(假手术组n=4,ICH组、治疗组n=6)。
1.2ICH模型的制作〔7〕SD大鼠术前禁食12 h,2%戊巴比妥钠(50 mg/kg)腹腔注射后,俯卧位固定在立体定位仪上,无菌操作暴露前囟,用小型牙科钻钻透颅骨至硬脑膜处,定位于前囟前0.2 mm、中线右侧旁开3 mm、深6 mm为注血点,将非肝素抗凝断尾获取的动脉血50 μl,先注入10 μl,停针2 min,后缓慢注入40 μl,注血时间约5 min,完毕后留针10~15 min,再缓慢退针。术后青霉素粉末涂抹局部,缝合皮肤。所用手术器械均经高压灭菌消毒,整个手术过程无菌操作。假手术组:参照上述方法,经注入点注入等量无菌生理盐水。治疗组制模成功1 h后经腹腔注射重组G-CSF(60 μg/kg),假手术组、ICH组经腹腔注射等量生理盐水。
1.3脑组织含水率测定 各组大鼠于相应时间点(假手术组n=2,ICH组、治疗组n=3)麻醉后迅速断头取脑,将取出的脑组织放在用生理盐水浸润过的滤纸上,以防止水分蒸发。去除软脑膜和血迹,精密称湿重。将取出的脑组织在100℃烤箱内烘烤24 h,再称取干重。按Blliot公式计算脑组织含水率= (湿重-干重)/湿重×100%。
1.4MMP-9、胶质纤维酸性蛋白(GFAP)表达测定 各组大鼠于相应时间点(假手术组n=2,ICH组、治疗组n=3)麻醉后,经主动脉灌注4%多聚甲醛,取出脑组织,多聚甲醛固定,石蜡包埋、切片。按照免疫组织化学试剂盒说明进行染色。采集系统对MMP-9、GFAP的表达测定采用阳性细胞计数法,每只大鼠选一张脑切片,在400倍光镜下随机选取血肿周围的 4 个视野,计数每个视野的阳性细胞数,取平均值。MMP-9阳性表达为细胞膜及胞质呈棕褐色,GFAP阳性表达为细胞质及星状突起纤维呈黄色或黄棕色。

2 结 果
2.1各实验组大鼠脑组织含水率动态变化 ICH组脑组织含水率各时间点明显高于假手术组(P<0.05),6 h开始增高,24 h进一步升高,48~72 h达到最高峰。治疗组各时间点脑组织含水率明显低于ICH组(P<0.05)。见表1。
2.2各组大鼠血肿周围组织MMP-9动态变化 ICH组各时点MMP-9表达明显高于假手术组(P<0.05),6 h少量散在表达,24 h开始增多,48~72 h达高峰,10 d仍有少量表达。治疗组各时点MMP-9表达显著低于ICH组(P<0.05),6 h较少表达,同样在24 h开始迅速增多,48~72 h达高峰,后逐渐下降。见表2。
2.3脑组织含水率与MMP-9相关性分析 假手术组脑组织含水率与MMP-9表达无相关性(r=0.429,P=0.396 1);ICH组脑组织含水率与MMP-9表达呈正相关(r=0.922,P=0.008 9);治疗组脑组织含水率与MMP-9表达呈正相关(r=0.844,P=0.034 5)。
2.4各组大鼠血肿周围组织GFAP测定 假手术组未见GFAP阳性细胞表达。ICH组6 h即有少量GFAP阳性细胞表达,分布稀疏、着色较浅、胞体体积较小、突起分支较少;48 h开始增多;72 h出现大量表达;7 d GFAP达高峰,胞体肥大、突起增粗且增长、着色较深,与组内其他时点比较差异显著(P<0.05);10 d GFAP阳性细胞表达减少。治疗组6h GFAP阳性细胞表达与ICH组相似,24 h、48 h、72 h、7 d、10 d表达较ICH组明显减少(P<0.05),细胞变形程度减轻。见表3。
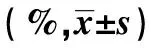
表1 各组不同时间点脑组织含水率比较

表2 各组不同时间点血肿周围MMP-9表达(个/单位面积,

表3 各组不同时间点血肿周围GFAP表达(个/单位面积,
3 讨 论
动物实验以及临床实验表明,在缺血性脑血管病中使用G-CSF干预的生存率及神经功能评分均高于对照组,这提示G-CSF在神经系统的损伤修复方面起着一定的生理作用,故在尨经保护领域受到越来越广泛的关注。关于G-CSF在中枢神经系统发挥生物学作用的途径,初期学者们推测可能是G-CSF动员了BMSC,促进前脑的神经干细胞分化并从侧脑室向损伤区募集神经前体细胞来促进神经功能的重建。随着研究的深入,Schabitz等〔8〕在离体实验中发现在受到刺激的星形胶质细胞上有G-CSF表达,Schneider 等〔9〕发现体内正常脑组织神经元上也有 G-CSF表达,并且应用免疫组化、western Blot和RT-PCR法均证实鼠脑的神经元和胶质细胞有G-CSF受体(G-CSF-R)存在。在此基础上,Hasselblatt等〔10〕试验证实G-CSF在中枢神经系统通过与效应细胞表面特异性G-CSF-R结合发挥生物学作用。脑组织存在内源性G-CSF,脑损伤后机体启动自我修复机制通过上述途径使神经环路和功能得到部分重建。Solaroglu等〔11〕采用不能透过血脑屏障的碘化牛血清白蛋白作为对照,给大鼠注射碘化的G-CSF,计算注射后1 h,4 h,24 h 碘化G-CSF和碘化白蛋白的脑/血清比值,实验发现G-CSF显示一个较高的脑/血清比值,证实G-CSF能够通过完整的血脑屏障,为外源性G-CSF治疗中枢系统疾病提供了科学的基础理论依据。
脑水肿是ICH最为严重的继发性损伤,是导致脑组织结构改变和功能损伤的重要原因之一,有效减轻脑水肿是ICH的治疗关键。本实验建立大鼠自体血ICH模型,结果说明G-CSF减轻了ICH后的脑水肿。实验进一步研究了G-CSF减轻脑水肿程度的可能机制。MMP-9是影响脑水肿发生发展的重要因素之一。Gursoy等〔12〕对基因遗传工程小鼠的实验研究证实MMP-9能够改变血脑屏障通透性并加重脑水肿。应用核磁共振技术对临床患者的观察发现ICH患者脑水肿消长规律与血清MMP-9变化一致〔13〕。本实验也说明ICH后MMP-9表达增强并参与了ICH后脑水肿形成。治疗组各时点MMP-9表达明显轻于ICH组,提示G-CSF抑制了MMP-9的表达,相关性分析发现治疗组MMP-9表达和脑组织含水率也成正相关关系。因此,G-CSF可能通过下调MMP-9的表达减轻了ICH后脑水肿,其确切机制尚需进一步研究。
GFAP为仅存在于星形胶质细胞(Ast)中的单体中间丝蛋白,是细胞骨架的主要组成部分,通常情况下正常Ast的GFAP表达量不高,中枢神经损伤后GFAP 在Ast中有丰富而特异性的表达,是Ast活化的客观标志蛋白〔14〕。中枢神经系统损伤时,Ast由常态转化为反应性Ast,称之为Ast活化,表现为Ast数量上增加,细胞胞体、胞核大小及突起长度的变化〔15〕。活化的Ast在脑损害后有利弊双向作用:一方面,Ast活化,对细胞间隙的谷氨酸及H+、K+等清除能力增加可增强能量代谢能力;释放神经营养因子增多,有助于受损神经元的修复;合成大量的载脂蛋白E重建神经元完整性,增加突触联系,促进神经修复及功能重建〔16〕。另一方面,活化的Ast可产生大量NO,通过对大分子特别是DNA的修饰,可导致细胞凋亡和坏死;可以产生多种细胞因子和炎症介质介导炎性反应,促进内皮细胞坏死,引起血脑屏障开放,参与脑水肿病理过程;过度的胶质化也可以作为机械屏障妨碍髓鞘和轴索的再生,影响周围神经组织结构和功能恢复〔17〕。 因此,活化的Ast对ICH后神经组织是一把双刃剑,依靠神经系统代偿性的自我调节不足以既发挥Ast的神经保护作用,同时又抑制Ast神经毒性作用,可能是导致ICH预后不佳的因素之一。因此,Ast在ICH中适度活化无疑具有重要意义。
本实验观察到假手术组无GFAP阳性细胞表达,表明Ast处于相对稳定状态;ICH组6 h开始GFAP少许表达,随时间延长逐渐增多,72 h大量表达,7 d达高峰,该规律与已有研究报道基本一致〔18〕;实验结果提示G-CSF下调了ICH后GFAP表达,抑制Ast过度活化。理论上G-CSF抑制了ICH大鼠Ast过度胶质化,可增强对神经细胞的保护作用,而减轻对脑组织的损伤作用,但是怎样才能使GFAP恰好维持在一个适当的水平从而最大程度发挥Ast的神经保护作用以及G-CSF抑制Ast过度活化的确切机制尚未明确,有待进一步研究。
4 参考文献
1李健生,刘敬霞,刘 柯,等.粒细胞集落刺激因子对脑缺血大鼠骨髓干细胞分布及脑保护作用的影响〔J〕.中国危重病急救医学,2011;23(6):333-6.
2Sevimli S,Diederich K,Strecker JK,etal.Endogenous brain protection by granulocyte-colony stimulating factor after ischemic stroke〔J〕.Exp Neurol,2009;217(2):328-35.
3Sugiyama Y,Yagita Y,Oyama N,etal.Granulocyte colony-stimulating factor enhances arteriogenesis and ameliorates cerebral damage in a mouse model of ischemic stroke〔J〕.Stroke,2011;42(3):770-5.
4Duelsner A,Gatzke N,Glaser J,etal.Granulocyte colony-stimulating factor improves cerebrovascular reserve capacity by enhancing collateral growth in the circle of Willis〔J〕.Cerebrovasc Dis,2012;33(5):419-29.
5Prasad K,Kumar A,Sahu JK,etal.Mobilization of stem cells using G-CSF for acute ischemic stroke:a randomized controlled,pilot study〔J〕.Stroke Res Treat,2011;6 (10):283-7.
6England TJ,Abaei M,Auer DP,etal.Granulocyte-colony stimulating factor for mobilizing bone marrow stem cells in subacute stroke:the stem cell trial of recovery enhancement after stroke-randomized controlled trial〔J〕.Stroke,2012;43(2):405-11.
7Deinsberger W,Vogel J,Kuschinsky W,etal.Experimental intracerebral hemorrhage:decription of a double injection model in rats〔J〕.Neurol Res,1996;18(5):475-7.
8Schabitz WR,Kollmar R,Schwaninger M,etal.Neuroprotective effect of granulocyte colony-stimulating factor after focal cerebral ischemia〔J〕.Stroke 2003;34(3):745-51.
9Schneider A,Krüger C,Steigleder T,etal.The hematopoietic factor G-CSF is a neuronal ligand that counteracts programmed cell death and drives neurogenesis〔J〕.J Clin Invest,2005;115(8):2083-98.
10Hasselblatt M,Jeibmann A,Riesmeier B,etal.Granulocyte-colony stimulating factor(G-CSF) and G-CSF receptor expression in human ischemie stroke〔J〕.Acta Neuropathol,2007;113(l):45-51.
11Solaroglu I,Cahill J,Tsubokawa T,etal.Granulocyte colony-stimulating factor protects the brain against experimental stroke via inhibition of apoptosis and inflammation〔J〕.Neurol Res,2009;31(2):167-72.
12Gursoy-Ozdemir Y,Qiu J,Matsuoka N,etal.Cortical spreading depression activates and upregulates MMP-9〔J〕.J Clin Invest,2004;113(10):1447-55.
13Barr TL, Latour LL,Lee KY,etal.Blood-brain barrier disruption in humans is independently associated with increased matrix metalloproteinase-9〔J〕.Stroke,2010;41(3):e123-8.
14Love S,Mc Lean C.Overview and recent advances in neuropathology〔J〕.Pathology,2011;43(2):87.
15Barker AJ,Ullian EM.Astrocytes and synaptic plasticity〔J〕.Neuroscientist,2010;16(1):40-50.
16Colangelo AM,Cirillo G,Lavitrano ML,etal.Targeting reactive astrogliosis by novel biotechnological strategies〔J〕.Biotechnol Adv,2012;30(1):261-71.
17梁彦涛,张敬军.胶原纤维酸性蛋白基础与临床研究进展〔J〕.医学综述,2009;15(16):2407-9.
18Masuda T,Maki M,Hara K,etal.Peri-hemorrhagic degeneration accompanies stereotaxic collagenase-mediated cortical hemorrhage in mouse〔J〕.Brain Res,2010;1355(8):228-39.

