IL-17A在胃癌中的表达及其对胃癌细胞增殖、凋亡的影响*
吴小琴 曾志荣 许丽霞 曹清华 陈 斌 陈旻湖 胡品津
广州医科大学附属第二医院消化科1(510260) 中山大学附属第一医院消化科2 病理科3
胃癌是消化系统常见恶性肿瘤之一,严重威胁人类生命。炎症与癌症关系密切,被列为癌症的第七大特征[1],而白细胞介素-17A(IL-17A)可能参与了炎症相关肿瘤的形成。本课题组前期研究[2]发现,IL-17A G197A多态性与某些亚型胃癌的发生风险增加有关。本研究通过分析IL-17A在胃癌组织中的表达,并探讨体外IL-17A处理对胃癌细胞增殖、凋亡及其下游肿瘤相关炎性因子表达的影响,以期进一步了解IL-17A与胃癌的关系。
材料与方法
一、标本获取
选取2004年7月~2005年6月于中山大学附属第一医院行胃癌根治术的54例胃癌患者的癌组织和16例相应癌旁非癌组织(距离癌灶边缘>3 cm),所有标本均经HE染色病理检查明确诊断。入选患者男33例,女21例,年龄41~72岁,平均(56.7±12.6)岁。所有患者手术前均未接受过放、化疗。
二、细胞株、主要试剂
胃癌细胞株AGS、SGC7901、MKN45、MKN87、SUN1、SUN16购自美国ATCC公司,传代培养于含10%胎牛血清、1%青霉素-链霉素双抗的RPMI1640培养基中(37 ℃,5%CO2);山羊抗人IL-17A多克隆抗体、重组人IL-17A蛋白购自美国R&D公司;细胞总RNA提取试剂盒购自天根生化科技(北京)有限公司;RT-PCR和real-time PCR试剂盒购自日本TOYOBO公司;MTT和Annexin V-FITC试剂盒购自广州展晨生物科技有限公司。
三、方法
1. 免疫组化法检测IL-17A表达:以免疫组化SP法检测胃癌组织和相应癌旁非癌组织中的IL-17A表达和分布。组织切片脱蜡、水化,3% H2O2室温封闭5~10 min,蒸馏水洗涤3次,置于10 mmol/L柠檬酸盐缓冲液中加热20 min,PBS冲洗后加入山羊抗人IL-17A多克隆抗体(1∶400),37 ℃孵育2 h,PBS冲洗后加入二抗,37 ℃孵育30 min,DAB显色,苏木精复染、脱水、中性树胶封固后于光学显微镜下观察。以PBS代替一抗作为阴性对照,以已知阳性切片作为阳性对照。IL-17A免疫组化染色阳性细胞胞质呈棕褐色。参考Zhang等[3]采用的方法,每例标本选取5个视野(×400)计数阳性细胞,结果取均值。
2. RT-PCR法检测IL-17A mRNA表达:取对数生长期胃癌细胞株AGS、SGC7901、MKN45、MKN87、SUN1、SUN16,以炎症性肠病患者外周血单核细胞作为阳性对照,参照细胞总RNA提取试剂盒和RT-PCR试剂盒说明书进行操作。IL-17A引物上游:5’-ACT CCT GGG AAG ACC TCA TTG-3’,下游:5’-GGC CAC ATG GTG GAC AAT CG-3’;GAPDH 引物上游:5’-TGG TCT CCT CTG ACT TCA AC-3’,下游:5’-GTG AGG GTC TCT CTC TTC CT-3’。PCR反应条件:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s, 72 ℃ 30 s,共35个循环。产物经琼脂糖凝胶电泳后,上UVP GDS-7600 凝胶图像成像系统检测。
3. 细胞增殖检测:取对数生长期SGC7901细胞制成单细胞悬液,以9×103/孔接种于96孔板,培养4~6 h后,分别加入不同浓度(10、50、100 ng/mL)重组人IL-17A,对照组加入等体积DMSO,培养24、48、72 h 后,每孔加入5 mg/mL MTT 20 μL,继续培养4 h,终止培养,弃上清液,加入DMSO 200 μL,低速振荡10 min,以酶标仪测定492 nm波长处各孔吸光度(A)值。细胞增殖率=实验孔A值/对照孔A值×100%。实验重复3次,结果取均值。
4. 细胞凋亡检测:取对数生长期SGC7901细胞,以5×104/孔接种于6孔板,加入含0.25 mmol/L H2O2的无血清RPMI1640培养基培养2 h,PBS冲洗2次,换为含10%胎牛血清的RPMI1640培养基,并加入不同浓度(0、10、100 ng/mL)重组人IL-17A,继续培养12 h,按Annexin V-FITC试剂盒说明书行细胞染色,上流式细胞仪检测细胞凋亡情况。
5. real-time RT-PCR法检测IL-6、基质金属蛋白酶-13(MMP-13) mRNA表达:取对数生长期SGC7901细胞接种于6孔板,待细胞完全贴壁后,换为含不同浓度(0、10、100 ng/mL)重组人IL-17A的培养基,培养6 h后收集细胞,参照细胞总RNA提取试剂盒和real-time PCR试剂盒说明书进行操作。IL-6引物上游:5’-TGT AGC CGC CCC ACA CA-3’,下游:5’-GGA TGT ACC GAA TTT GTT TGT CAA-3’;MMP-13引物上游:5’-GAA TTA AGG AGC ATG GCG ACT T-3’,下游:5’-CCC AGG AGG AAA AGC ATG AG-3’;β-actin引物上游:5’-GCA TGG GTC AGA AGG ATT CCT-3’,下游:5’-TCG TCC CAG TTG GTG ACG AT-3’。PCR反应条件:93 ℃ 3 min;93 ℃ 30 s,55 ℃ 45 s,72 ℃ 30 s,共40个循环。以2-△△Ct法计算目的基因mRNA相对表达量。
四、统计学分析

结 果
一、IL-17A在胃癌和癌旁非癌组织中的表达
免疫组化染色结果显示,IL-17A阳性染色主要定位于细胞质,呈棕褐色颗粒样,细胞核无阳性染色。胃癌组织中IL-17A呈散在分布,主要表达于炎性细胞和血管内皮细胞;相应癌旁非癌组织有少量炎性细胞表达IL-17A。胃癌组织中IL-17A阳性细胞数较相应癌旁非癌组织显著增多(P=0.007)(见图1)。
二、IL-17A在胃癌细胞株中的表达
RT-PCR法检测结果显示,胃癌细胞株AGS、SGC7901、MKN45、MKN87、SUN1、SUN16中均无IL-17A mRNA表达(见图2)。
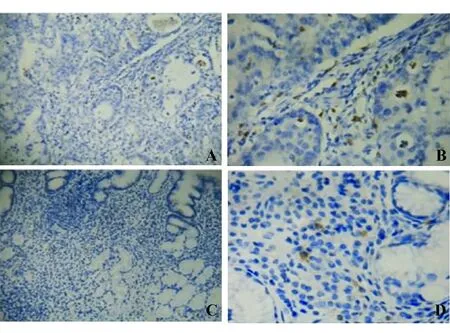
A、B: 胃癌组织;C、D:癌旁非癌组织

图2 IL-17A mRNA在胃癌细胞株中的表达
三、IL-17A对胃癌细胞增殖、凋亡的影响
MTT法检测结果显示,与对照组相比,IL-17A能显著刺激SGC7901细胞增殖,作用呈剂量和时间依赖性(见图3)。
流式细胞术检测结果显示,IL-17A 10、100 ng/mL组SGC7901细胞凋亡率较0 ng/mL 组显著降低(P<0.05),10、100 ng/mL组间凋亡率无明显差异(P>0.05)(见图4)。
四、IL-17A对胃癌细胞IL-6、MMP-13 mRNA表达的影响
real-time RT-PCR法检测结果显示,IL-17A 10、100 ng/mL组SGC7901细胞IL-6、MMP-13 mRNA表达水平较0 ng/mL组显著上调,作用呈剂量依赖性(P<0.05)(见图5)。

图3 IL-17A对SGC7901细胞增殖的影响
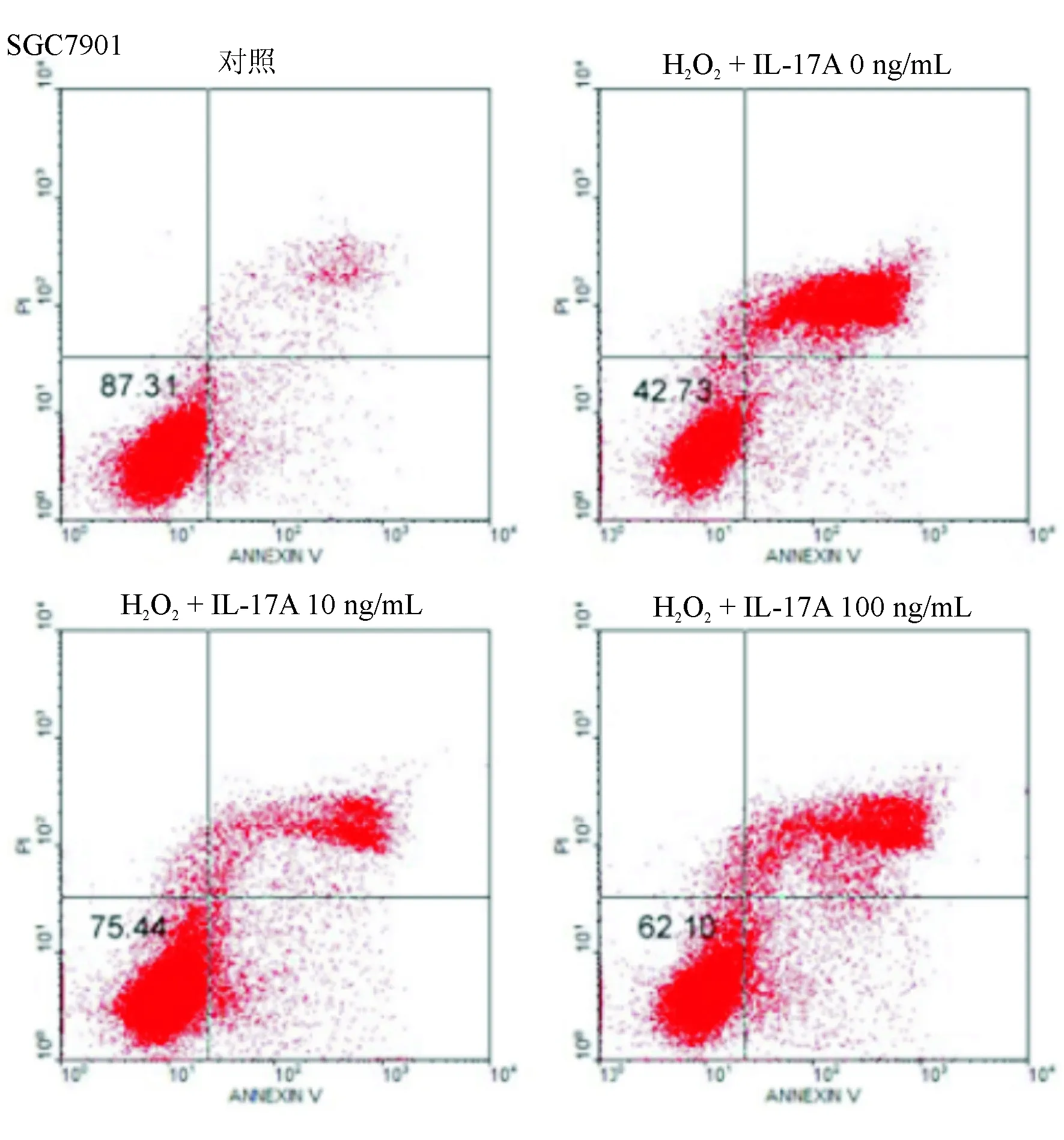
图4 IL-17A对SGC7901细胞凋亡的影响

图5 IL-17A对SGC7901细胞IL-6、MMP-13 mRNA表达的影响
讨 论
IL-17是一种炎性细胞因子,在炎症反应中发挥重要作用,与类风湿性关节炎、哮喘、系统性红斑狼疮、银屑病、多发性硬化、炎症性肠病等多种炎症性和自身免疫性疾病相关[4-5]。近年研究发现,IL-17在多种肿瘤组织中表达异常。Miyahara等[6]的研究显示,分离自卵巢癌组织的浸润性T细胞中,表达IL-17的Th17细胞比例较正常组织显著增高。Zhu等[7]的研究发现,乳腺癌组织中IL-17表达明显升高,其主要表达于肿瘤相关巨噬细胞、部分淋巴细胞以及多个核细胞,极少量表达于肿瘤细胞。Le Gouvello等[8]对结肠癌标本的研究显示,癌组织IL-17表达水平明显高于相应正常组织。Zhang等[3]的研究发现,肝细胞癌组织中的IL-17表达水平显著高于癌旁非癌组织,癌组织IL-17细胞密度与预后密切相关,有望成为预后指标和治疗靶点。
本研究分析了IL-17A在胃癌组织中的表达情况,发现胃癌组织中的IL-17A表达强度显著高于癌旁非癌组织,主要表达于炎性细胞和血管内皮细胞,该发现提示IL-17A可能与肿瘤血管生成有关。Numasaki等[9]的研究显示,IL-17可激发血管内皮细胞迁移,促进脉管形成,调节促血管生成因子分泌,从而促进肿瘤血管生成。此外,本研究还发现,体外重组人IL-17A可刺激胃癌细胞株SGC7901增殖,抑制H2O2诱导的细胞凋亡,提示IL-17A可能参与了胃癌的恶性演变进程。
IL-6是一种多功能细胞因子,参与调节细胞增殖、分化、免疫防御等过程。MMP-13属于间质胶原酶类,具有强大的胶原蛋白降解能力,在基质金属蛋白级联激活中起关键作用。IL-6和MMP-13在肿瘤侵袭、转移过程中发挥重要作用。IL-6可通过JAK/STATs途径活化STAT3,导致细胞异常增殖和凋亡障碍,并可促进肿瘤血管生成以及加剧肿瘤组织炎症等[10]。MMP-13表达受 MAPK信号通路控制,后者是IL-17A信号转导的重要通路之一[11-12]。本研究结果证实,IL-17A可上调胃癌细胞中的IL-6和MMP-13表达,作用呈剂量依赖性,提示IL-6和MMP-13在IL-17A参与的胃癌发生机制中可能起一定作用。
综上所述,本研究发现IL-17A在胃癌组织中呈高表达。体外IL-17A处理可刺激胃癌细胞增殖、抑制细胞凋亡,并上调其肿瘤相关炎性因子IL-6、MMP-13表达。IL-17A可直接或通过诱导炎症信号通路分子间接促进胃癌进展,有望成为胃癌治疗的新靶点。然而,目前IL-17A在肿瘤微环境中的作用尚未完全明确,其确切作用机制有待进一步研究。
1 Mantovani A, Allavena P, Sica A, et al. Cancer-related inflammation[J]. Nature, 2008, 454 (7203): 436-444.
2 Wu X, Zeng Z, Chen B, et al. Association between polymorphisms in interleukin-17A and interleukin-17F genes and risks of gastric cancer[J]. Int J Cancer, 2010, 127 (1): 86-92.
3 Zhang JP, Yan J, Xu J, et al. Increased intratumoral IL-17-producing cells correlate with poor survival in hepatocellular carcinoma patients[J]. J Hepatol, 2009, 50 (5): 980-989.
4 Tesmer LA, Lundy SK, Sarkar S, et al. Th17 cells in human disease[J]. Immunol Rev, 2008, 223: 87-113.
5 Fouser LA, Wright JF, Dunussi-Joannopoulos K, et al. Th17 cytokines and their emerging roles in inflammation and autoimmunity[J]. Immunol Rev, 2008, 226: 87-102.
6 Miyahara Y, Odunsi K, Chen W, et al. Generation and regulation of human CD4+ IL-17-producing T cells in ovarian cancer[J]. Proc Natl Acad Sci U S A, 2008, 105 (40): 15505-15510.
7 Zhu X, Mulcahy LA, Mohammed RA, et al. IL-17 expression by breast-cancer-associated macrophages: IL-17 promotes invasiveness of breast cancer cell lines[J]. Breast Cancer Res, 2008, 10 (6): R95.
8 Le Gouvello S, Bastuji-Garin S, Aloulou N, et al. High prevalence of Foxp3 and IL-17 in MMR-proficient colorectal carcinomas[J]. Gut, 2008, 57 (6): 772-779.
9 Numasaki M, Fukushi J, Ono M, et al. Interleukin-17 promotes angiogenesis and tumor growth[J]. Blood, 2003, 101 (7): 2620-2627.
10 Neurath MF, Finotto S. IL-6 signaling in autoimmunity, chronic inflammation and inflammation-associated cancer[J]. Cytokine Growth Factor Rev, 2011, 22 (2): 83-89.
11 Leeman MF, Curran S, Murray GI. The structure, regulation, and function of human matrix metalloproteinase-13[J]. Crit Rev Biochem Mol Biol, 2002, 37 (3): 149-166.
12 Dong C. TH17 cells in development: an updated view of their molecular identity and genetic programming[J]. Nat Rev Immunol, 2008, 8 (5): 337-348.

