磷脂酸含量测定法评价烟曲霉孢子对肺上皮细胞磷脂酶D活性的影响
王硕 韩雪琳 高欢 宗浩 韩黎
(1.四川师范大学生命科学学院,成都 610101;2.中国人民解放军军事医学科学院疾病预防控制所医院感染监控中心,北京 100071)
磷脂酶D(Phospholipase D,PLD)即磷脂酰胆碱磷脂水解酶 (EC3.1.4.4),普遍存在于细菌、真菌以及哺乳动物中。PLD是细胞内的重要信号效应蛋白,其活性变化可以调节多种细胞膜受体及胞内信号蛋白以发挥重要生理功能,如肌动蛋白的骨架重排,细胞分裂、分泌,免疫及炎症反应等[1]。因此,PLD已渐渐成为临床药物研发的重要治疗靶点之一。
烟曲霉 (Aspergillus fumigatus)是一种广泛存在并通过空气传播的腐生条件致病真菌。其分生孢子可以通过呼吸道进入人体引起肺部感染,引起炎症因子释放、呼吸暴发等天然免疫反应,进而引发侵袭性曲霉病。研究发现,烟曲霉孢子在被吸入肺泡后可诱发A549肺II型上皮细胞肌动蛋白骨架重排从而内化侵入细胞,并显著激活PLD[2]。目前这些反应的具体调控机制仍不清楚。
为了解析肺上皮细胞应对烟曲霉感染的天然免疫机制,对PLD信号调控机制的研究具有重要意义。众所周知,PLD可水解细胞膜磷脂生成磷脂酸(phosphotidic acid,PA)和胆碱,而PLD介导的PA生成被认为是真核细胞内重要的信号转导途径[3]。因此,我们优化了一种测定细胞内PLD活性的方法[4-5]:通过测定PA的含量间接反应PLD活性。PA在脂蛋白脂肪酶的作用下,生成3-磷酸甘油 (G3P);3-磷酸甘油在3-磷酸甘油氧化酶(GPO)作用下,生成H2O2和磷酸二羟基丙酮;H2O2在Amplex Red的作用下生成Resorufin(一种荧光物质);最后通过荧光酶标仪测定荧光强度,通过荧光强度高低反应PA含量多少,间接反应了PLD的活性。本研究以A549肺II型上皮细胞为实验对象,建立了适合肺上皮细胞磷脂酶D活性测定的方法,为进一步探讨烟曲霉内化侵入肺上皮细胞过程中PLD的基本规律及主要信号通路奠定基础。
1 材料和方法
1.1 菌株和细胞系
烟曲霉菌株为ATCC13073,生长培养基为沙堡弱 (SDA)琼脂培养基。37℃下生长3~4 d后,用含0.01%吐温80的磷酸盐缓冲液 (PBST)收获孢子,无菌脱脂纱布过滤去除菌丝,4℃保存。细胞为人肺腺癌细胞系A549,于DMEM完全培养基 (含 100 μg/mL的链霉素、100 μg/mL的青霉素和10%胎牛血清)中,置于37℃,5%的CO2培养箱中培养。
1.2 主要试剂
胎牛血清 (四季青公司),DMEM(Giobco公司)。脂蛋白脂肪酶 (lipoprotein lipase)、3-磷酸甘油氧化酶 (L-Glycerol-3-phosphate oxidase,GPO)、Amplex Red Reagent(10-acetyl-3,7-dihydrophenoxazine)、辣根过氧化物酶 (Peroxidase)、PA标准品 (PA standard)、佛波醇 (PMA)均购自Sigma公司。终止剂 (Amplex Red Stop Reagent,Invitrogen公司)。
1.3 膨胀孢子制备
烟曲霉休眠孢子以1×108/mL置于SDA液体培养基中,37℃、200 r/min恒温震荡培养箱中摇培4 h得到膨胀孢子。分别将膨胀孢子及休眠孢子转移至灭菌的15 mL离心管中,3 000 r/min离心10 min,弃上清,加入5 mL PBST涡旋振荡,于3 000 r/min离心6 min洗孢子两次,放入4℃冰箱备用(24 h内使用)。
1.4 实验方法
细胞内脂质的提取 细胞内脂质提取采用Bligh和 Dyer甲醇/氯仿法[6],并加以改良。A549细胞以1×106/皿接种于35 mm皿中,12 h后将培养液换成不含胎牛血清的DMEM培养基,置于37℃,5%的CO2培养箱中过夜培养。磷酸盐缓冲液(PBS)漂洗细胞一次,根据不同分组处理细胞;处理结束后吸出反应液,加入500 μL甲醇 (-20℃预冷);将培养皿置于冰板上,刮取细胞于离心管中,加入250 μL 1 mol/L NaCl和 500 μL 氯仿 (-20℃预冷);剧烈震荡2 min;3 400 r/min,4℃条件下离心10 min,取下层有机相450 μL,氮吹仪吹干。样品可保存于-20℃ (12 h内测定)。
PA含量的测定 用20 μL 1%TirtonX-100水溶液溶解样品;充分溶解后加入80 μL Reagent 1(包含 10 000 units/mL lipase,50 mmol/L NaCl,50 mmol/L Tris-HCl(pH7.4),37℃恒温水浴孵育1 h;96℃恒温金属浴3 min使磷脂酶热失活,变性的酶通过离心 (7 200 g,4℃,5 min)除去;取 50 μL 上清于黑色不透光96孔板中 (costar),加入50 μL Reagent 2[包含5 units/mL GPO,5 units/mL peroxidase,300 μmol/L Amplex Red Reagent,0.2%Triton X-100,40 mmol/L NaCl,40 mmol/L Tris-HCl(pH7.4)],室温孵育 30 min;加入 20 μL Amplex Red Stop Reagent室温孵育30 min;最后用荧光酶标仪 (SpectraMax M5,Molecular Devices)测量其荧光强度(激发光为544 nm,发射光为590 nm)。
实验分组 阴性对照为无孢子刺激组;阳性对照为50 ng/mL PMA刺激30 min组;血清调理孢子用含10%人血清的PBST,37℃下共孵育30 min,以感染复数 (multiplicity of infection,MOI)=10的比例,刺激细胞30 min;空白对照组无细胞,无刺激,只加反应试剂。
1.5 统计学处理
数据以测定数值减去空白对照组荧光强度为实际荧光强度值,采用GraphPad Prism 5.01和Excel进行统计检验分析,P<0.05为差异有显著性意义。本文所有结果均为3次重复的平均值。
2 结 果
2.1 PA标准曲线的建立
PA标准品用1%TirtonX-100水溶液溶解稀释至不同浓度 (5、10、20、30、40、50、60、80、100、150、200、250 μmol/L)。取20 μL 进行 PA 含量测定,每一个点代表三次重复测量结果 (Mean±SD)。结果如图1所示。PA标准品在5~250 μmol/L呈线性关系 (R2=0.990),在 5 ~60 μmol/L 线性拟合度略低 (R2=0.988)。
2.2 烟曲霉刺激A549细胞后PLD活性显著升高
用人血清调理烟曲霉膨胀孢子 (SC)刺激A549细胞30 min,对细胞内提取的脂质进行梯度稀释后测定PA含量。PA含量随稀释浓度的下降而下降(见图2),说明该方法较为稳定。PMA是PLD的激活剂,可诱导PA含量升高。烟曲霉膨胀孢子刺激细胞30 min后PA含量上升,显著高于对照组和PMA刺激组 (见图3),间接反应PLD活性增强。说明烟曲霉膨胀孢子内化侵入肺上皮细胞后可显著激活细胞内PLD活性。
2.3 烟曲霉萌发对细胞内PLD活性的影响
人血清调理烟曲霉休眠孢子 (RC)和人血清调理膨胀孢子 (SC)分别刺激A549细胞30 min,结果见图4。休眠孢子刺激30 min后细胞内PA含量无明显变化,膨胀孢子刺激30 min后则显著升高。说明,烟曲霉孢子可显著激活细胞内PLD活性。
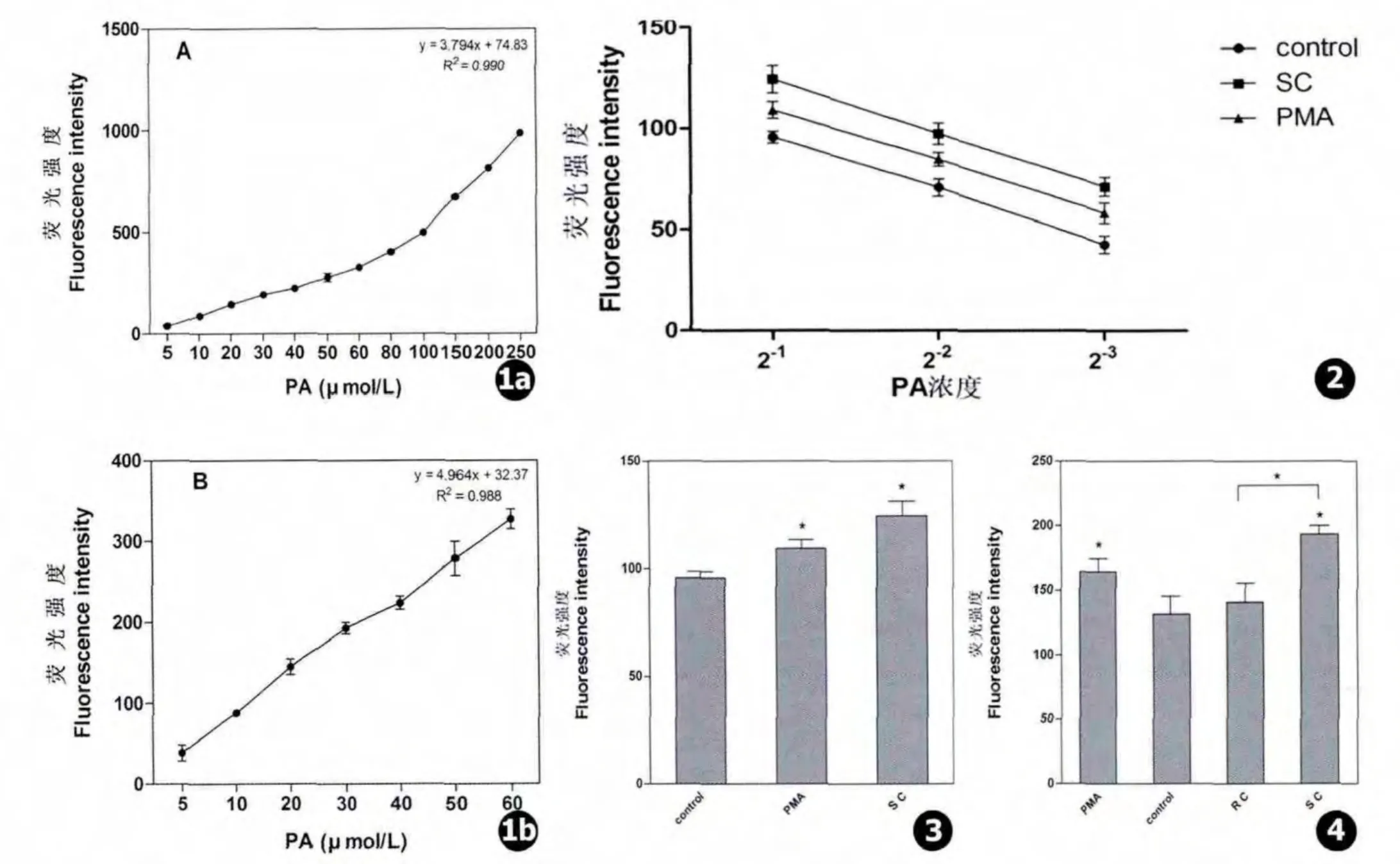
图1 PA标准曲线:a.5~250 μmol/LPA标准曲线,b.5~60 μmol/LPA标准曲线 图2 细胞内脂质提取物梯度稀释后PA含量变化 图3烟曲霉刺激对PLD活性的影响 图4 烟曲霉不同形态刺激对细胞内PLD活性的影响Fig.1 Standard curves of PA measurement up to 250 μmol/L(a)and 60 μmol/L(b)Fig.2 A test of the credibility of the PA levels measuring method used in the experiment:a curve of measured values for each diluted sample PA levels against the its diluted multiple Fig.3 A549 cells showed levels of PLD activity after incubated with the A.fumigatus Fig.4 The different morphology of A.fumigatus affects the PLD activity of A549 cells
3 讨 论
PLD是细胞内重要的跨膜信号转导酶,参与调节抗体受体及补体受体介导的多种细胞信号通路,其活性同肌动蛋白骨架改变紧密相联,并与炎症因子的释放密切相关。PLD活性影响多种细胞信号途径,如细胞生长、增殖、分化、迁移、胞吞与胞吐现象以及细胞骨架重组等。病原性真菌感染、炎症、癌症以及神经系统退变性等疾病常会引起PLD活性异常。PLD激活在病原体侵染宿主细胞过程中扮演着重要的角色,如巨噬细胞中PLD与吞噬作用密切相关,病原体刺激后PLD活性可上升10倍以上[7];单核增生李斯特菌内化侵入相应的宿主细胞后可诱导细胞骨架发生重排并激活细胞内PLD活性[8]。我们前期研究发现上皮细胞在应对烟曲霉侵染过程中伴随着PLD激活,但PLD激活与病原体侵袭宿主细胞功能的关系尚不清楚。因此,PLD活性变化的测定尤为重要。目前测定PLD活性方法主要有PLD活性测定试剂盒[9]、底物放射标记法[10]以及荧光高效液相法[11]等。其中,常用的PLD活性检测方法是底物放射标记物法:以放射标记的磷脂酰胆碱为底物,PLD催化水解其末端的磷酸二酯键生成第二信使分子磷脂酸和亲水性的胆碱;胆碱经胆碱氧化酶作用后,用液体闪烁记数仪测定反应中释放出的[3H]胆碱;根据实验中所使用的底物浓度和酶蛋白含量将实验结果转变为胆碱的释放量,从而反应PLD的活性。然而上述测定方法分别存在敏感性不高、有放射性污染和操作复杂的缺点,且对于上皮细胞中PLD活性测定并不理想。其中底物放射标记法虽然灵敏且结果准确,但是存在放射性污染,对实验室及操作人员有较高的要求,在普通实验室难以开展。我们利用PLD活性测定试剂盒开展上述实验。结果发现,试剂盒法在检测肺上皮细胞PLD活性变化中应用效果不佳,结果不稳定。
鉴于此,我们通过优化建立细胞内PA含量测定方法来间接反应PLD活性。细胞受到外源刺激后,使得 PLD活化而引起胞内 PA含量上升[12]。Amplex Red Reagent是对H2O2敏感的探针。PA在一系列酶的作用下生成H2O2;H2O2在辣根过氧化物酶存在的条件下,和Amplex Red reagent 1∶1结合产生高度荧光物质resorufin;resorufin在571和585 nm处有最大吸光度值,且在多数生物样本中荧光干扰较小。因此可以通过荧光强度的高低来反应PLD活性。我们利用该方法建立了PA标准曲线。发现PA标准品在5~250 μmol/L呈线性关系,在低浓度时这种线性拟合度略低。随后,我们检测了肺上皮细胞PLD活性变化。研究发现,该方法可以敏感而稳定的反应出PLD活性变化。烟曲霉刺激A549细胞后,PLD活性明显升高;膨胀孢子在这一过程中的激活能力显著高于休眠孢子。研究结果与本研究组之前用底物放射标记法测定结果一致[2]。
综上所述,本研究通过检测细胞内PA含量间接反应上皮细胞中PLD活性变化情况。通过对烟曲霉刺激细胞内PLD活性变化分析,认为该方法灵敏、结果准确、快速及稳定,是测定上皮细胞PLD活性变化的理想方法,为进一步研究烟曲霉内化侵入上皮细胞的机制奠定了基础。
[1]Filler S G,Sheppard D C.Fungal invasion of normally nonphagocytic host cells[J].PLoS pathogens,2006,2(12):e129.
[2]Han X,Yu R,Zhen D,et al.β-1,3-Glucan-induced host phospholipase D activation is involved inAspergillus fumigatusinternalization into type II human pneumocyte A549 cells[J].PloS one,2011,6(7):e21468.
[3]李平,周汉良.磷脂酶D和炎症的关系[J].生理科学进展,1999,30(2):118-122.
[4]Morita S,Ueda K,Kitagawa S.Enzymatic measurement of phosphatidic acid in cultured cells[J].J Lipid Res,2009,50(9):1945-1952.
[5]Antonescu C N,Danuser G,Schmid S L.Phosphatidic acid plays a regulatory role in clathrin-mediated endocytosis[J].Mol Biol Cell,2010,21(16):2944-2952.
[6]Bligh E G,Dyer W J.A rapid method of total lipid extraction and purification[J].Can J Biochem Physiol,1959,37(8):911-917.
[7]Serrander L,Fllman M,Stendahl O.Activation of phospholipase D is an early event in integrin-mediated signalling leading to phagocytosis in human neutrophils[J].Inflammation,1996,20(4):439-450.
[8]Han X,Yu R,Ji L,et al.InlB-mediated Listeria monocytogenes internalization requires a balanced phospholipase D activity maintained through phospho-cofilin[J].Mol Microbiol,2011,81(4):860-880.
[9]Moreno-García ME,López-Bojórques LN,Zentella A,et al.CD38 signaling regulates B lymphocyte activation via a phospholipase C(PLC)-γ2-independent,protein kinase C,phosphatidylcholine-PLC,and phospholipase D-dependent signaling cascade[J].J Immunol,2005,174(5):2687-2695.
[10]Vinggaard A,Jensen T,Morgan C,et al.Didecanoyl phosphatidylcholine is a superior substrate for assaying mammalian phospholipase D[J].Biochem J,1996,319(Pt 3):861-864.
[11]韩丽,毕阳,魏晋梅,等.应用荧光高效液相测定麦芽根中磷脂酶D的活性[J].天然产物研究与开发,2009,21(2):343-345.
[12]English D,Cui Y,Siddiqui RA.Messenger functions of phosphatidic acid[J].Chem Phys Lipids,1996,80(1):117-132.

