干旱胁迫下老芒麦遗传多样性分析
陈 云,闫伟红,吴 昊,曲志才
(1.曲阜师范大学 生命科学学院,山东 曲阜 273165;2.中国农业科学院草原所,内蒙古 呼和浩特 010010)
水分胁迫是植物生长发育过程中最易遭受到的生态胁迫因子[1]。研究报道,植物的抗旱性包括系统抗旱性和细胞抗旱性,二者都是由于植物体内相关基因表达的结果[2]。小麦对干旱胁迫的响应过程包括胁迫感受、渗透调控反应、激素反应、信号转导、基因表达调控、气孔运动、形态及生长速率变化等多个环节的协同作用,是一个多途径、多水平的调控过程。这个过程同时也是植物在长期进化过程中经过自然选择与人工选择而获得的对环境的适应性过程[3]。植物抗旱性和遗传多样性是环境选择的结果,评价植物的抗旱性和遗传多样性可以了解它们的生态适应性,为研发和推广抗旱品种提供理论依据。
有关植物种质资源抗旱性的评价,国内外已有许多报道,但大多侧重于植物形态及生理生化特性等方面。曾怡[4]以川西北高原的野生老芒麦种质资源为供试材料,通过对萌发期、苗期至开花期干旱胁迫条件下的生理生化、生长特性、生物量等指标的观测,探讨了干旱胁迫对老芒麦的影响,筛选出鉴定老芒麦抗旱性的重要指标。对以色列野生二粒小麦的研究发现,不同生态区干旱胁迫环境造成非编码区的微卫星序列的遗传变异和分化,致使其重复次数发生相应变化[5]。Esmaeilzadeh等[6]以AFLP分子标记和某些农艺性状评价面包小麦基因型耐旱的遗传多样性,发现AFLP分析的聚类结果与农艺性状的聚类存在相关性。对棉花耐旱相关种质的遗传多样性分析表明,高抗材料之间的遗传关系较远,其抗旱性来源于不同的遗传基础,而不抗旱材料之间的遗传关系较近[7]。韩瑞宏等[8]研究了干旱条件下草坪草的生态适应性,细胞膜、细胞壁、叶绿体超微结构的变化,草坪草对干旱胁迫的生理生化反应,以及提高草坪抗旱性的途径。至于干旱胁迫对老芒麦遗传多样性的影响,国内外报道较少。从干旱胁迫下遗传特性响应机制方面,研究不同生境下老芒麦耐旱的遗传特性,为筛选高抗旱性材料,合理开发老芒麦种质资源和遗传育种提供理论依据。
1 材料和方法
1.1 供试材料
供试材料老芒麦均由中国农业科学院草原研究所提供,所有材料均采自野外,经异地扩繁及农艺性状评价,从中筛选出20份性状优异的老芒麦,其物候期较长、穗大、牧草产量高、抗逆性较强(表1)。
1.2 试验方法
1.2.1 基因组DNA提取 称取每份材料100 mg,液氮研磨至粉状后,采用改良的CTAB法提取老芒麦基因组DNA[9,10],以0.8%琼脂糖凝胶电泳检测,置于-20 ℃备用。
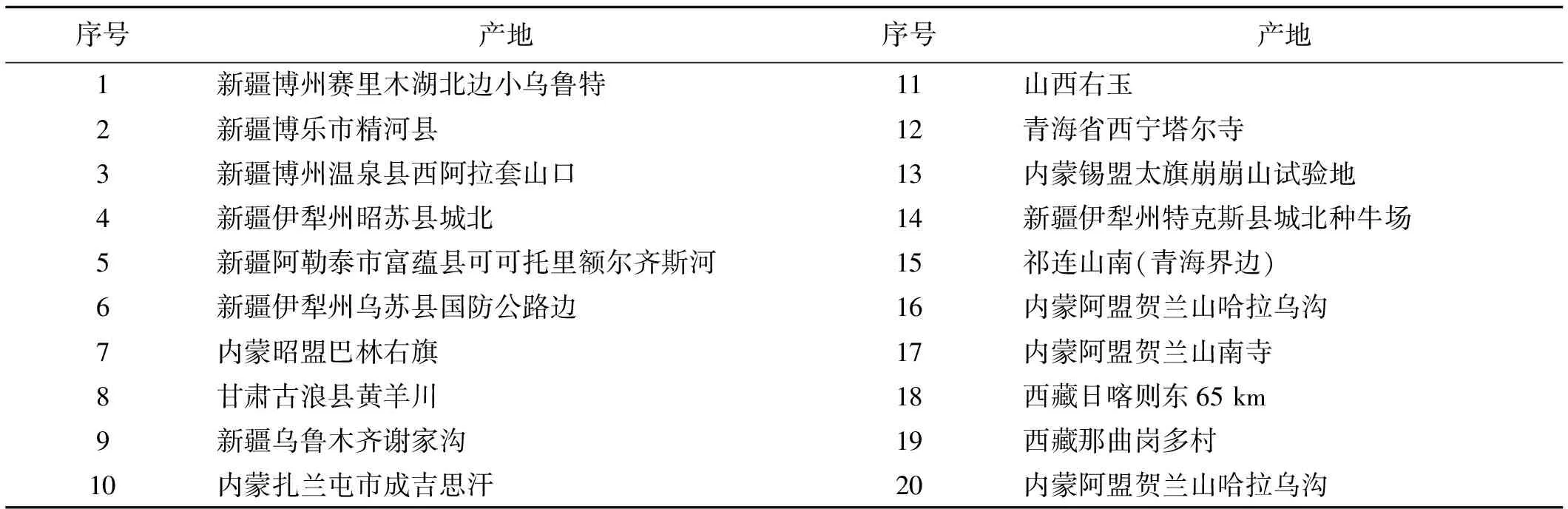
表1 供试材料老芒麦序号及产地Table 1 The information of tested Elymus sibiricus
1.2.2 SSR-PCR 参照文献[11]的体系加以优化,实验的最适体系为20 μL反应体系,即25 mmol/L MgCl21.6μL,2.5 mmol/L dNTP 1.5 μL,10(Buffer缓冲液2.0 μL,10 μmol/L上下游引物各0.6 μL,1 UTaqDNA聚合酶0.2 μL,模板DNA 0.5 μL。扩增程序为94 ℃预变性3 min;94 ℃变性60 s,50~59 ℃退火45 s (依具体引物对而定),72 ℃延伸60 s,共35个循环;最后72 ℃延伸10 min;4 ℃保存。扩增产物以1.5%的琼脂糖凝胶电泳检测。
1.3 数据处理
在老芒麦PCR扩增产物的电泳图谱中,每个条带视为一个基因位点,按同一位置上DNA条带的有无进行统计,有带的标记为“1”,无带的标记为“0”,缺失记为“2”,得到1,0数据矩阵。分别应用NTSYSpc2.1[12]软件和POPGEN 32软件,以非加权组平均法(UPGMA) 为手段进行聚类分析。
2 结果与分析
2.1 老芒麦基因组DNA提取及电泳鉴定
以改良的CTAB法提取的老芒麦基因组DNA,经琼脂糖凝胶电泳检测,大部分材料的基因组DNA纯度较高、蛋白质等杂质残留较少,可用于SSR标记分析。
2.2 SSR分子标记检测
用PEG-6000模拟自然状态下的干旱环境,对20份地理距离远且形态学差异较大的供试老芒麦材料进行胁迫处理,然后筛选出多态性高、条带清晰、重复性好的10对引物进行SSR-PCR扩增,总扩增带数115条,大小多集中在500~2 000 bp,平均每个引物对扩增出11.5条(图2),其中,多态性带数为103条,占总条带数的89.57%,平均每个引物对产生10.3条(表2);多态性信息含量(PIC)为0.255~0.473,平均为{0.368}),SSR标记效率(MI)为3.87(表2);多态性条带百分率在70%~100%,表明老芒麦有很丰富的遗传多样性。
2.3 供试材料的遗传距离分析
扩增产物采用Nei[13]的计算方法得到供试材料的遗传距离矩阵,20份老芒麦的遗传距离值在1.03~9.97(表3);由矩阵图可以看出,来自内蒙锡盟太旗崩崩山试验地的13号材料和来自新疆伊犁州特克斯县城北种牛场的14号材料之间的遗传距离最小,表明二者亲缘关系较近;而来自新疆博州温泉县西阿拉套山口的3号材料和来自新疆伊犁州昭苏县城北的4号材料之间的遗传距离最大,说明二者亲缘关系较远,这也反映了同一产地的老芒麦材料之间亲缘关系并非较近,产地距离较远的老芒麦材料之间亲缘关系也并非较远,这一趋势与干旱胁迫之前的结果一致。

图1 46-47引物对对20份老芒麦的PCR扩增产物Fig.1 PCR product of 20 accessions of Elymus sibiricus amplified by 46~47 primer pairs
注:泳道M,DNA标准分子量(DL 2000),1~20号泳道对应表1中的1~20号材料的基因组DNA扩增结果

表2 SSR引物序列及其扩增结果Table 2 The SSR primer sequences and its amplification

表3 20份老芒麦品种间的遗传距离Table 3 The genetic distance of 20 accessions of Elymus sibiricus based on the software of Ntsyspc-2.10
注:根据Ntsyspc-2.10软件得出
经POPGENE 32软件处理,可知老芒麦居群间的遗传距离介于0.160 0~0.894 8(表4),差异比较大,表明干旱胁迫后的老芒麦的遗传差异性较高,遗传变异较广。

表4 20份老芒麦之间的遗传距离Table 4 The genetic distance of 20 accessions of Elymus sibiricus based on the software of POPGENE 32
注:根据POPGENE 32软件得到
2.4 干旱胁迫前后的聚类分析
2.4.1 以NTSYSpc 2.1软件处理的聚类图与三维图 干旱胁迫前的聚类图表明,在遗传距离为0.57处20份供试材料被聚为两类,来自西藏的18,19号材料聚为一类,其余的材料聚为一类,在遗传距离为0.62处第1大类又被分为2类(图2),即1,2,3,14,4,5,15,16聚在一起,6,9,10,8,7,11,13,17,12聚在一起。
胁迫处理后的老芒麦,在遗传距离为0.36处分为两类,即Ⅰ,Ⅱ和Ⅲ两大类,除7号材料外其余材料归为一类,在遗传距离为0.50处第Ⅰ大类又被分为Ⅰ和Ⅱ两类(图2B),1,10,2,3,4,5,8,13,14,15,16,6,9,12聚为一类。
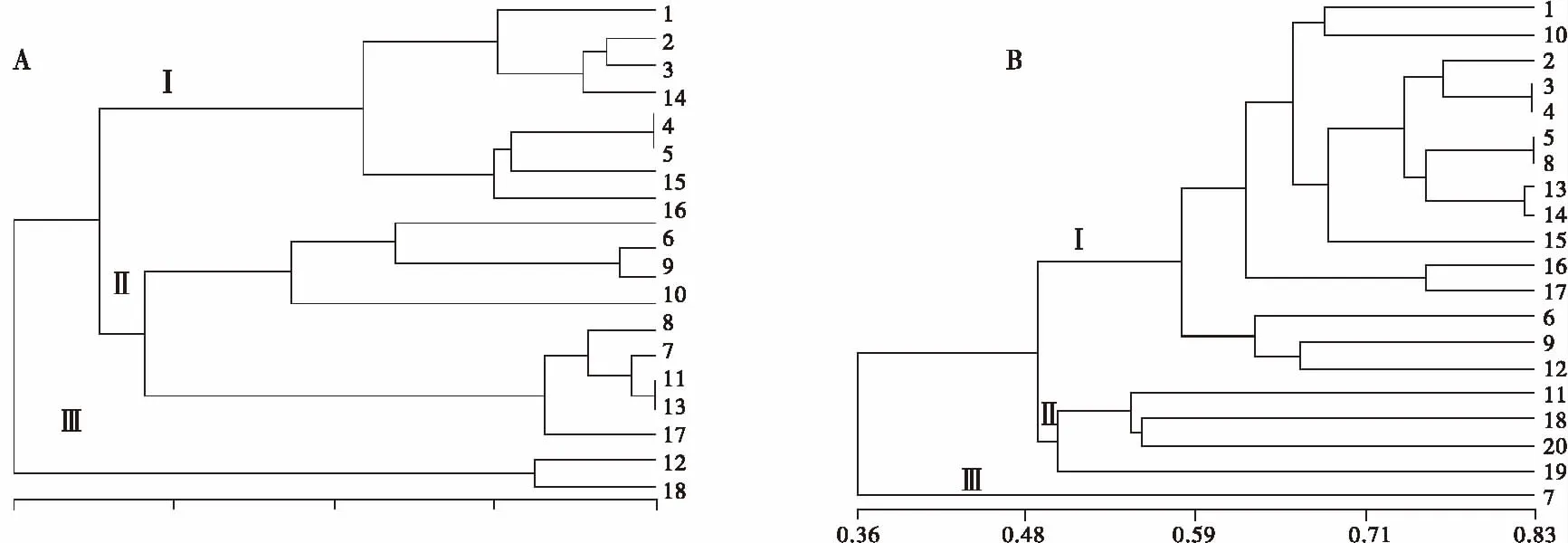
图2 干旱胁迫处理前(A)后(B)老芒麦的类平均法聚类Fig.2 The cluster dendrogram using average linkage clustering of Elymus sibiricus before and after drought stress treatments
以相同软件构建的老芒麦材料的三维聚类图可以非常直观地反映所测试居群的整体结构(图3)。但胁迫前后的三维图差别比较明显。
2.4.2 以POPGENE 32软件处理的聚类图 由图4可以看出不同软件处理的聚类结果基本一致,且胁迫前的聚类结果明显不同于胁迫后的聚类结果。
2.4.3 干旱胁迫前后的聚类结果比较 比较干旱胁迫前后的聚类结果发现,胁迫前来自新疆的4、5号材料聚为一类,而干旱处理后4号却与同样来自新疆的2、3号聚在一起,5号材料与来自甘肃的8号材料聚为一类;胁迫前来自内蒙的7号和13、17号聚在一起,而处理后7号却单独聚为一类;胁迫前来自内蒙的10号材料与来自新疆的6、9号,甘肃的8号材料聚在一起,而胁迫处理后10号却与来自新疆的1号聚在一起,这表明干旱胁迫前后聚类结果差别较大。
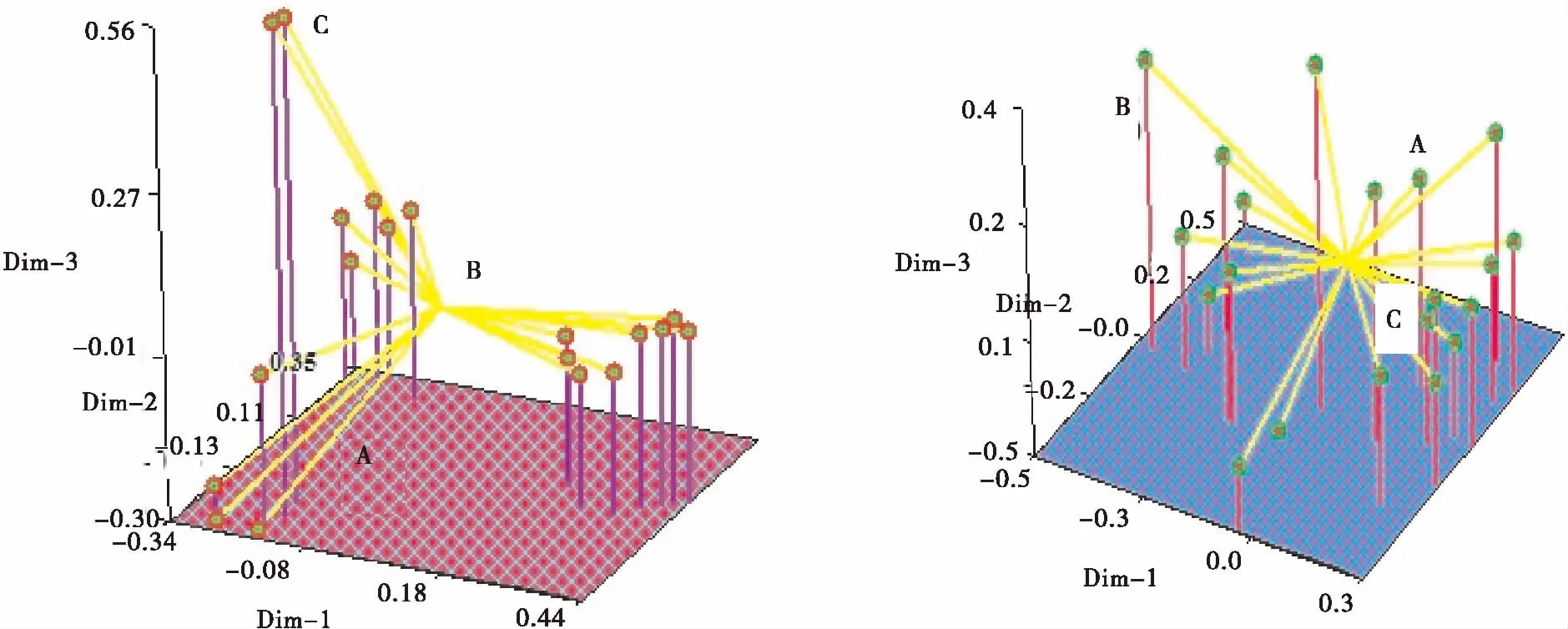
图3 干旱胁迫处理前(A)后(B)老芒麦的三维图Fig.3 Three dimensional diagram of 20 accessions of Elymus sibiricus before and after drought stress treatments
注:A,B,C分别对应图2中的Ⅰ,Ⅱ,Ⅲ
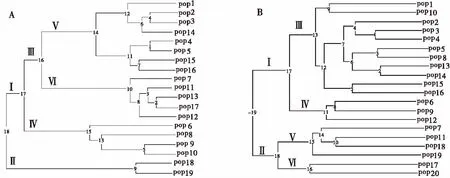
图4 干旱胁迫处理前(A)后(B)老芒麦的类平均法聚类Fig.4 Figure 2 The cluster dendrogram using average linkage clustering of Elymus sibiricus before and after drought stress treatments
3 讨论
3.1 胁迫处理前材料的遗传多样性分析
干旱胁迫处理前聚类(图2A)表明,采自新疆的1,2,3,14,4,5号材料聚在一起,采自内蒙的7,13,17号材料聚在一起,采自西藏的18,19号材料聚在一起,表明产地相同的材料大多聚为一类,但同样是采自青海的12和15号材料,同样是采自内蒙的10号和16号材料却不聚在一起,表明聚类结果与其地理来源并非完全一致。其原因可能有两方面,一是有些地区采集的样本数量有限,例如山西和青海地区仅采集了一份样本,这在一定程度上使得聚类结果精确性降低,研究报道表明遗传多样性水平和群体样本数量间存在明显的相关性,为此,未来在采样时应充分考虑样本数量和采集地范围的大小,减小因材料数量太少、来源过于集中对研究结果造成的影响[14-16]。二是基因突变,不同产地的样本在异地扩繁多年,受扩繁环境的影响程度不同,以及对不利环境的耐受性不同,可能引起耐受性低的材料有关基因发生突变,并且这种变异能够遗传。
3.2 胁迫处理后材料的遗传多样性分析
20份老芒麦的SSR-PCR分析显示多态性条带百分率在70%~100%,而不同地域居群间的遗传距离介于0.160 0~0.894 8,差异比较大,说明其遗传分化程度较高,遗传多样性丰富,遗传变异较广。多态性信息含量(PIC)为0.255~0.473,平均为0.368,SSR标记效率(MI)为3.87,说明运用SSR分子标记能够较好地揭示野生老芒麦的遗传多样性及亲缘关系。
试验研究中,供试材料的Nei’s 遗传多样性指数(He)为0.332 4,明显高于单子叶植物Nei’s 遗传多样性的平均值0.190[17],Shannon’s 信息多样性指数Ho为0.492 6,同样表明老芒麦不同居群间的遗传多样性较高。从DNA分子水平上证实了老芒麦遗传多样性丰富,有大量可供选择利用的优异性状和种质资源[16]。因此,应深入研究和合理开发利用老芒麦遗传种质资源,提高其产量和扩大种植范围,提高其利用率。
胁迫处理后的聚类图(图2B)表明,第Ⅰ大类中1,2,3,4,5,14,6,9均采自新疆,但6号和9号与其他6份材料遗传距离仍然较远,15和12号材料均采自青海,但二者遗传距离也较远,其原因与胁迫前相同,主要是耐受异地环境影响的能力不同。
胁迫后原来与新疆6号和9号聚在一起的内蒙10号材料却与新疆的1,2,3,4,5号材料聚在一起,之前与内蒙13,17号材料聚在一起的7号材料在干旱处理后却单独聚为一类,胁迫前内蒙13,17号材料遗传距离较近,经干旱处理后遗传距离变得较远,推测其原因可能是采自内蒙的供试材料由于适应了特定的生境条件,对干旱模拟较为敏感,造成非编码区的微卫星序列的遗传变异和分化或微卫星不稳定等,致使其重复次数发生相应变化[5],由于干旱胁迫下信号传递和基因表达及其调控非常复杂,对干旱敏感的基因和抗干旱基因的突变分析仍比较困难,因此,必须在此领域进行深入广泛的研究[18]。
3.3 胁迫前后聚类结果的比较
POPGENE软件比NTSYS软件运行简便、快捷,且可以测多种遗传多样性参数,包括等位基因数,Nei’s遗传多样性指数,Shannon’s多样性信息指数,多态位点百分率,遗传分化值,基因流等。试验使用两个软件处理遗传多样性参数,所得聚类结果基本一致。
基于干旱胁迫前后老芒麦的聚类结果,比较发现胁迫前后差异较大。有两方面原因:(1)适应特定生境的老芒麦对干旱模拟较为敏感,造成非编码区的微卫星序列的遗传变异和分化或微卫星不稳定等,致使其重复次数发生相应变化[5];(2)由于老芒麦受生境条件的影响较大,在地理距离较小时,干旱产生的差异性较为突出;随着地理距离的增大,地理位置产生的差异超出干旱引起的差异,这与一些学者的研究结果一致。通过研究气候效应对以色列二粒小麦微卫星多样性的影响,发现在地理范围较大时小气候的选择作用阻碍了基因漂移,从而造成较大的遗传分化[19]。在研究欧洲盐沼披碱草属的种群遗传结构时,发现在小地理范围(<100 m)下,具有独特生境的披碱草居群有很明显的遗传变异,超过60 km时,地理距离隔离造成的影响变弱,并总结出总遗传变异的14%是由生境造成的,8.9%与地理距离有关[20],进一步肯定了生境条件对披碱草属植物遗传变异的影响。遗传上的变异是物种进化和选择的基础,在育种上的地位十分重要[21]。因此,应采取适当的措施妥善保存并合理开发利用。
干旱胁迫处理的20份不同居群的老芒麦遗传多样性丰富,多态性比例为89.565%,SSR标记效率(MI)为3.87,Nei’s遗传多样性指数(He)为0.332 4,Shannon指数(Ho)为0.492 6。胁迫处理材料与同批材料胁迫前的聚类结果差异较大。胁迫前后UPGMA聚类都表明产地相同的材料大多聚为一类,但不完全一致,其中来自内蒙古的材料胁迫前后差异较大。
参考文献:
[1] 马彦军,曹致中,李毅.PEG胁迫对尖叶胡枝子幼苗SOD和POD同工酶的影响[J].草原与草坪,2010,30(1):64-67.
[2] 康宗利,杨玉红,张立军.植物响应干旱胁迫的分子机制[J].玉米科学,2006,14(2):96-100.
[3] 邵宏波,梁宗锁,邵明安.小麦抗旱生理生化与分子生物学研究进展[J].草业学报,2006,15(3):5-17.
[4] 曾怡.川西北高原野生老芒麦种质资源抗旱性初步研究[D].雅安:四川农业大学,2009.
[5] Li Y C,Röder M S,Fahima T,etal.Natural selection causing microsatellite divergence in wild emmer wheat at the ecologically variable microsite at Ammiad,Israel[J].TAG,2000,100:985-999.
[6] Esmaeilzadeh M,Moghaddam,Trethowan R M,etal.Assessment of genetic diversity in bread wheat genotypes for tolerance to drought using AFLPs and agronomictraits[J].Euphytica,2005,141:147-156.
[7] 王俊娟.陆地棉种质资源的抗旱性评价及遗传研究[D].北京:中国农业科学院,2011.
[8] 韩瑞宏,毛凯,干友民,等.干旱对草坪草的影响[J].草原与草坪,2003(5):8-10.
[9] Hewitt G M,Johnston A.Molecular Techniques in Taxonomy[M].Berlin,Germany:Springer-Verlag Press,1991:283-293.
[10] Doyle J J.DNA protocols for plants-CTAB total DNA isolation[A]//Hewitt G M,Johnston A.Molecular Techniques in Taxonomy.Berlin,Germany:Springer-Verlag Press,1991:283-293.
[11] 张文妤,曹社会,曹仲华,等.西藏披碱草属野生牧草种质资源的遗传多样性分析与分子聚类研究[J].西北农林科技大学学报(自然科学版),2008,36(6):39-44.
[12] Rohlf F J.NTSYSpc numerical taxonomy and multivariate analysis system,version 2.1[D].New York:User Guide.Exeter Software.Setauket,2000.
[13] Nei M,Li W.Mathematical model for study the genetic variation in terms of restriction endonucleases[J].Proceedings of the National Academy of Sciences of the United States of America,1979,74:5267-5273.
[14] Godt M J W,Johnson B R,Hamrick J L.Genetic diversity and population size in four rare southern Appalachian plant species[J].Conservation Biology,1996,10:796-805.
[15] Sun M.Effects of population size,mating system,and evolutionary origin on genetic diversity in Spiranthes sinensis and S.hongkongensis[J].Conservation Biology,1996,10:785-795.
[16] 鄢家俊,白史且,常丹,等.青藏高原老芒麦种质遗传多样性的SSR分析[J].中国农学通报,2010,26(9):26-33.
[17] Nybom H,Bartish Igor V.Effects of life history traits and sampling strategies on genetic diversity estimates obtained with RAPD markers in plants[J].Perspectives in Plant Ecology Evolution and Systematics,2000(3):93-114.
[18] 万东石,李红玉,张立新,等.植物体内干旱信号的传递与基因表达[J].西北植物学报,2003,23(1):151-157.
[19] Li Y C,Röder M S,Fahima T,etal.Climatic effects on microsatellite diversity in wild emmer wheat (Triticumdicoccoides) at the Yehudiyya microsite,Israel[J].Heredity (Edinb),2002,89(2):127-32.
[20] Bockelmarm A C,Reusch TB H,Bijsma R.Habitat differentiation vs.isolation-by-distance:The genetic population structure ofElymusathericusinEuropean salt marshes[J].Molecular Ecology,2003,12:505-515.
[21] 米福贵.分子标记技术在植物育种中的应用[J].草原与草坪,2000(2):3-7.

