慢性阻塞性肺疾病患者血清和痰液中表面活性蛋白D的水平及临床意义
段艳红 杜春玲 肖建 周锋 徐栋辉 吴超民 周磊
(复旦大学附属中山医院青浦分院呼吸内科,上海 201700)
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)在我国的发病率不断升高,成为老年人群致死、致残的重要原因[1]。肺表面活性物质由肺泡II型上皮细胞分泌,具有保证肺部的通气和换气功能、提高肺部的防御机制等功能[2]。肺表面活性蛋白-D(surfactant protein-D,SP-D)是肺表面活性蛋白(surfactant protein,SP)之一,具有抗感染、抗病毒、免疫调节等功能[3]。近年来,有研究[4]表明,血清SP-D水平的检测有助于诊断慢性阻塞性肺疾病急性加重期(acute exacerbation of COPD, AECOPD) 。然而,关于痰液中SP-D浓度与血清中SP-D浓度的关系以及COPD患者病情变化时二者的变化,目前尚无相关报告。本研究采用AECOPD及稳定期COPD患者血清和痰液中的SP-D水平,探讨COPD病情变化时的二者关系,现报告如下。
1 资料与方法
1.1 一般资料 选取2012年12月—2013年12月我院收治的AECOPD患者34例(A组)以及COPD稳定期患者37例(B组);选择30名有嗜烟史的健康人(C组)以及30名无嗜烟史的健康人(D组)。4组受试者的性别、年龄差异无统计学意义(P>0.05)。A、B、C组的吸烟指数差异无统计学意义(P>0.05),A、B组的病程差异无统计学意义(P>0.05)。见表1。
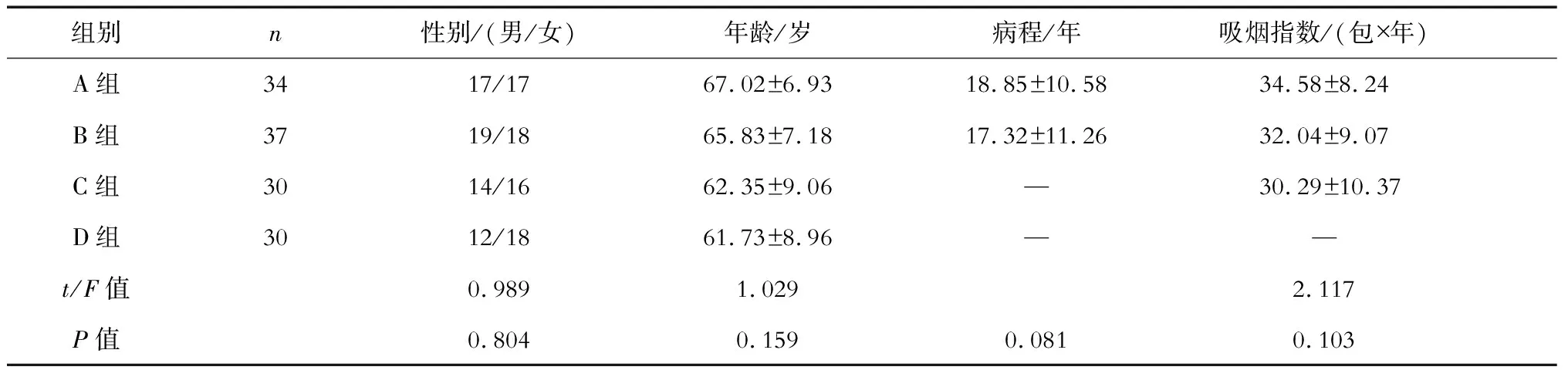
表1 4组患者的一般资料比较
1.2 纳入标准 参照中华医学会呼吸病学分会慢性阻塞性肺疾病学组发布的《慢性阻塞性肺疾病诊治指南》[5]中的诊断标准进行诊断。A、B组患者均有不同程度的长期咳嗽、咯痰病史,结合胸部X线片表现、肺功能检查指标等,确诊为COPD。A组患者在COPD病史的基础上,有咳嗽、咳痰、呼吸困难等症状的急性加重,可伴有呼吸衰竭、意识障碍等,由此诊断为AECOPD。排除急性肺栓塞、支气管哮喘等其他呼吸系统疾病患者;排除合并恶性肿瘤、严重心肝肾功能不全、凝血功能障碍、急性心脑血管事件的患者;排除近期接受过糖皮质激素治疗或者长期吸入糖皮质激素和长效支气管扩张剂的患者。
1.3 研究方法 A、B组患者入院后均按照COPD诊疗常规进行治疗,包括吸氧、抗感染、化痰等;A组患者根据病情给予解痉平喘治疗并监测生命体征,必要时行气管内插管、呼吸机辅助通气等。A、B组患者入院后第2天清晨空腹抽取外周静脉血4 mL,C、D组受试者在预定时间清晨空腹抽取外周静脉血4 mL。将静脉血在室温下静置30 min,然后以3000 r/min的速率离心10 min,采集上层血清液,贮存于-70℃的环境中待测。4组受试者用灭菌注射用水漱口后,雾化吸入5 mL 3%氯化钠液以诱导咯痰,用无菌培养皿收集痰液,加入0.1%的二硫苏糖醇(加入量约为痰液体积的4倍),涡旋震荡10 min后,再加相同体积的磷酸盐缓冲液并震荡5 min,然后以2000 r/min的速率离心10 min,吸取上层清液并贮存于-70℃待测。采用酶联免疫吸附法(SP-D试剂盒由北京方程生物科技有限公司提供)检测血清和痰液SP-D水平。

2 结 果
2.1 4组受试者的血清、痰液SP-D水平的比较 A组血清SP-D水平为(165.09±16.72)ng/mL,显著高于B、C、D组(P<0.05);A组痰液SP-D水平为(109.03±18.95)ng/mL,显著低于B、C、D组(P<0.05)。B组血清SP-D水平为(126.48±15.64)ng/mL,显著高于C、D组(P<0.05);B组痰液SP-D水平为(133.28±16.36)ng/mL,显著低于C、D组(P<0.05)。C组血清SP-D水平为(72.85±8.62)ng/mL,显著高于D组(P<0.05);C组痰液SP-D水平为(260.04±47.91)ng/mL,显著低于D组(P<0.05)。见表2。

表2 4组受试者血清、痰液SP-D水平的比较
2.2 AECOPD患者痰液SP-D和血清SP-D水平的相关性分析 Pearson相关性分析显示,AECOPD患者的血清SP-D水平和痰液SP-D水平呈负相关(r=-0.698,P<0.05)。
3 讨 论
COPD呈慢性病程,病情容易反复,随着病情的进展,患者的肺功能进行性下降,可并发呼吸衰竭、肺心病而威胁患者的生命[6]。在COPD的发病和病情变化的过程中,炎性细胞浸润、各种细胞因子介导的非特异性炎性反应发挥了重要作用[7]。SP-D由Clara细胞和肺泡II型上皮细胞分泌,近年研究[8]证实,SP-D在机体免疫调节以及抵抗病原微生物方面起重要作用。
近年来,有关血清SP-D水平和COPD病情关系的研究逐渐深入,关键等[9]的研究证实,相对于健康人群,COPD患者的血清SP-D水平显著升高,本研究的结果与之基本一致。此外,本研究中AECOPD患者的血清SP-D水平显著高于COPD稳定期患者,这说明检测血清SP-D水平有助于评估COPD患者的病情,对临床COPD的诊治有一定指导意义。周忠海等[10]发现,COPD患者SP-D水平越高,一秒用力呼气容积(FEV1)越低, COPD病情越严重,这也证实,对血清SP-D的检测有助于评估COPD病情。本研究进一步比较了健康人群中有嗜烟史和无嗜烟史患者的SP-D水平,结果发现,前者的血清SP-D水平显著高于后者。研究[11-12]表明,吸烟过程中产生的各种有害物质进入呼吸道后,可损伤呼吸道黏膜,并诱导非特异性炎性反应,使SP-D的浓度升高,肺毛细血管损伤后通透性增加,SP-D进入血中,由此导致血清SP-D水平显著升高。
本研究对4组的痰液SP-D水平的检测发现,A组患者的痰液SP-D水平显著低于其余3组,C组的痰液SP-D水平则显著低于D组;同时,AECOPD患者血清SP-D水平和痰液SP-D水平呈负相关。这说明COPD患者病情越重,其痰液SP-D水平越低,而有嗜烟史的健康人群其痰液中SP-D水平也显著下降。这主要是由于SP-D为亲水性蛋白,COPD患者和有长期嗜烟史的健康人群的肺组织均有不同程度的炎性反应,肺血管通透性增加,SP-D向血清扩散的速度增加,肺组织中的SP-D浓度则随之降低[13]。这提示除了监测患者的血清SP-D水平外,痰液SP-D水平的监测也对COPD病情的评估也有重要的参考价值。
综上所述,血清和痰液SP-D水平的监测均有助于临床AECOPD病情的评估,且两者呈负相关。
[1]蔡柏蔷. 2010年慢性阻塞性肺疾病的研究进展[J]. 中华结核和呼吸杂志, 2011, 34(4): 294-298.
[2]Parra E1, Moleiro LH, López-Montero I et al. A combined action of pulmonary surfactant proteins SP-B and SP-C modulates permeability and dynamics of phospholipid membranes[J]. Biochem J, 2011, 438(3): 555-564.
[3]Atochina-Vasserman EN. S-nitrosylation of surfactant protein D as a modulator of pulmonary inflammation[J]. Biochim Biophys Acta, 2012, 1820(6): 763-769.
[4]吴友茹, 陈明勇, 李惠, 等. 慢性阻塞性肺疾病急性加重期患者血浆SP-D水平测定及临床意义[J]. 重庆医学, 2011, 40(36): 3701-3702.
[5]中华医学会呼吸病学分会. 慢性阻塞性肺疾病学组.慢性阻塞性肺疾病诊治指南(2007年修订版)[J]. 中华结核和呼吸杂志, 2007, 30(1): 8-17.
[6]Galera R, Casitas R, Martínez E, et al. Exercise oxygen flow titration methods in COPD patients with respiratory failure[J]. Respir med, 2012, 106(11): 1544-1550.
[7]Eustace A, Smyth LJ, Mitchell L, et al. Identification of cells expressing IL-17A and IL-17F in the lungs of patients with COPD[J]. Chest, 2011, 139(5): 1089-1100.
[8]Duvoix A, Miranda E, Perez J, et al. Evaluation of full-length, cleaved and nitrosylated serum surfactant protein D as biomarkers for COPD[J]. COPD, 2011, 8(2): 79-95.
[9]关键, 罗倩, 李敬萍, 等. COPD患者血浆SP-A、SP-D水平变化及意义[J]. 石河子大学学报(自然科学版), 2013, 31(2): 206-209.
[10]周忠海, 雷霆, 颜春松, 等. 慢性阻塞性肺疾病稳定期血清肺表面活性蛋白D和C-反应蛋白与各因素之间的关系探讨[J]. 中国全科医学, 2011, 14(22): 2528-2530.
[11]老启芳, 钟小宁, 何志义, 等. 肺功能正常吸烟者和慢性阻塞性肺疾病患者肺腺泡动脉炎症特征[J]. 中华内科杂志, 2011, 50(10): 839-844.
[12]Warnier MJ, van Riet EE, Rutten FH, et al. Smoking cessation strategies in patients with COPD[J]. Eur Respir J, 2013, 41(3): 727-734.
[13]刘双林, 沈奕播, 李琦, 等. 慢性阻塞性肺疾病急性加重时血清和痰液中SP-D的变化和临床意义[J]. 中华肺部疾病杂志(电子版), 2013, 6(2): 26-29.

