细柄蕈树嫩枝扦插生根过程中内源激素动态特性研究
范俊俊, 张往祥, 蔡喜彦, 赵明明, 魏宏亮
(南京林业大学林学院,江苏 南京 210037)
细柄蕈树嫩枝扦插生根过程中内源激素动态特性研究
范俊俊, 张往祥*, 蔡喜彦, 赵明明, 魏宏亮
(南京林业大学林学院,江苏 南京 210037)
以3年生细柄蕈树实生苗嫩枝为试验材料,运用酶联免疫吸附测定法(ELISA),研究其在扦插生根过程中内源激素含量的变化,旨在揭示细柄蕈树扦插生根的机理。结果表明,与CK相比,以质量浓度300 mg/L的NAA处理插穗,能有效缩短其生根周期;扦插生根过程中,NAA处理与CK的几种内源激素(IAA、ZT和ABA)含量随时间变化的趋势相同,均呈正“V”形变化;NAA处理可调节内源激素,促进不定根的形成和发育;不定根形成期间,NAA处理与CK的IAA/ZT、IAA/GA3和IAA/ABA谷值的出现时间(20 d和30 d)与愈伤组织形成期重合,内源激素的这种节奏性变化反映了生根与生理之间的协同性。
细柄蕈树;扦插;内源激素
细柄蕈树(Altingiagracilipes)是金缕梅科蕈树属优良的速生阔叶常绿乔木,喜温暖湿润,其根系发达,对土壤要求并不十分严格,主要分布于浙江南部、福建及广东地区,树脂可供药用和香料之用,木材可供建筑和制家具[1]。其树冠庞大,树形优美,树干通直,具有较高观赏价值,是优良生态造林和绿化树种。现存的细柄蕈树大多处于野生状态,其优良特性还未被挖掘利用[2-3],应积极人工繁殖造林,加快其推广促进产业发展。细柄蕈树可播种繁殖,但是其蒴果出籽率低,仅有1.285%[2],且后代易产生性状变异,不易保持亲本优良性状。目前很多苗木在生产中都采用扦插繁殖技术,一套完善的扦插技术不仅能缩短培育周期,还能保证品种特性,快速成型、开花。细柄蕈树扦插繁殖技术还处于摸索阶段[4-5],并且局限在繁殖技术上,并没有对扦插生根机理做进一步的研究。因此,本文主要从细柄蕈树扦插生根过程中内源激素含量及比值的动态变化来研究不定根的发生,为揭示细柄蕈树的生根机理、高效繁殖和开发利用提供理论和技术依据。
1 材料与方法
1.1 材料
试验插穗取材于江苏省扬州市江都区苗圃基地种植的3 年生细柄蕈树实生苗。选择无病虫害的半木质化枝条(嫩枝),采后立即放入水桶并带回实验室,将其剪成8~10 cm的段作插穗,每段保留2~3片叶子,每片叶子保留基部的1/3叶面积。
1.2 方法
1.2.1 试验设计 试验设处理2组,即清水对照(CK)和用300 mg/L NAA浸插条基部2 h。每个处理重复3次,每个重复30株。扦插15 d后,进行插穗生根动态观测。以后每隔3 d在每个处理中随机挑选3株观测记录插穗愈伤组织形成期、不定根开始发生期和不定根大量生成期。扦插后每隔10 d取样,用保鲜盒立即带回实验室,迅速将插穗基部2 cm处的韧皮部切下来并剪碎、混匀,放入-74 ℃的超低温冰箱中保存待用。
1.2.2 扦插及插后管理 试验于2012年8月11日在南京林业大学银杏园内全光照自动间歇式喷雾扦插苗床上进行。插床基质为珍珠岩和蛭石(2∶1 体积比)的混合物,基质层厚度15 cm。扦插前加多菌灵进行消毒。扦插采用直插,株行距为4 cm×4 cm,深度为3~4 cm。扦插1个月后,每隔15 d喷施浓度为0.3%的多菌灵溶液进行消毒,减少病虫害。
1.2.3 测定方法 生长素(IAA)、玉米素(ZT)、赤霉素(GA3)、脱落酸(ABA)等4种内源激素的含量采用酶联免疫法(ELISA)[6]测定,试剂盒由中国农业大学提供。每样准确称取细柄蕈树插穗韧皮部样品0.2 g,重复3次。
2 结果与分析
2.1 扦插生根情况
结果见表1。

表1 细柄蕈树嫩枝插穗生根时间
从表1可以看出,与CK相比,以质量浓度300 mg/L的NAA处理插穗,能有效缩短其生根周期。CK产生愈伤组织需30 d左右,不定根开始发生需40 d左右,不定根大量生成需50 d左右;而NAA处理形成愈伤组织只需20 d左右,不定根开始发生只需25 d左右,不定根大量生成只需35 d左右。
2.2 扦插生根过程中的内源激素含量变化
结果如图1所示。扦插生根过程中,NAA处理与CK的IAA含量均呈正“V”字形变化,扦插初期插穗体内IAA含量不断下降,直至不定根突出后IAA含量开始上升。NAA处理的IAA含量均低于CK,在扦插20 d时达到谷值,比CK提前10 d。

图1 细柄蕈树柄扦插生根过程中IAA,ZT,GA3和ABA含量变化
GA3含量变化与IAA含量变化截然不同,NAA处理与CK均呈倒“V”字形变化,扦插初期插穗体内GA3含量不断上升,直至不定根开始大量发生时含量开始下降。NAA处理第30 d达到峰值,比CK提前10 d。在第30 d之前,NAA处理GA3含量均高于CK,第30 d之后低于CK。
在不定根大量形成前,ZT含量经扦插初期骤增后呈正“V”字形变化,不定根开始发生时ZT含量最低。NAA处理在第20 d时达到谷值,比CK提前10 d。扦插生根过程中,NAA处理ZT含量均高于CK。
ABA含量经扦插初期骤增之后均呈正“V”字形变化,NAA处理在第40 d时达到谷值,均比CK提前10 d。扦插生根过程中,NAA处理ZT含量基本低于CK。
2.3 扦插生根过程中的内源激素比值变化
细柄蕈树扦插生根过程中IAA/ZT、IAA/GA3和IAA/ABA的变化见图2。
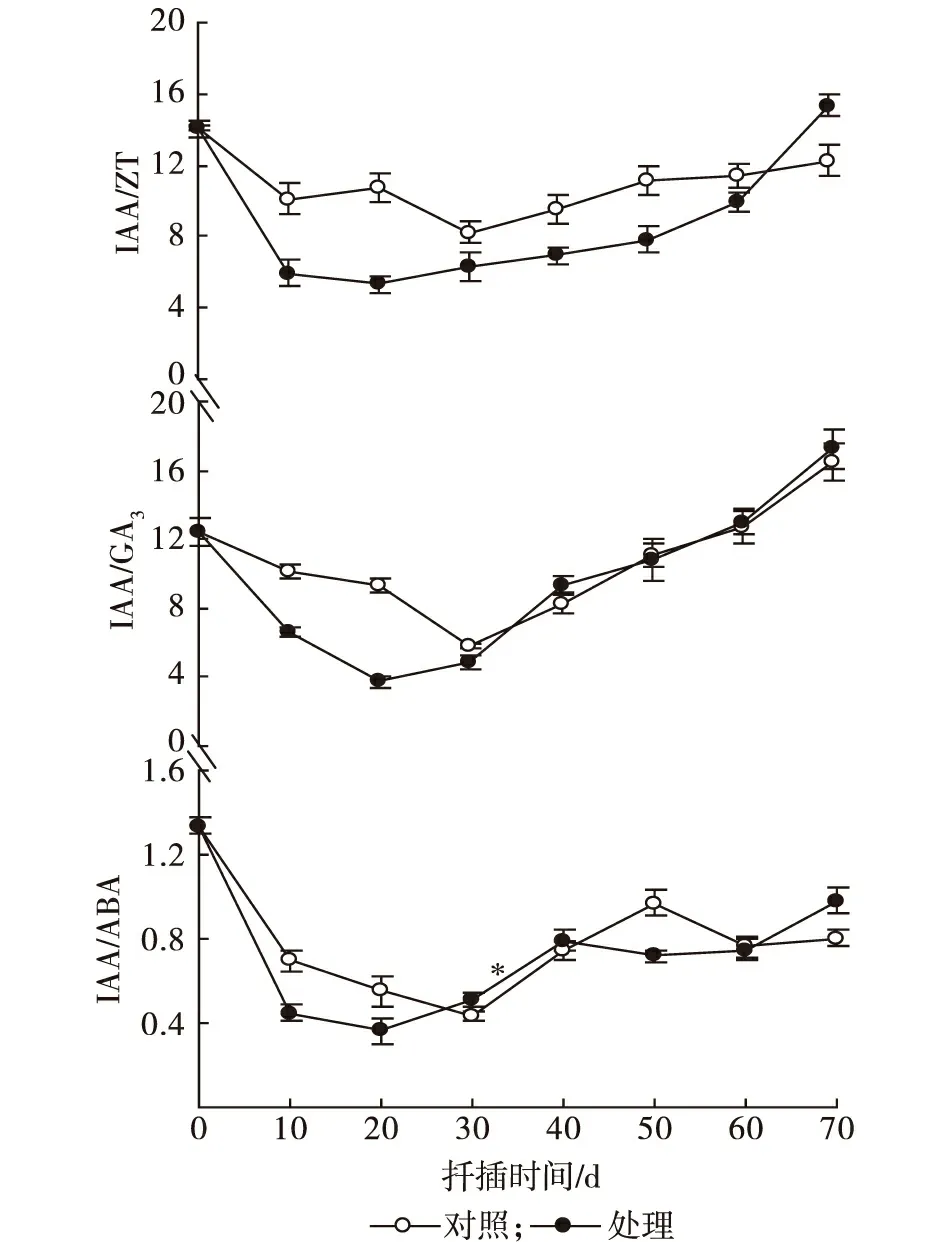
图2 细柄蕈树扦插生根过程中IAA/ZT,IAA/GA3和IAA/ABA值变化
就IAA/ZT而言,NAA处理与CK变化趋势相同,均呈正“V”字形变化,但NAA处理比CK反应快,在第20 d就已经达到谷值,比CK早10 d。扦插生根过程中,两处理IAA/ZT值始终大于1,NAA处理IAA/ZT低于CK。
IAA/GA3变化与IAA/ZT变化趋势相同,呈正“V”字形变化。NAA处理比CK反应快,在第20 d就已经达到谷值,比CK早10 d。扦插生根过程中,IAA/GA3值均大于1,在30 d前NAA处理IAA/GA3低于CK。在不定根大量形成前,NAA处理与CK的IAA/ABA变化趋势相同,均呈正“V”字形变化。NAA处理在第20 d达到谷值,比CK早10 d。
3 结论与讨论
(1)外源激素与插穗不定根形成之间存在密切的关系[7-11]。应用外源激素预处理插穗,可使难生根树种生根[12-15]。在扦插育苗中,刺激生根效果显著的生长素有NAA、IAA、IBA、2,4-D等[16-19]。本研究中,细柄蕈树插穗经300 mg/LNAA处理后,愈伤组织形成、不定根开始形成以及不定根大量形成时期均比CK提前10 d,有效缩短了生根时间。在苗圃管理过程中,扦插初期要加强扦插环境内的病菌防治和水分管理。在扦插40 d内(生根高峰期),要及时补充营养元素,促进苗木生根、生长,缩短苗木出圃时间。
(2)普遍认为IAA是促进不定根形成的主要激素[20],ABA则通过抑制IAA的运输和离体器官的生长,从而抑制不定根的形成[16]。GA3对不定根发生的影响观点不一,但多数试验表明高浓度GA3抑制不定根形成[7]。ZT对插穗生根的影响与生根时期及其浓度有关[21]。本研究中,在愈伤组织和根原基形成的过程中,IAA不断被氧化,含量逐渐减少,在不定根突出前,IAA和ZT含量均处于谷值,说明低浓度IAA及ZT对不定根的启动和萌发有重要影响,而在不定根发生期2激素含量不断上升以促进根的分化和生长,这与前人[22-25]研究结果一致。GA3含量变化与IAA呈一定的消长关系,在愈伤组织形成时期,GA3含量不断上升,说明愈伤组织形成过程中需要合成大量的GA3[26-27],在不定根发生期GA3含量不断下降以促进根细胞分裂和分化[28]。ABA含量在扦插初期骤增可能为降低逆境对插穗的伤害,不定根形成期含量下降利于生根,这与前人的结论一致[29]。
(3)促进扦插生根的基本原理是调节插穗体内生根抑制物质含量和生根促进物质含量之间的动态平衡,扦插过程中插穗内源激素比值的变化也陆续被证明与生根关系密切[30-33]。本试验发现,NAA处理插穗与CK在扦插生根过程中,体内激素比值IAA/ZT,IAA/GA3和IAA/ABA均呈正“V”字形变化,其谷值的出现时间前者为第20 d,后者为第30 d,与愈伤组织形成期重合,内源激素的这种节奏性变化反映了生根与生理之间的协同性。外施NAA激素可协同内源激素促进不定根的形成和发育,并与清水处理形成差异。
[1] 张宏达.中国植物志:35卷[M].北京: 科学出版社, 1979:66-67.
[2] 陈新法, 付国勇.细柄蕈树优质壮苗培育技术[J].浙江林业科技, 2005, 25(2): 39-40.
[3] 吴文谱.中国的细柄蕈树林[J].植物科学学报, 1990, 8(1): 59-63.
[4] 许晓红, 史亚萍.细柄蕈树全光照扦插繁育技术[J].江西林业科技, 2006 (4): 15-16.
[5] 何贵平, 陈益泰, 骆文坚, 等.几种阔叶树种嫩枝扦插繁殖技术研究[J].林业科学研究, 2004, 17(6): 810-814.
[6] 吴颂如, 陈婉芬, 周 燮.酶联免疫法(ELSA)测定内源植物激素[J].植物生理学通讯, 1988, 3(5): 53-57.
[7] 王金祥, 严小龙, 潘瑞炽.不定根形成与植物激素的关系[J].植物生理学通讯, 2005,41(2): 133-142.
[8] 郭益力, 宫庆华, 王 峰, 等.‘南京红’梅花嫩枝扦插试验[J].江苏林业科技, 2013, 40(2): 26-28+42.
[9] 崔成华, 方 丽, 石晶晶.生长调节剂插前处理对红叶石楠扦插成活率的影响[J].江苏林业科技, 2011, 38(4): 24-27.
[10]王小玲, 赵 忠, 权金娥, 等.外源激素对四倍体刺槐硬枝扦插生根及其关联酶活性的影响[J].西北植物学报, 2011, 31(1): 116-122.
[11]卢 芳, 鲁 丹, 周瑞玲.不同植物生长调节剂对美人梅硬枝扦插生根的影响[J].江苏林业科技, 2010, 37(6):22-25.
[12]张志权, 廖文波, 陈志明, 等.南方红豆杉嫩枝扦插生根性研究[J].林业科学研究, 1999, 12(5): 539-543.
[13]Henrique A, Campinhos E N, Ono E O, et al.Effect of plant growth regulators in the rooting ofPinuscuttings [J].Brazilian Archives of Biology and Technology, 2006, 49(2): 189-196.
[14]季孔庶.杂交鹅掌楸的无性繁殖[J].南京林业大学学报: 自然科学版, 2005, 29(1): 83-87.
[15]张乐华, 王书胜, 单 文, 等.基质、激素种类及其浓度对鹿角杜鹃扦插育苗的影响[J].林业科学, 2014, 50(3): 45-54.
[16]徐继忠, 陈四维.桃硬枝插条内源激素(ABA,IAA)含量变化对生根的影响[J].园艺学报, 1989, 16(4): 275-278.
[17]马振华, 王吉斌, 周贵平, 等.四倍体刺槐嫩枝扦插生根过程中内源激素的变化[J].西北林学院学报, 2013, 28(5): 18-23.
[18]王军辉, 张建国, 张守攻, 等.几种因素对川西云杉扦插繁殖生根的影响[J].南京林业大学学报: 自然科学版, 2007, 31(1): 51-54.
[19]王雪莲, 李宏伟.生长调节剂对雪柳嫩枝扦插效果的影响[J].林业科技, 2001, 26(5): 1-3.
[20]麻文俊, 张守攻, 王军辉, 等.日本落叶松扦插生根期内源激素和营养物质及酚酸含量变化特征[J].西北植物学报, 2013, 33(1): 109-115.
[21]林士杰, 姜 静, 冯 昕, 等.黑林1号杨组培叶片不定根的发生与内、外激素关系的研究[J].林业科技, 2006, 31(1): 8-11.
[22]宋金耀, 何文林, 李松波, 等.毛白杨嵌合体扦插生根相关理化特性分析[J].林业科学, 2001, 37(5): 64-67.
[23]Gaspar T, Kevers C, Hausman J F, et al.Practical uses of peroxidase activity as a predictive marker of rooting performance of micropropagated shoots [J].Agronomie, 1992, 12(10): 757-765.
[24]Nag S, Saha K, Choudhuri M A.Role of auxin and polyamines in adventitious root formation in relation to changes in compounds involved in rooting [J].Journal of Plant Growth Regulation, 2001, 20(2): 182-194.
[25]郭 鑫.杂交鹅掌楸硬枝扦插繁殖技术与生根机理研究[D].南京:南京林业大学, 2011.
[26]潘瑞炽, 董愚得.植物生理学[M].北京: 高等教育出版社, 1995:232-233.
[27]刘关君, 李绪尧.长白落叶松插穗内源激素变化与不定根产生的关系[J].东北林业大学学报, 2000, 28(1): 19-20.
[28]闫绍鹏.欧美山杨杂种扦插生根的理化与分子机理研究[D].哈尔滨:东北林业大学, 2011.
[29]吕 梅, 方炎明, 贾 恒, 等.红桤木扦插生根过程中内源激素的变化[J].林业科技开发, 2009, 23(2): 16-19.
[30]敖 红, 冯玉龙.长白落叶松插穗的内源激素水平及其与扦插生根的关系[J].植物研究, 2002, 22(2): 190-195.
[31]陈雪梅, 高红兵, 王沙生.三种杨树扦插生根期间内源激素水平的比较研究[J].林业科学, 1994, 30(1): 1-7.
[32]程水源, 王 燕.银杏插穗生根与酶及内源激素的关系[J].园艺学报, 1996, 23(4): 407-408.
[33]谢寅峰, 王 莹, 张志敏, 等.青钱柳子叶不定根的发生机制[J].林业科学, 2009, 45(12): 72-76.
Theendogenoushormones’variationduringtheadventitiousrootformationofAltingiagracilipescuttings
FAN Jun-jun, ZHANG Wang-xiang*, CAI Xi-yan, ZHAO Ming-ming, WEI Hong-liang
(College of Forestry,Nanjing Forestry University,Nanjing 210037,China)
To reveal the rooting mechanism ofAltingiagracilipes, endogenous hormone dynamics in the 3-year-old softwood cuttings during the adventitious root formation was studied by ELISA.The result showed that rooting cycle of the cuttings treated with 300 mg/LNAA was clearly shortened compared with that of CK.The change trend of the endogenous hormones (IAA, ZT and ABA) by NAA treatment was parallel to that of CK, which was featured with “V-shape”.Meanwhile, indications of synergetic effects were observed between endogenous and exogenous hormones.During the adventitious root formation, the valley in the curves of IAA/ZT, IAA/GA3and IAA/ABA with the NAA treatment and CK appeared on the 20thand 30threspectively, presenting synergetic effect along with root formation.
Altingiagracilipes; Cutting; Endogenous hormone
1001-7380(2014)04-0011-04
2014-05-20;
2014-05-23
江苏省农业科技自主创新项目:"枫香亚科耐寒常绿阔叶行道树新品种选育"CX(11)1040
范俊俊(1990- ),女,硕士生,研究方向:观赏植物栽培。
*通信作者:张往祥(1965- ),男,副教授,主要从事观赏园艺研究,E-mail: malus2011@163.com。
Q949.751.4
A
10.3969/j.issn.1001-7380.2014.04.003

