大肠癌及大肠息肉中端粒酶、PTEN的表达及意义
段晓燕 冷雪芹 陈平 苏秉忠 孙涓 牛丽丽 胡香珍 常鸿菲
近年来我国结直肠癌发病和死亡率均呈上升趋势[1],发病率和病死率均高于世界平均水平[2]。肠息肉的发病率随年龄增加而上升,约有30%的人在一生中会有肠息肉形成。二者发病的病因尚不十分清楚,其发生、发展过程中细胞凋亡基因和抑癌基因异常表达是目前研究的热点。端粒酶(telomerase)使细胞具有无限增殖的能力,具有抑制细胞凋亡的作用。人端粒酶逆转录酶(human telomerase reversetranscriptase,hTERT)作为端粒酶的主要限速成份,其表达的强度与端粒酶活性一致,因此,hTERT的表达可以作为衡量端粒酶活性的指标[3]。PTEN是在1997年被发现的新的抑癌基因,它是第10号染色体缺失的磷酸酶和张力蛋白的同源基因[4]。研究显示,PTEN在人类肿瘤的发生与发展中扮演着极其重要的角色[5]。本实验通过免疫组织化学法(SP法)检测端粒酶、PTEN在结直肠癌、癌旁组织、结直肠息肉、息肉旁正常组织中的表达,并探讨端粒酶、PTEN在大肠癌及大肠息肉发生过程中的作用及两者之间的关系,进一步研究端粒酶及PTEN与肿瘤进展和预后的关系。
材料与方法
一、一般资料
收集内蒙古医科大学附属医院消化内科及普通外科2012年10月至20l3年10月门诊及住院患者83例,其中68例大肠息肉、25例息肉旁正常组织、15例结直肠癌灶组织(其中10例患者有淋巴结转移,5例患者无淋巴结转移)、9例癌旁组织。又根据Morson结直肠息肉分类方法分类,炎性息肉17例,增生性息肉16例,腺瘤35例,其中管状腺瘤12例,绒毛状腺瘤11例,混合型腺瘤l2例。临床资料分类:单发25例,多发(≥2个)43例;直径≤0.5cm的35例,直径在0.5~1cm之间的有18例,直径≥1cm的15例;根据息肉部位,升结肠5例,横结肠15例,降结肠13例,乙状结肠24例,直肠11例。对照组正常大肠黏膜标本取自息肉旁正常组织并HE染色病理证实为正常大肠黏膜,共25例。我们排除了家族遗传性大肠癌疾病的患者、错构瘤性息肉(常染色体显性遗传性疾病)患者、最近6个月内服用活血药物的患者。我们也排除了虽经病理证实为大肠息肉但同时检出患有大肠癌的患者。以上所有诊断均经病理检查证实。
二、试剂与方法
采用免疫组织化学S-P法,即链霉素抗生物素蛋白-过氧化物酶法检测大肠癌、大肠息肉组织中端粒酶和PTEN的表达。实验步骤按说明书进行。(抗原修复均采用微波修复),即用型PTEN兔抗人多克隆抗体、即用型端粒酶兔抗人多克隆抗体均购于北京博奥森有限公司。即用型S-P免疫组化染色试剂盒、浓缩型DAB显色试剂盒均购于福建迈新有限公司。采用PBS液代替一抗作为阴性对照,采用已知的阳性片作为阳性对照。
三、结果判定方法
端粒酶阳性表达主要定位于胞核或胞质,PTEN阳性表达主要定位于细胞的细胞浆或细胞膜中,阳性结果呈黄色、棕黄色或者褐色的细小颗粒。我们在10×40倍视野下观察切片,随机选取合适的10个视野,计算出视野中的阳性细胞数。按阳性细胞所占视野细胞的百分比分级:视野中无阳性细胞为阴性(-):视野中阳性细胞数少于20%为弱阳性(+);阳性细胞数20%~50%为中度阳性(++);阳性细胞数在50%以上记为强阳性(+++);一个加号以上为阳性结果。
四、统计学方法
采用SPSS13.0统计学软件进行统计分析,用χ2检验、Fisher确切概率法和Spearman相关系数分析。相关性用相关系数r表示。以P<0.05为差异有统计学意义。
结 果
一、大肠癌及大肠息肉中端粒酶和PTEN的表达结果
端粒酶在大肠癌组织中的阳性率(80.00%)显著高于癌旁组织(22.22%)、大肠息肉组织(19.12%)和正常大肠黏膜组织(0.00%)。在息肉的不同类型中,腺瘤中端粒酶的表达(34.29%)显著高于增生性息肉(0.00%)及炎性息肉(5.88%)。端粒酶在腺瘤中的阳性表达率为:绒毛状腺瘤72.73%、混合型腺瘤16.67%、管状腺瘤16.67%。以上差异均有统计学意义(P<0.05)。
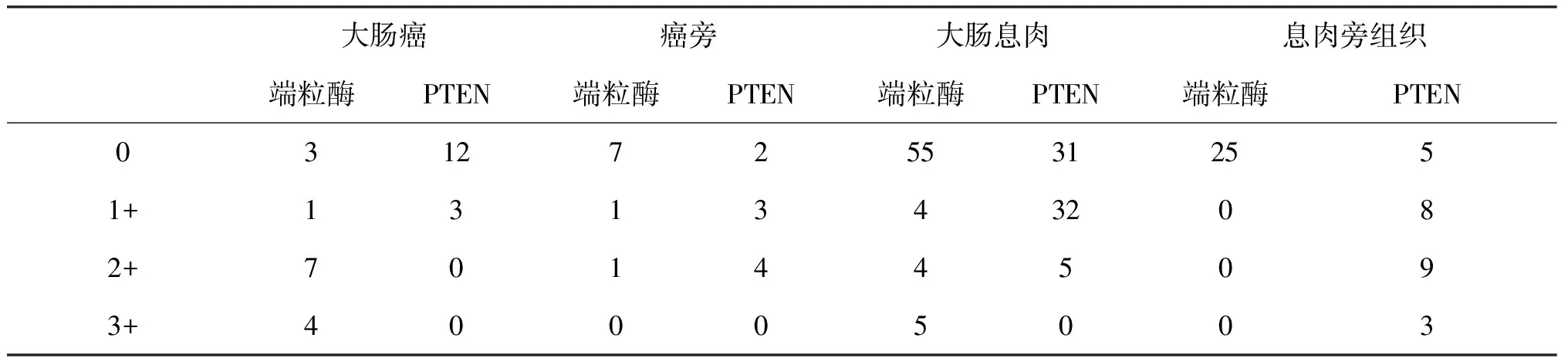
表1 端粒酶和PTEN在大肠癌、大肠息肉中的表达情况表

注:a图为息肉旁组织PTEN表达免疫组织化学S-P法染色图像(400ד+++”);b图为息肉旁组织端粒酶表达免疫组织化学S-P法染色图像(400ד-”);c图为大肠癌中PTEN表达免疫组织化学S-P法染色图像(400ד-”);d图为大肠癌中端粒酶表达免疫组织化学S-P法染色图像(400ד+++”);e图为绒毛状腺瘤PTEN表达免疫组织化学S-P法染色图像(400ד-”);f图为绒毛状腺瘤端粒酶表达免疫组织化学S-P法染色图像(400ד+++”);g图为管状腺瘤PTEN表达免疫组织化学S-P法染色图像(400ד-”);h图为管状腺瘤端粒酶表达免疫组织化学S-P法染色图像(400ד++”);i图为PTEN在增生性息肉中表达免疫组织化学S-P法染色图像(400ד+”);j图为端粒酶在增生性息肉表达免疫组织化学S-P法染色图像(400ד++”);k图为PTEN在炎性息肉中表达免疫组织化学S-P法染色图像(400ד+++”);l图为端粒酶在炎性息肉中表达免疫组织化学S-P法染色图像(400ד++”)
PTEN在大肠癌组织中的阳性率(20.00%)显著低于癌旁组织(77.78%)、大肠息肉组织(54.41%)和正常大肠黏膜组织(80.00%)。两两比较中,大肠癌组织与癌旁组织间,大肠癌与大肠息肉组织间,息肉组织与息肉旁组织间,大肠癌与息肉旁正常组织间差异均有统计学意义(P<0.05),在结直肠息肉旁组织与结直肠癌旁组织间的差异没有统计学意义(P>0.05,表1)(图1)。
二、不同病理类型息肉组织中的表达情况
1.端粒酶的表达:端粒酶在腺瘤性息肉中的表达率为34.29%(12/35)明显高于增生性息肉0%(0/16)及炎性息肉5.88%(1/17)。三者之间比较差异有统计学意义(P<0.05),两两比较增生性息肉、腺瘤间,炎性息肉、腺瘤间差异有统计学意义(P<0.05)。增生性息肉、炎性息肉间差异无统计学意义(P>0.05,表2)。
2.PTEN的表达:PTEN在腺瘤性息肉为40.00%(14/35)显著低于增生性息肉62.50%(10/16)及炎性息肉76.47(13/17),三者之间差异有统计学意义(P<0.05),在两两比较中炎性息肉和腺瘤间有显著差异(P<0.05)。增生性息肉、腺瘤间,增生性息肉和炎性息肉间差异无统计学意义(P>0.05,表2)。
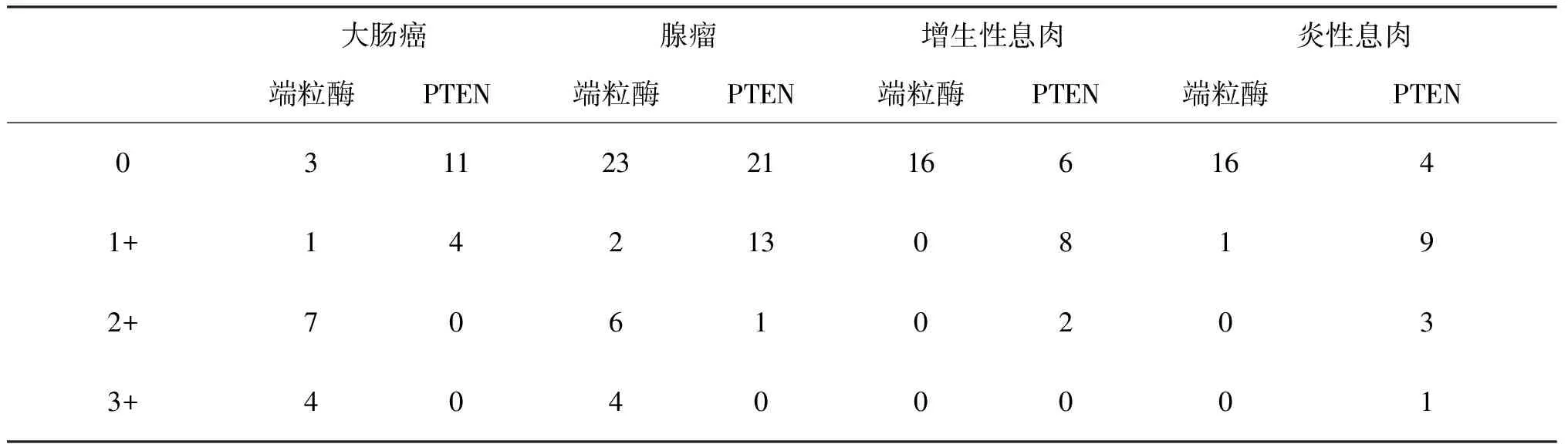
表2 端粒酶和PTEN在不同病理类型息肉中的表达情况表

表3 端粒酶和PTEN在不同病理类型腺瘤的表达情况表
三、不同病理类型的腺瘤中端粒酶和PTEN的表达情况
1.端粒酶的表达:端粒酶在绒毛状腺瘤中的阳性率为72.73%、混合型腺瘤16.67%、管状腺瘤16.67%。三者之间有差异(P<0.05)。绒毛状腺瘤和管状腺瘤间,绒毛状腺瘤与混合性腺瘤间差异均有统计学意义(P<0.05)。混合性腺瘤与管状腺瘤间差异无统计学意义(P>0.05,表3)
2.PTEN的表达:PTEN在绒毛状腺瘤中阳性表达率为9.09%(1/11),在混合型腺瘤中的阳性表达率为50%(6/12),在管状腺瘤中的阳性表达率为58.33%(7/12)。三者之间有差异有统计学意义(P<0.05,表3)。
四、大肠癌、大肠息肉中端粒酶与PTEN表达的相关性
在大肠癌组织中,端粒酶与PTEN成负相关关系,Spearman相关系数:r=-0.516,P<0.05。在大肠息肉组织中,端粒酶与PTEN成负相关关系,Spearman相关系数:r=-0.261,P<0.05。
五、大肠癌和息肉相关因素与端粒酶、PTEN表达的关系
端粒酶和PTEN的表达与大肠癌有无淋巴结转移关系密切(r=0.560,P<0.05;r=-0.707,P<0.05,表4)。端粒酶与息肉大小(r=0.262,P<0.05)关系密切,与息肉发生的部位及数量没有明显相关性(P>0.05),PTEN表达与息肉大小、部位、息肉数量没有相关性(表5)。

表4 端粒酶、PTEN与大肠癌有无淋巴结转移关系情况表
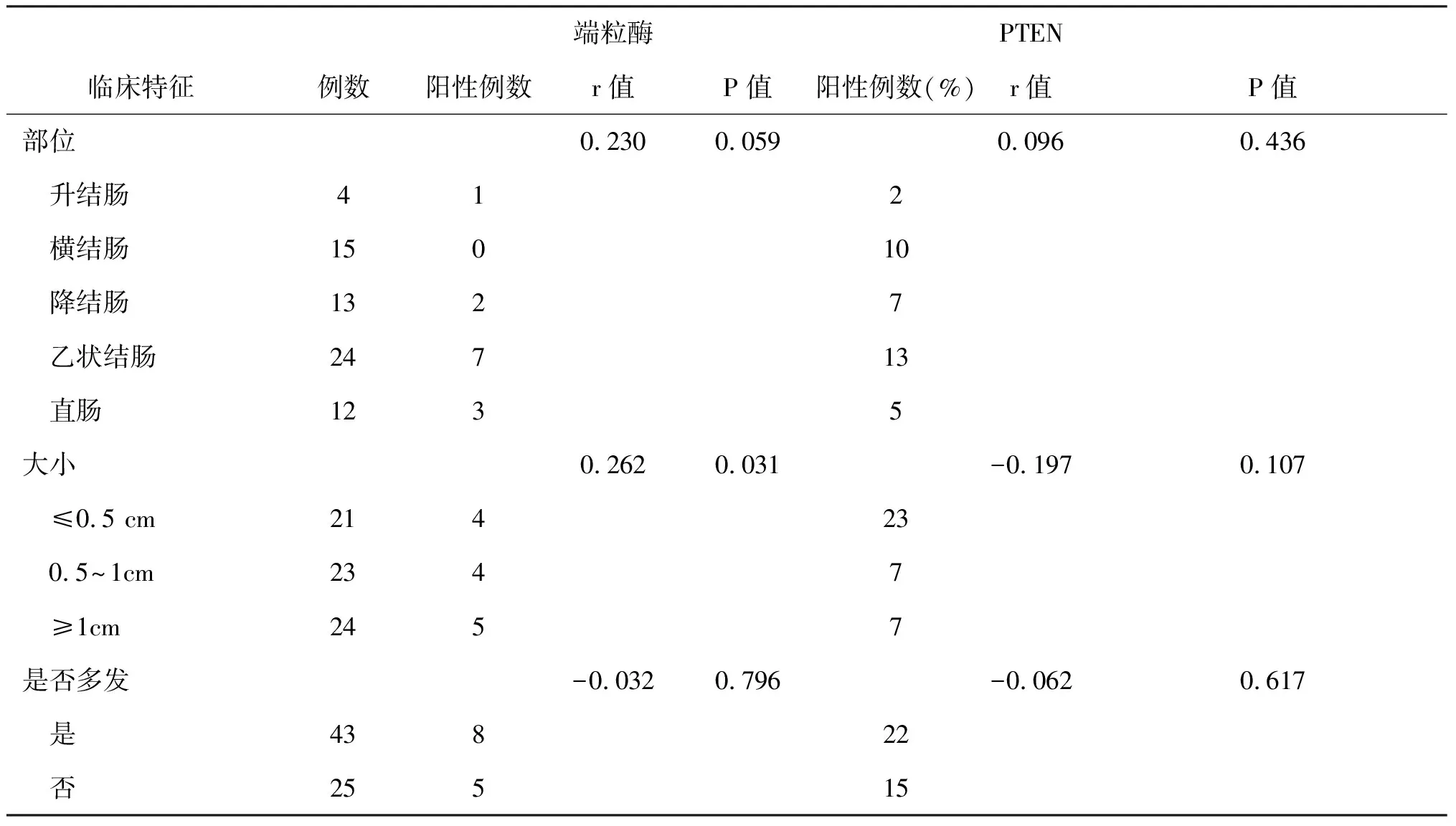
表5 不同部位的息肉及大小、是否多发与端粒酶、PTEN表达关系情况表
讨 论
研究发现,正常体细胞中几乎检测不到端粒酶活性,而多数肿瘤细胞中端粒酶活性异常升高[6],有研究发现,15%以上的癌前病变中也可以检测到端粒酶活性[7]。PTEN基因在人类肿瘤的产生、发展中起重要作用,有望成为新的基因治疗靶点。它在肿瘤发生发展中的作用机制有:(1)负性调控PI3K/AKT信号通路[8]。PI3K/AKT信号通路的激活可负性调控细胞增殖和分化[9]。(2)对细胞周期的抑制作用。(3)PTEN具有抑制FAK/P130C和MAPK信号通路的作用。(4)PTEN抑制新生血管生成,增强其抑癌作用[10]。
本实验结果表明,PTEN在大肠癌组织中的表达显著低于癌旁组织、大肠息肉组织和息肉旁组织,可能说明PTEN与大肠息肉的发生发展有着密切的关系。PTEN在腺瘤性息肉中的表达显著低于增生性息肉及炎性息肉,可能提示PTEN的缺失在息肉异型增生至息肉癌变过程起重要作用。PTEN在绒毛状腺瘤中的表达显著低于混合型腺瘤及管状腺瘤。PTEN随腺瘤中绒毛含量的增多而表现出逐渐缺失的趋势,与目前所认为的腺瘤绒毛含量越多越容易恶变的观点相符合。综上所述,端粒酶在大肠癌、大肠息肉中的表达较息肉旁组织明显增高,且与息肉的不同类型有关系,提示端粒酶可能在大肠癌前病变至大肠癌的进展过程中起作用。本实验发现端粒酶的表达与大肠癌淋巴结转移呈正相关关系,提示端粒酶可以做为肿瘤进展程度的术前评估指标。
目前有些学者对肿瘤细胞中端粒酶和PTEN表达的相关性做了研究[11-12],研究两种因子在肿瘤产生、发展及复发、转移、预后的作用,为患者在治疗方案上的选择及预后判断提供参考。研究发现,转染野生型PTEN基因也能够抑制肿瘤细胞端粒酶活性[13]。考虑到肿瘤侵袭特性与端粒酶活性有密切关系,而PTEN抑癌基因具有抗侵袭作用,PTEN基因是否有抑制肿瘤增殖和端粒酶活性作用呢?有实验结果表明,外源性PTEN抑癌基因导入高转移性黏液表皮样癌细胞能够诱导癌细胞增殖抑制,并且导致端粒酶活性显著下降[14]。文献报道PTEN抑癌基因抑制端粒酶活性的机制可能是通过抑制PKB活化,下调端粒酶关键组分hTERT mRNA水平,进而导致端粒酶活性降低[15]。由此可见,端粒酶和PTEN的表达存在着相互制约和影响的关系,PTEN表达减低或缺失致使端粒酶表达增高;反过来,端粒酶的表达增高时在某种程度上也影响了PTEN的表达。
在我们的实验中发现,PTEN在大肠癌中的表达缺失,在腺瘤性息肉表现出缺失倾向,并随着腺瘤病理类型的不同而有差别。端粒酶和PTEN在大肠息肉的表达可能存在一定的相关性。联合检测对大肠癌、癌前病变的诊断、治疗及预后有重要意义。目前研究已证实端粒酶抑制剂可与肿瘤的放、化疗协同,增加其治疗的敏感性[16-18]。也可将端粒酶的核心成员hTERT作为靶点,进行肿瘤免疫治疗研究[19]。如诱导hTERT特异性T淋巴细胞免疫反应,尤其是细胞毒性T淋巴细胞(cytotoxic T lymphocyte,CTL)效应,特异性清除hTERT阳性的肿瘤细[20]。相信不久的将来抑制端粒酶药物及PTEN基因的替代疗法会应用于临床,用于大肠息肉、大肠癌的预防和治疗。
[1] 陈琼,刘志才,程兰平,等.2003~2007年中国结直肠癌发病与死亡分析.中国肿瘤,2012,21(3):179-182.
[2] Ferlay J,Shin HR,Bray F,et al.Estimates of worldwide burden of cancer in 2008:GLOBOCAN 2008.Int J Cancer,2010,127(12):2893-2917.
[3] Shay JW,Wright W E.Role of telomeres and telomerase in cancer.Semin Cancer Biol,2011,21(6):349-353.
[4] Xuehua Zhu,Xia Qin,MaoguiFei,et al.Combined Phosphatase and Tensin Homolog(PTEN)Loss and Fatty Acid Synthase(FAS)Overexpression Worsens the Prognosis of Chinese Patients with Hepatocellular Carcinoma.Int J MolSci,2012,13:9980-9991.
[5] Hollander MC,Blumenthal GM,Dennis PA.PTEN loss in the continuum of common cancers,rare syndromes and mouse models.Nat Rev Cancer,2011,11(4):289-301.
[6] Cifuentes-Rojas C,Shippen DE.Telomerase regulation.MutatRes,2012,730(1-2):20-27.
[7] Meeker AK,DeMarzo AM.Recent advances in telomere biology:implications for human cancer.CurrOpinOnco,2004,16(1):32-38.
[8] Roy S,Yu Y,Padhye SB,etal.Difluorinated-curcumin(CDF)restores PTEN expression in colon cancer cells by down-regulating miR-21.See comment in PubMed Commons below.PLoS One,2013,8(7):68543.
[9] Song MS,Salmena L,Pandolfi PP.The functions and regulation of the PTEN tumour suppressor.Nat Rev Mol Cell Biol,2012,13(5):283-296.
[10] Kamaljeet Singh,Rochelle A Simon,Cunxian Zhang,etal.“Surface epithelial changes”in uterine endometrioid carcinoma mimicking micropapillary serous borderline tumor of ovary:report of two cases and review of the literature.Diagnostic Pathology,2011,6:13.
[11] Furnari FB,Huang SH,CaveneeWK.Thephosphoinsitol phosphatase activity of PTEN mediates a serum-sensitive G1growth arrest in gliomdcells.Cancer Res,1998,58(22):5002-5008.
[12] 尤永平,傅震,赵鹏,等.反义hTERT/PTEN联合基因治疗恶性胶质瘤的体内外研究.中华医学遗传学杂志,2006,12(23):605-609.
[13] Zhou C,Bae-Jump VL,Whang YE,et al.The PTEN tumor suppressor inhibits telomerase activity in endometrial cancer cells by decreasing hTERT mRNA levels.GynecolOncol,2006,101(2):305-310.
[14] 刘斌,吴军正,关素敏,等.PTEN基因联合多西环素抑制黏液表皮样癌细胞系端粒酶活性的研究.华西口腔医学杂志,2010,28(5):532-534.
[15] Kokubo Y,Gemma A,Noro R,et al.Reduction of PTEN protein and loss of epidermal growth factor receptor gene mutation in lung cancer with natural resistance to gefitinib(IRESSA).Br J Cancer,2005,92(9):1711-1719.
[16] 董俊红,王振明,付新华,等.RNAi沉默survivin表达对A549细胞凋亡及紫杉醇敏感性的影响.肿瘤防治研究,2010,37(3):266-269.
[17] Alli E,Yang JM,Ford JM,et al.Reversal of Stathmin-Mediated resistance to paclitaxel and vinblastine in human breast carcinoma cells.MolPharmacol,2007,71(5):1233-1240.
[18] Tan J,Zhou X,Zhu H.hTERT-siRNA Could Potentiate the Cyto-toxic Effect of Gemcitabine to Pancreatic Cancer Cells Bxpc-3.ExpClin Transplant,2012,10(4):386-393.
[19] Tajima K,Ito Y,Demachi A,et al.Interferon-gamma differentially regulates susceptibility of lung cancer cells to telomerase specific cytotoxic T lymphocytes.Int J Cancer,2004,110(3):403-412.
[20] Pesonen S,Diaconu I,Kangasniemi L,et al.Oncolytic immunotherapy of advanced solid tumors with a CD40L-expressing replicating adenovirus:assessment of safety and immunologic responses in patients.Cancer Res,2012,72(7):1621-1631.

