3种百合组培快繁体系的优化
崔祺,贾桂霞,2,3*
(1.北京林业大学园林学院,北京 100083;2.国家花卉工程技术研究中心,北京 100083;3.花卉种质创新与分子育种北京市重点实验室,北京 100083)
3种百合组培快繁体系的优化
崔祺1,贾桂霞1,2,3*
(1.北京林业大学园林学院,北京 100083;2.国家花卉工程技术研究中心,北京 100083;3.花卉种质创新与分子育种北京市重点实验室,北京 100083)
为优化百合组培快繁体系,以东方百合‘索邦’、野生淡黄花百合及新铁炮百合‘雷山3号’为研究对象,采用组织培养技术,研究不同外植体诱导分化、组培苗继代增殖和鳞茎增大的最佳培养条件。结果表明:淡黄花百合种子萌发的适宜培养基为MS+0.01 mg/L NAA+60 g/L蔗糖;适宜‘索邦’、‘雷山3号’鳞片诱导不定芽的适宜培养基分别为MS+2.0 mg/L 6–BA + 0.3 mg/L NAA和MS+0.5 mg/L 6–BA + 0.2 mg/L NAA;适宜这3种百合组培苗增殖培养的培养基为MS+2.0 mg/L 6–BA+0.2 mg/L NAA;适宜‘索邦’无菌苗鳞茎增大的培养基为3MS+0.5 g/L AC+3.0 mg/L PP333+80 g/L蔗糖。
百合;再生体系;组织培养;快速繁殖
1 材料与方法
1.1 材 料
供试材料为淡黄花百合(L. sulphureum Baker)的成熟果实和新铁炮百合‘雷山3号’( L. formolongi ‘Raizan 3’)及东方百合‘索邦’(L. Oriental ‘Sorbonne’)的种球。
试验所用基本培养基均为MS培养基,其中含6.5 g/L 琼脂粉和30 g/L蔗糖,并附加了不同质量浓度的植物生长调节剂6–BA、NAA。培养基的pH值为5.85。培养基在121 ℃高温下灭菌20 min。培养条件:温度25 ℃,光照强度2 000 lx,每天光照时间12 h,相对空气湿度70%~80%。
1.2 方 法
1.2.1 3种百合种子和鳞片的诱导培养
以颗粒饱满的种子和干净无病虫害的鳞片为外植体。将外植体用洗洁剂浸泡10 min,在流水下用轻柔毛刷刷洗。在超净台中,将种子、鳞片放入75%的乙醇中浸泡1 min后,用质量分数25%的次氯酸钠分别处理15、25 min,之后用无菌水清洗。淡黄花百合种子接入添加不同质量浓度(30、60、90 g/L)蔗糖和不同质量浓度(0.001、0.010、0.100 mg/L) NAA的MS培养基中;新铁炮百合‘雷山3号’、‘索邦’鳞片接种到含不同质量浓度(0.1、0.2、0.5 mg/L)NAA和不同质量浓度(0.5、1.0、2.0 mg/L)6–BA 的MS培养基中,其中蔗糖质量浓度为30 g/L。每处理接30个外植体,3次重复,分别在接入30、40 d 后统计不同处理下鳞片的不定芽诱导率和种子的萌发率。
不定芽诱导率=产生不定芽的外植体数/未发生污染的外植体总数。
平均出芽数=分化的不定芽总数/未污染的鳞片总个数。
萌发率=萌发出苗的种子数/未发生污染的试验种子总数。
1.2.2 3种百合继代增殖培养基的筛选
将淡黄花百合、新铁炮百合‘雷山3号’和‘索邦’的组培幼苗分别接种到添加不同质量浓度(0.1、0.2、0.5 mg/L)NAA和不同质量浓度(0.5、1.0、2.0 mg/L) 6–BA的MS培养基中进行增殖培养。每处理接种30株无菌苗,3次重复,接入50 d后统计不同生长调节剂质量浓度处理下组培苗的增殖系数与生长情况。增殖系数=培养后组培苗总数/初始组培苗数。
1.2.3 ‘索邦’组培苗鳞茎的增大培养
为提高百合组培苗的鳞茎质量,促进鳞茎膨大,缩短种球的繁育时间,本试验中以‘索邦’为例,在前人研究的基础上,探讨高质量浓度蔗糖条件下影响鳞茎膨大的3个主要因素,以期筛选出协同蔗糖高效增加鳞茎鲜重的组合。选取小鳞茎大小相近、整齐一致的组培苗,将MS培养基中大量元素的含量增加1倍、增加2倍(分别记为2MS、3MS),配合不同质量浓度的活性炭(AC)和多效唑(PP333)进行正交试验(表1),将组培苗切去叶片和根,称量小鳞茎,再将小鳞茎接入到不同处理的MS培养基中(所有处理蔗糖含量均为80 g/L)。每处理接30个小鳞茎,3次重复。接入60 d后切去叶片和根,称量每个鳞茎的鲜重(取平均值),统计不同处理下小鳞茎的增大倍数与生长情况。鳞茎增大倍数=培养后鳞茎鲜重/初始鳞茎鲜重。
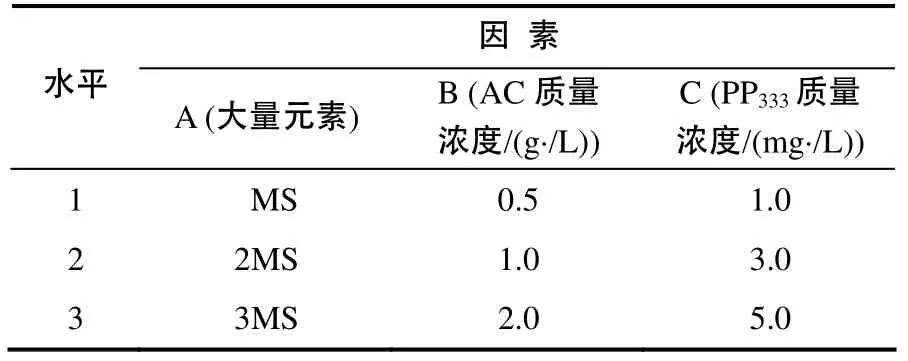
表1 组培苗鳞茎增大培养正交试验的因素和水平Table 1 Factors and levels of orthogonal design on the culture of plantlets bulblets enlargement
1.3 数据处理
采用Microsoft Excel 2010和IBM SPSS 19对数据进行方差分析和因素内多重比较。
2 结果与分析
2.1 不同配比蔗糖和NAA对淡黄花百合种子萌发的影响
由图1和表2可见,大部分种子都能萌发,且在不同培养基条件下存在萌发快慢和生长势的差别;幼苗鳞茎大多高度分化,在母体鳞茎长出2~4个子鳞茎,经过60 d左右的培养后子鳞茎与母体鳞茎大小差不多;蔗糖(F0.01=6.01<9.104**)和NAA(F0.01= 6.01<17.862**)对种子萌发率的影响极显著;蔗糖和NAA质量浓度分别为60、0.01 mg/L时种子萌发率最高,所以,认为淡黄花百合种子萌发的适宜培养基配方为MS+0.01 mg/L NAA+60 g/L蔗糖。

图1 不同生长阶段淡黄花百合种子的离体再生培养结果Fig.1 L. sulphureum seeds regeneration in vitro in different growth stage
由图1和表2可见,培养60 d后,有少量种子没有萌发,在更换新培养基的同时采取剥皮的处理,发现剥皮后萌发迅速而整齐,剥皮20 d后几乎100%能萌发,而未进行剥皮处理的只有少量萌发,由此可见,种子的外种皮也是影响其萌发快慢的主要因素。

表2 不同配比蔗糖和NAA处理淡黄花百合种子40 d后的萌发率Table 2 Germination rate of L.sulphureum Baker in the mediums with different 6–BA and sugar concentrations after 40 days inoculation
2.2 不同配比NAA和6–BA对新铁炮百合‘雷山3
号’与‘索邦’鳞片诱导分化不定芽的影响
百合的鳞片分化以2种方式进行:一是先形成愈伤组织,然后从愈伤组织上产生不定芽;二是不经愈伤直接产生不定芽。图2结果表明,试验中只有少量鳞片产生了愈伤组织,且几天后愈伤组织便分化出芽点;大部分鳞片则表现为直接产生不定芽或小鳞茎。

图2 新铁炮百合‘雷山3号’和东方百合‘索邦’鳞片的离体再生培养结果Fig.2 Lilium × formolongi ‘Raizan 3’ and L.oriental hybrid ‘Sorbonne’ bulblet-scale regeneration in vitro
雷山3号’与‘索邦’在分化方面具有显著差异,‘雷山3号’较‘索邦’分化快,每块鳞片的平均出芽数多,不定芽长势快,且多是以丛生芽的形式快速生长;‘索邦’在大部分培养基中都是以单芽的形式直接生长成小鳞茎。随着6–BA质量浓度的增加,不定芽诱导率以及每块鳞片的平均出芽数逐渐增加(表3)。经比较,‘雷山3号’在MS+0.5 mg/L 6–BA+0.2 mg/L NAA上培养鳞片的不定芽诱导率最高,可达(83.55±5.45)%,且平均每块鳞片出芽数较多,为6.19±0.60;‘索邦’在培养基MS+2.0 mg/L 6–BA + 0.3 mg/L NAA上鳞片的不定芽诱导率和平均每块鳞片的出芽数最高,分别为(65.96±5.84)%和4.53±0.89。
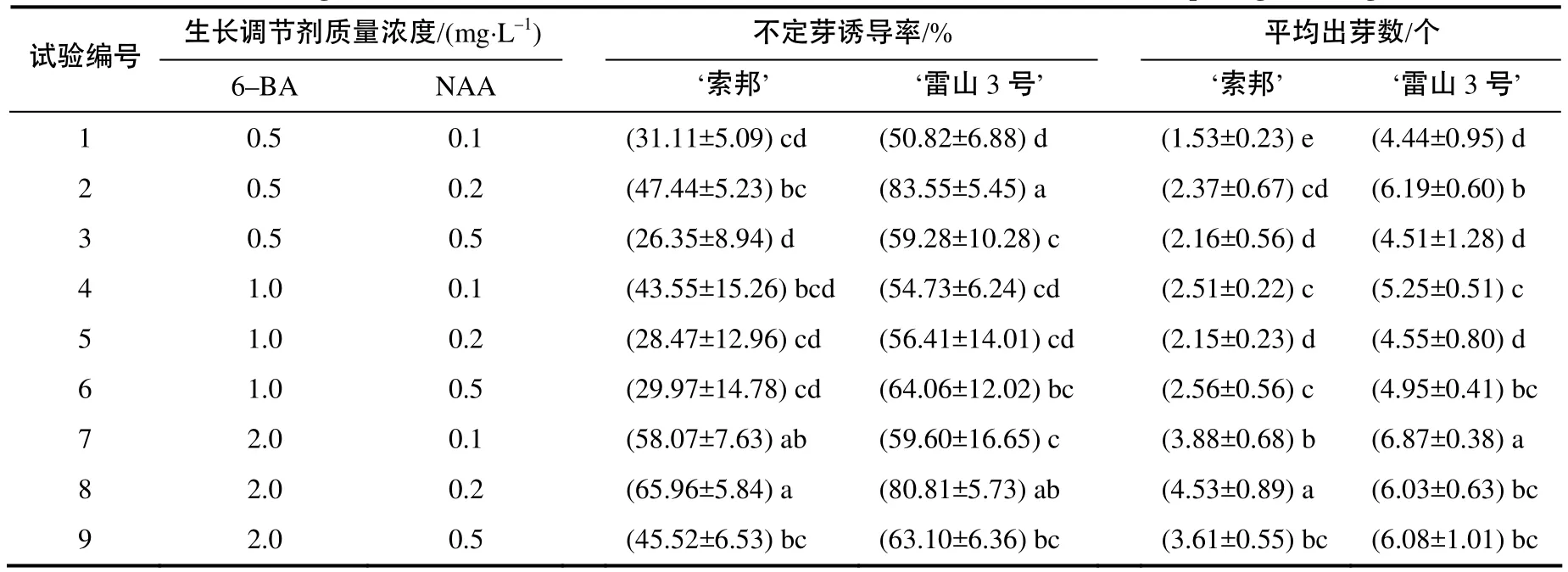
表3 不同配比生长调节剂处理百合鳞片的不定芽诱导率和出芽数Table 3 Shoot regeneration rate of bulb scales in the mediums with different concentration of plant growth regulators
2.3 不同配比NAA和6–BA对3种百合继代增殖培养的影响
由表4可见,在淡黄花百合继代增殖过程中,6–BA(F0.05=3.55<5.659)和NAA (F0.05=3.55<4.592)对增殖系数的影响显著,不同配比6–BA和NAA处理间存在明显差异;对淡黄花百合组培苗而言,6–BA 和NAA的质量浓度分别为2.0、0.2 mg/L时的增殖效果较好。在‘雷山3号’和‘索邦’的继代增殖过程中,NAA (F0.05=3.55>0.842,0.105)对增殖系数的影响均没有统计学意义,而6–BA(F0.05=3.55< 26.148,12.925)对增殖系数的影响显著,不同质量浓度6–BA处理间存在显著差异,2.0 mg/L 6–BA对‘雷山3号’和‘索邦’组培苗的增殖效果较好,因此,认为淡黄花继代增殖的适宜培养基为MS+2.0 mg/L 6–BA+0.2 mg/L NAA,新铁炮‘雷山3号’与‘索邦’继代增殖的适宜培养基分别为MS+2.0 mg/L 6–BA+ (0.1~0.5) mg/L NAA,由此筛选出MS+2.0 mg/L 6–BA+0.2 mg/L NAA为3种百合继代增殖的适宜培养基。
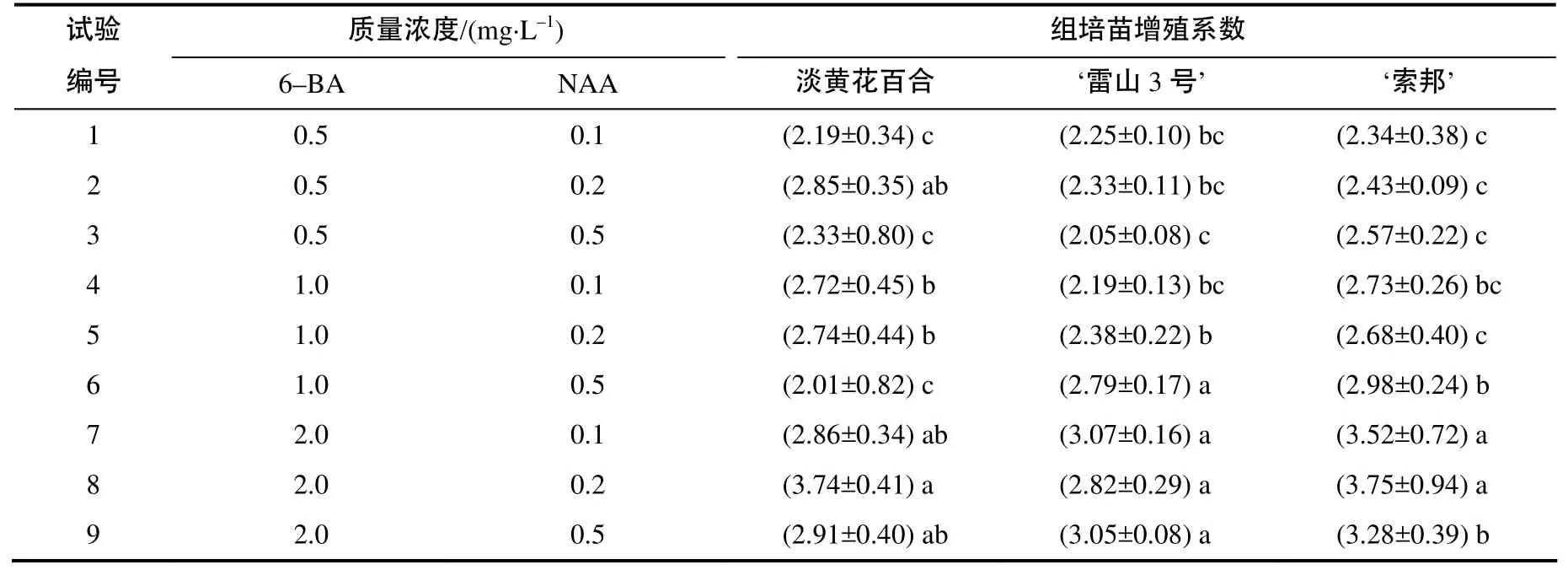
表4 不同配比生长调节剂处理百合40 d后的组培苗增殖系数Table 4 Magnification factor of plantlets proliferation in the mediums with different combinations of plant growth regulators after 40 days cultivation
2.4 ‘索邦’组培苗鳞茎增大培养基的优化
试验结果表明,‘索邦’组培苗接入9种不同处理的培养基后,大部分生长状态良好,叶片较少,鳞茎较绿,根系多而粗壮,但也出现少量鳞茎生长畸形的情况,这可能是由于培养基内渗透压过高引起的。培养50 d后(图2)鳞茎膨大倍数(表5)的极差分析结果表明:各因素对鳞茎增大的影响效应由大到小排列依次为PP333、AC、大量元素,经正交试验筛选出的最优生长调节剂组合为A3B1C2,PP333对鳞茎增大的影响极显著(F0.01=6.01<8.656**),AC (F0.05=3.55> 0.697)和大量元素(F0.05=3.55>0.864)的影响无统计学差异,不同质量浓度PP333处理间存在显著性差异,PP333质量浓度为3.0 mg/L 时鳞茎增大倍数最高,因此,3MS+0.5 g/L AC+3.0 mg/L PP333+80 g/L蔗糖为‘索邦’无菌苗鳞茎增大的适宜培养基。
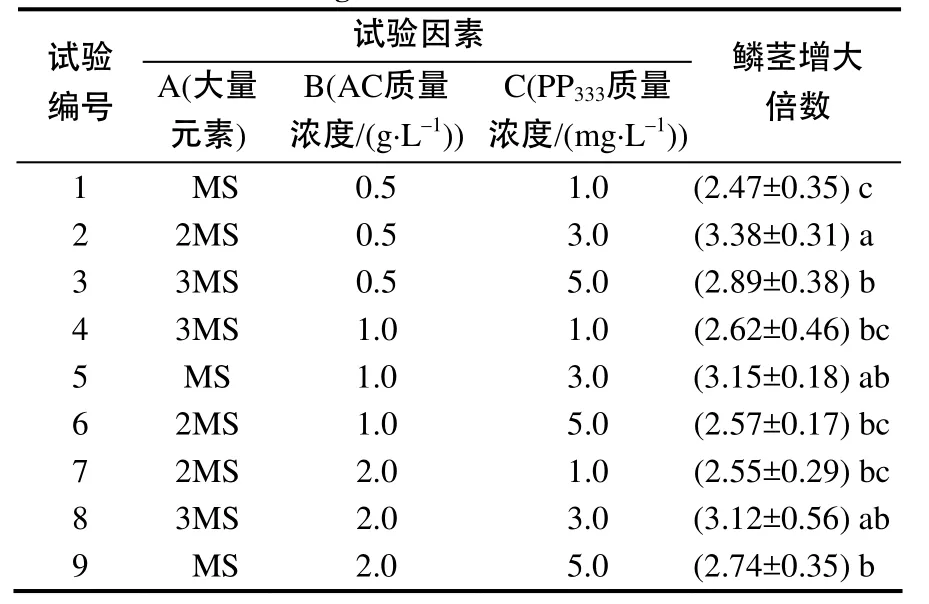
表5 组培苗鳞茎增大培养的正交试验结果Table 5 Results of orthogonal design on the culture of plantlets bulblets enlargement
3 结论与讨论
在淡黄花百合种子萌发试验中,有少量的组培苗出现胚根向上和叶片贴着培养基生长的现象。生长素的极性运输及其造成的生长素侧向质量浓度梯度是向地性所必需的[11]。本试验中发现淡黄花百合组培苗的胚根向上而子叶向下生长,与向地性完全相反,这种负向地性生长的现象可能是受生长调节剂影响的结果,有待于进一步研究。另外,培养基中的糖含量是百合幼胚在离体条件下正常生长的关键因子[12]。淡黄花百合种子在高浓度蔗糖和低浓度NAA条件下的萌发率较高,鳞茎生长壮实,能迅速成苗,且母体鳞茎周围新生出较多的子鳞茎。值得一提的是,在种子萌发生长过程中,约有5%的幼苗根系肥大粗壮,周围出现质地坚硬的黄绿色颗粒状愈伤组织(有研究者将其定义为“瘤状根”[13]),这可能是由于培养基中生长素作用的结果。根系周围的愈伤组织有可能导致输导组织不畅,影响组培苗生长和移栽成活率,必须及时切除。
植物生长调节剂种类和浓度是影响组织培养中细胞分化与形态建成的关键因子,合适的生长调节剂配比可使不定芽分化大大加快,在短期内可繁殖出大量组培苗。王刚等[14]的研究表明,6–BA与NAA的浓度比介于5∶1到10∶1之间时不定芽诱导率较高。本研究中低质量浓度的NAA和高质量浓度的6–BA配合使用可以快速诱导鳞片产生不定芽,且平均每块鳞片的不定芽数较多。本试验中3种不同基因型的百合采用相同的培养基配方进行扩繁,均可获得较高的增殖系数,但筛选出的继代培养的培养基配方是否适宜多种百合,还需进一步验证。
影响百合鳞茎形成和膨大的因素是多方面的,如生长调节剂的种类和浓度以及蔗糖、大量元素、活性炭(AC)、水杨酸、光照、温度等[15–16],其中,高浓度蔗糖是促进鳞茎膨大的决定性因素。本研究中在培养基中加入高浓度的蔗糖后,又设置了不同浓度的大量元素、活性炭和多效唑,试图探索出能够协同蔗糖高效增加鳞茎鲜重的组合。加倍的大量元素可以为鳞茎生长提供充足的营养物质,活性炭(AC)可以吸附离体培养中的抑制生长物,并且给鳞茎生长创造暗环境,有利于鳞茎膨大;多效唑(PP333)是一种生长延缓调节剂,可使植株矮小、茎粗、叶厚,生产上常用于壮苗。本试验初步研究了不同浓度的大量元素、AC、PP333对于鳞茎增大的影响,至于大量元素、AC、PP333协同高浓度蔗糖综合影响内源激素的变化,进而促进鳞茎生长的机理有待研究。本试验中筛选出3.0 mg/L PP333较适宜鳞茎增大。张永平等[16]筛选出15 mg/L PP333对‘索邦’鳞茎增大的效果最好,但本研究预试验中发现当PP333质量浓度超过10 mg/L 时部分小鳞茎生长变慢,鳞茎质量变差,散心现象严重并出现死亡,因此,宜将PP333质量浓度设置在10 mg/L以下。这种差异可能是由于小鳞茎生理、生化状态不同引起的。
[1] Robb S M.The culture of excised tissue bulb scales of Lilium speciosum[J].Exp Bot,1957(8):348–352.
[2] 李筱帆,张启翔.百合组织培养和植株再生的研究进展[J].安徽农业科学,2009,37(4):1479–1482.
[3] 周艳萍,郑红娟,贾桂霞.2个亚洲百合品种离体再生体系的建立[J].北京林业大学学报,2007,29(1):123–127.
[4] Hou Q,Carman J G,Varga W A.Micropropagation of Sego lily [J].Plant Cell,Tissue and Organ Culture,1997,49(2):149–151.
[5] Bacchetta L,Remotti P C,Bemardini C,et al. Adventitious shoot regeneration from leaf explants and stem nodes of Lilium [J].Plant Cell,Tissue and Organ Culture,2003,74:37–44.
[6] Hana B H,Yae B W,Yu H J,et al.Improvement of in vitro micropropagation of Lilium oriental hybrid ‘Casablanca’ by the formation of shoots with abnormally swollen basal plates[J].Scientia Horiculturae,2005,103:351–359.
[7] 宁云芬,周厚高,黄玉源,等.新铁炮百合鳞片扦插繁殖的小鳞茎形态发生[J].园艺学报,2003,30(2):229–231.
[8] 刘雅莉,张剑侠,潘学军.东方百合‘索邦’的花器官培养与快速繁殖[J].西北植物学报,2004,24(12):2350–2354.
[9] 李黛,谈锋.淡黄花百合的组织培养[J].种子,2005,25(9):27–29.
[10] Ron M S,Yong G S.Seed germination of Lilium× formolongi as influenced by temperature and plant growth regulators[J].Acta Hort,1996,414:243–250.
[11] 李春检.植物生长调节剂抑制根向地性生长的机制探讨[J].中国农业大学学报,1999,4(1):33–35.
[12] 于晓英,吴铁明,倪沛,等.百合幼胚的离体培养和植株再生[J].湖南农业大学学报:自然科学版,2000,26(4):286–288.
[13] 周晓杰,樊金萍,龚束芳,等.百合远缘杂交种子快繁方法的研究[J].作物杂志,2009,25(3):123–127.
[14] 王刚,杜捷,李桂英,等.兰州百合和野百合组织培养及快速繁殖研究[J].西北师范大学学报:自然科学版,2002,38(1):69–71.
[15] 张洁,蔡宣梅,林真,等.百合试管鳞茎诱导及膨大技术的研究[J].福建农业学报,2010,25(3):328–331.
[16] 张永平,乔永旭,陈超,等.东方百合‘索邦’组织培养及鳞茎快繁研究[J].江苏农业科学,2007,23(5):120–123.
责任编辑:王赛群
英文编辑:王 库
Optimization of tissue culture and rapid propagation system for Lilium
CUI Qi1,JIA Gui-xia1,2,3*
(1.College of Landscape Architecture, Beijing Forestry University, Beijing 100083, China; 2.National Engineering Research Center for Floriculture, Beijing 100083, China; 3.Beijing Key Laboratory of Ornamental Plants Germplasm Innovation and Molecular Breeding, Beijing 100083, China)
In order to optimize the tissue culture and rapid propagation system for Lilium, L. oriental ‘Sorbonne’, L. sulphureum Baker and L. formolongi ‘Raizan 3’ were studied, using tissue culture technology, to explore the optimum conditions of three different explants’ induction and differentiation, plantlets proliferation and bulblets enlargement. The results showed that the suitable medium for seeds germination of L. sulphureum Baker was MS medium supplemented with 0.01 mg/L NAA and 60 g/L sugar, while MS medium supplemented with 2.0 mg/L 6–BA, 0.3 mg/L NAA and 0.5 mg/L 6–BA, 0.2 mg/L NAA were the best to promote the induction of adventitious shoots for ‘Sorbonne’ and ‘Raizan 3’bulb scales respectively. The optimal medium for plantlets proliferation from three different genotypes was MS medium containing 2.0 mg/L 6–BA and 0.2 mg/L NAA. In addition, 3MS medium with 0.5 g/L AC, 3.0 mg/L PP333and 80 g/L sugar was fitted for ‘Sorbonne’ bulblets enlargement.
Lilium; regeneration system; tissue culture; rapid propagation
10.13331/j.cnki.jhau.2014.06.012
投稿网址:http://www.hunau.net/qks
Q813.1+2
A
1007−1032(2014)06−0621−06
百合(Lilium spp.)是世界著名切花之一,具有很高的观赏价值,一直深受人们喜爱,是重要的商品花卉和园林绿化植物。自Robb[1]首次离体培养百合鳞茎以来,组织培养技术在百合上的应用已取得了显著的进展,但百合种类繁多,类型各异,目前很多品种尚未形成规模化生产。组织培养技术可有效地进行百合的快速繁殖和脱毒苗生产,是提供生产用百合种球的重要途径。百合再生能力比较强,许多器官、组织可作为外植体进行离体培养,如鳞片、叶片、珠芽、花器官、种子、胚等[1–9]。关于百合组织培养的研究主要集中在不同培养途径的外植体材料、培养方式、培养条件、植物生长调节剂种类及质量浓度筛选等方面[2]。由于百合的种、品种、品系间的基因型存在差异,所以,百合诱导分化阶段的差异仍需探索。在百合继代增殖阶段,最常使用的植物生长调节剂是0.1~0.5 mg/L的NAA和0.5~2.0 mg/L的6–BA。从前人的研究中可以看出,不同基因型百合对这两类激素具有较宽的适应范围。如果能针对几种百合建立一致的继代增殖体系,在生产中可起到快速提高组培苗增殖系数、减少工作量、节约成本的作用。试管鳞茎培养是百合种球培育的关键技术环节之一。组培苗继代培养多次后容易出现鳞茎发育慢、叶根长势柔弱的现象,严重影响百合的移栽成活。通过建立促进鳞茎膨大的技术体系,能迅速增加鳞茎的重量,有效促进壮苗,去除病毒,提高移栽成活率,实现短时间内获得大量生产用优质种球的目标。新铁炮百合(Lilium × formolongi Hort.)是由高砂百合(L. formosanum Walla.)与铁炮百合(L. longiflorum Thunb.)为亲本杂交所得的子代与铁炮百合回交培育而成的杂种系列[10],其主要特点是生育期较短,花大瓣厚,花型独特,花期较长,是优良的切花品种;东方百合‘索邦’(L. oriental ‘Sorbonne’)花型优美,芳香宜人,是目前市场上最畅销的切花百合品种之一;野生淡黄花百合(L. sulphureum Baker)耐阴,耐热,抗病虫害,集食用、药用、观赏于一身,是培育百合新品种的优良种质材料。本研究中以上述3种不同基因型百合为材料,在前人研究的基础上对其组培快繁体系进行比较和优化,旨在探索一套促进百合诱导分化、继代增殖和鳞茎膨大的综合技术,为百合种球的商业化生产提供参考依据。
2014–04–15
国家“863”计划项目(SS2013AA100706);林业公益性行业科研专项(201204609);北京市园林局育种项目(YLHH201300103)
崔祺(1987—),女,山东临沂人,硕士研究生,主要从事园林植物遗传育种研究,cuiqivivi@163.com;*通信作者,gxjia@bjfu.edu.cn

