转基因作物中2种除草剂抗性基因 >aad1和dmo的PCR检测方法
龙丽坤, 韩 月, 杨丹丹, 闫 伟, 李飞武*
1吉林省农业科学院农业生物技术研究所,吉林 长春130033; 2哈尔滨师范大学生命科学与技术学院,黑龙江 哈尔滨 150025
除草剂在农业生产上对田间杂草的防治具有十分重要的作用,根据其作用方式可分为选择性除草剂和灭生性除草剂(陈海伟等,2012)。随着除草剂抗性基因的发现并将其通过遗传工程手段导入主要农作物中,抗除草剂转基因作物取得了重大发展,是当前应用面积最广的转基因作物类型。2013年全球种植的抗除草剂转基因作物(包括抗虫抗除草剂复合性状)超过1.46亿hm2,占转基因作物种植总面积的83.6%,其中具有草甘膦抗性和草铵膦抗性的转基因作物占绝大多数,这2类转基因作物的应用可确保在整个生长季使用灭生性除草剂控制田间杂草而不会对作物造成伤害,有效降低了杂草的控制成本(James,2014)。近年来,一些新的除草剂抗性基因被相继发掘和应用到转基因作物中,使得除草剂的使用更具灵活性。
转基因技术的快速发展给农业生产带来诸多有利因素,但作为一项在农业领域应用不到20年的新兴技术,社会公众对其认知度和接受程度还有待提高,围绕转基因生物及其产品是否安全的讨论在社会层面广泛存在(刘培磊等,2011)。鉴于此,许多国家根据各自国情,制定了转基因生物安全管理法律法规,其中50多个国家和地区建立了标识制度,要求对转基因产品实行定性或定量标识,以满足社会公众的知情权和选择权(王荣谈等,2013)。而转基因产品标识制度及市场监管工作的实施,需要快速、灵敏、准确的检测技术作为支撑。
按照检测靶标对象不同,可将转基因产品的检测技术划分为两大类:一类是以转入的外源DNA(如外源目的基因、表达调控元件、载体序列等)作为检测对象,这类技术包括常规PCR、实时荧光定量PCR、基因芯片等;另一类是以转入的外源目的基因或标记基因表达的蛋白质作为检测对象,如ELISA、快速检测试纸条、蛋白质芯片等(Zhang & Guo,2011)。PCR技术由于适用性广、灵敏度高,是目前国内外广泛应用的转基因产品检测技术,根据不同原理,PCR技术又能细分为定性PCR、定量PCR、多重PCR、巢式PCR、数字PCR等(邓汉超等,2011)。我国目前对转基因产品实行定性标识管理,在监管工作中主要采用定性PCR检测方法,已建立了针对CaMV35S启动子、NOS终止子等调控元件(谢家建等,2012),针对除草剂抗性基因cp4-epsps、bar(Guoetal.,2012)、抗虫基因Bt(李飞武等,2014)、CpTI(朱珠等,2012)等外源目的基因,以及针对MON88017玉米(瞿勇等,2010)、59122玉米(Xuetal.,2009)等转化事件的PCR检测方法,但未见除草剂抗性基因aad1 和dmo的PCR检测方法的报道。
本研究以在转基因作物中进行商业化应用的2种新的除草剂抗性基因aad1 和dmo为对象,开展PCR检测体系、方法特异性、灵敏度、稳健性等测试,旨在建立针对这2种外源目的基因的特异性PCR检测方法,为转基因作物的安全监管提供切实可行的技术手段。
1 材料与方法
1.1 植物试验材料
转aad1 基因玉米DAS40278-9(ERM-BF433d)、转cp4-epsps基因玉米NK603(ERM-BF415f)、转cry1Ab和pat基因玉米Bt11(ERM-BF412f)、转cry34Ab、cry35Ab和pat基因玉米59122(ERM-BF424d)转mcry3A和pmi基因玉米MIR604(ERM-BF423d)购自欧洲标准物质与测量研究所(IRMM),转dmo基因大豆MON87708由孟山都公司研发和馈赠,非转基因玉米、大豆为本实验室收集保存的样品。
1.2 基因组DNA提取
应用植物基因组DNA提取试剂盒(DP320)[天根生化科技(北京)有限公司]提取样品基因组DNA,操作步骤按试剂盒使用说明执行,提取的DNA用ND1000核酸微量分光光度计(美国Thermo Fisher)测定浓度和纯度,并用试剂盒附带的DNA稀释缓冲液稀释至25 ng·μL-1,-20 ℃保存备用。
1.3 PCR反应
单一PCR:在200 μL的PCR反应管中依次加入10×PCR缓冲液2.5 μL,2.5 mmol·L-1的dNTPs混合溶液2 μL,10 μmol·L-1上下游引物各0.5 μL,5 U·μL-1热启动rTaq DNA聚合酶0.125 μL,基因组DNA溶液2 μL,加超纯水至25 μL。PCR扩增程序为:94 ℃预变性5 min;35个循环(94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s);72 ℃延伸5 min。
双重PCR:除加入2对0.5 μL引物,并相应调整超纯水的用量至PCR体系总体积为25 μL外,其他组分的用量及PCR反应程序与单一PCR相同。
电泳检测:PCR扩增结束后,取 10 μL扩增产物在2%的琼脂糖凝胶中进行电泳检测。
2 结果与分析
2.1 除草剂抗性基因的核苷酸序列分析及引物设计与筛选
根据研发人公开的国内外专利信息(Brinkeretal.,2013; Cuietal.,2012),使用生物信息学软件Vector NTI Advance®11.5进行序列比对分析,获得了DAS40278-9玉米中的aad1 基因(1005 bp)和MON87708大豆中的dmo基因(1275 bp)的核苷酸序列。以这2个基因的序列为模板,应用Primer Premier 5.0设计了一系列PCR检测引物,经过试验验证确定的检测引物相关信息见表1。为保证所设计引物序列的特异性,将设计的引物序列提交NCBI数据库(http:∥blast.st-va.ncbi.nlm.nih.gov/Blast.cgi)进行核苷酸序列检索,结果显示,引物序列与主要农作物均不具有同源性,从理论上保证了引物在转基因作物检测中的特异性。

表1 PCR检测引物信息Table 1 Information of the PCR primers
2.2 单一PCR检测方法的特异性测试
以DAS40278-9玉米、NK603玉米、Bt11玉米、59122玉米、MIR604玉米、MON87708大豆等6种转基因作物以及非转基因玉米和大豆为测试样品,对aad1 基因和dmo基因的检测方法进行特异性测试。PCR扩增产物的电泳图谱见图1和图2,在aad1 基因检测体系中仅DAS40278-9玉米样品出现特异性条带,dmo基因检测体系中仅MON87708大豆样品出现特异性条带,其他测试样品和空白对照在2种检测体系中均未出现特异性产物,表明本研究建立的2种除草剂基因的PCR检测方法对靶标基因具有高度特异性。
2.3 单一PCR检测方法的灵敏度测试
提取DAS40278-9玉米的基因组DNA,用0.1×TE缓冲液对其进行梯度稀释,获得质量浓度为250、125、25、12.5、2.5 pg·μL-1的5份样品,取2 μL作为模板,利用aad1 基因的PCR检测方法进行测试,以判定方法的灵敏度。采用同样的制样方法,获得MON87708大豆基因组DNA质量浓度为250、125、25、12.5、2.5 pg·μL-1的5份样品,用于dmo基因的PCR检测方法的灵敏度测试。结果如图3和图4所示,2个基因的PCR检测方法均可以从25 pg·μL-1及以上浓度的样品中获得与预期大小一致的扩增产物,表明本研究建立的aad1 基因和dmo基因的PCR检测方法的检出限均可达到50 pg,按照玉米和大豆的基因组DNA大小进行估算(Arumuganathan & Earle,1991),2种方法的绝对检出限分别约为20个拷贝和40个拷贝,具有良好的灵敏度。

图1 aad1 基因PCR检测方法的特异性Fig.1 Specificity of PCR method for detecting aad1 gene M:DL2000 DNAMarker;1:空白对照;2:DAS40278-9;3:NK603;4:Bt11;5:59122;6:MIR604;7:MON87708;8:非转基因玉米和大豆混样。 M: DL2000 DNA Marker; 1: blank control; 2: DAS40278-9; 3: NK603; 4: Bt11; 5: 59122; 6: MIR604; 7: MON87708; 8: non-GM maize and soybean mix.
2.4 PCR检测体系的稳健性
为测试aad1 基因和dmo基因PCR检测方法对不同退火温度的适应度,对每种基因的PCR检测体系均设置56、58、60、62、64 ℃等5个退火温度,进行PCR方法的稳健性测试。PCR扩增结果见图5,2个基因的PCR检测体系在5种退火温度条件下,均能获得与预期一致的PCR产物,表明2种基因的PCR检测方法对退火温度有较宽的适合度,具有良好的适用性。

图2 dmo基因PCR检测方法的特异性Fig.2 Specificity of PCR method for detecting dmo gene M:DL2000 DNA Marker;1:空白对照;2:MON87708;3:NK603;4:Bt11;5:59122;6:MIR604;7:DAS40278-9;8:非转基因玉米和大豆混样。 M: DL2000 DNA Marker; 1: blank control; 2: MON87708; 3: NK603; 4: Bt11; 5: 59122; 6: MIR604; 7: DAS40278-9; 8: non-GM maize and soybean mix.
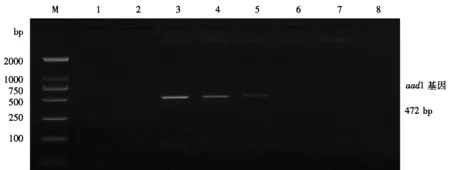
图3 aad1 基因PCR检测方法的灵敏度Fig.3 Sensitivity of PCR method for detecting aad1 gene M:DL2000 DNA Marker;1:空白对照;2:非转基因玉米和大豆混样;3~7分别代表质量浓度为250、125、25、12.5、2.5 pg·μL-1的DAS40278-9玉米基因组DNA样品。 M: DL2000 DNA Marker; 1: blank control; 2: non-GM maize and soybean mix; 3~7: 250, 125, 25, 12.5 and 2.5 pg·μL-1 of DAS40278-9 maize genomic DNA, respectively.

图4 dmo基因PCR检测方法的灵敏度Fig.4 Sensitivity of PCR method for detecting dmo gene M:DL2000 DNA Marker;1:空白对照;2:非转基因玉米和大豆混样;3~7分别代表质量浓度为 250、125、25、12.5、2.5 pg·μL-1的MON87708大豆基因组DNA样品。 M: DL2000 DNA Marker; 1: blank control; 2: non-GM maize and soybean mix; 3~7: 250, 125, 25, 12.5 and 2.5 pg·μL-1 of MON87708 soybean genomic DNA, respectively.
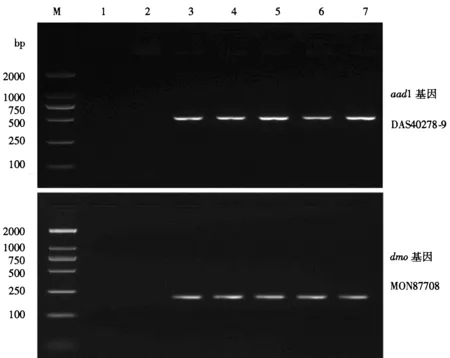
图5 PCR检测方法的稳健性Fig.5 Robustness of PCR method M:DL2000 DNA Marker;1:空白对照;2:非转基因玉米和大豆混样;3~7分别代表退火温度为56、58、60、62、64 ℃。 M: DL2000 DNA Marker; 1: blank control; 2: non-GM maize and soybean mix; 3~7: annealing with 56, 58, 60, 62 and 64 ℃, respectively.
2.5 双重PCR检测体系的建立
本研究将aad1 基因和dmo基因的PCR检测引物放到同一个反应体系中,旨在建立能同时检测这2个靶标基因的双重PCR检测方法。将DAS40278-9玉米的基因组DNA和MON87708大豆的基因组DNA等量混合,并用0.1×TE缓冲液对混合DNA样品进行梯度稀释,获得DAS40278-9玉米基因组DNA和MON87708大豆基因组DNA的质量浓度均为250、125、25、12.5、2.5 pg·μL-1的5份样品,对双重PCR检测体系进行测试。结果如图6所示,利用双重PCR检测体系,可获得与单一PCR检测体系相同的检测灵敏度,双重PCR检测体系中aad1 基因和dmo基因的检出限分别可达到约20个拷贝和40个拷贝。

图6 双重PCR检测方法的灵敏度Fig.6 Sensitivity of the duplex PCR for detecting aad1 and dmo gene M:DL2000 DNA Marker;1:空白对照;2:非转基因玉米和大豆混样;3~7分别代表质量浓度各为250、125、25、 12.5、2.5 pg·μL-1的DAS40278-9玉米和MON87708大豆基因组DNA混样。 M: DL2000 DNA Marker; 1: blank control; 2: non-GM maize and soybean mix; 3~7: 250, 125, 25, 12.5 and 2.5 pg·μL-1 of DAS40278-9 maize and MON87708 soybean genomic DNA mix, respectively.
3 讨论
将除草剂抗性基因导入作物后,可使后者拥有抗除草剂的特性,这为农业生产上应用除草剂防治杂草提供了便利(李云河等,2012)。通过查询国内外有关数据库,目前在生产上应用的除草剂抗性基因主要为cp4-epsps、bar、aad1、dmo等,其中cp4-epsps基因和bar基因在转基因作物商业化初期就已投入应用,是目前使用频次最高的2类除草剂抗性基因(陈海伟等,2012),aad1 基因和dmo基因自2011年开始在商业化转基因作物中出现并已有多种转化体进入中国市场。因此,以除草剂抗性基因为靶标对象的特异性检测方法是转基因产品日常监管和筛选检测的重要技术手段之一。
由于cp4-epsps基因和bar基因在转基因作物中已被广泛长期应用,针对这2个基因的PCR检测方法已有诸多报道,并形成相应的国家标准(路兴波等,2012; 杨立桃等,2012)。然而,aad1 基因和dmo基因是近几年来才被应用于转基因作物,而且含有这2个基因的转化体才开始向我国提交进口申请,目前还未见关于aad1 基因和dmo基因的PCR检测方法的报道。本研究通过查询国内外专利信息,获得了这2个基因的核苷酸序列,并根据该序列建立了特异性检测这2个基因的PCR检测方法,检出限可达到20个拷贝(aad1 )和40个拷贝(dmo),能够满足日常监管工作的需要,该方法的相关技术指标已达到同类检测方法的水平(Guoetal.,2012)。
在一个PCR体系中同时检测多种转基因成分可提高检测效率、降低检测成本(王渭霞等,2009)。本研究将aad1 基因和dmo基因的检测引物放在同一个PCR反应管中进行检测,建立了能在一个PCR管中同时检测这2个目的基因的双重PCR方法,检测灵敏度达到与单一PCR方法相同的水平,具有较好的应用前景。
陈海伟, 张鲁华, 陈德富, 陈喜文. 2012. 除草剂及抗除草剂作物的应用现状与展望. 生物技术通报, (10): 35-40.
邓汉超, 尹长城, 刘国振, 林健荣, 邓平建. 2011. 转基因植物核酸成分检测技术研究进展. 中国生物工程杂志, 31(1): 86-95.
李飞武, 闫伟, 龙丽坤, 李葱葱, 张世宏, 张明. 2014. 应用多重PCR技术筛选检测转Bt基因作物. 现代食品科技, 30(5): 262-266.
李云河, 彭于发, 李香菊, 吴孔明. 2012. 转基因耐除草剂作物的环境风险及管理. 植物学报, 47(3): 197-208.
刘培磊, 康定明, 李宁. 2011. 我国转基因技术风险交流分析. 中国生物工程杂志, 31(8): 145-149.
路兴波, 宋贵文, 李凡, 沈平, 杨立桃, 孙红炜, 武海斌, 王敏, 王鹏. 2012. 转基因植物及其产品成分检测bar或pat基因定性PCR方法. 北京: 中国农业出版社.
瞿勇, 武玉花, 吴刚, 曹应龙, 卢长明. 2010. 转基因玉米MON88017转化事件特异性定性PCR检测方法及其标准化. 农业生物技术学报, 18(6): 1208-1214.
王荣谈, 姜羽, 韦娇君, 张大兵, 杨立桃. 2013. 转基因生物及其产品的标识与检测. 植物生理学报, (7): 645-654.
王渭霞, 赖凤香, 洪利英, 傅强. 2009. 应用多重PCR技术快速检测抗虫转基因水稻. 中国测试, 35(6): 97-101.
谢家建, 沈平, 彭于发, 李葱葱, 宋贵文, 孙爻. 2012. 转基因植物及其产品成分检测调控元件CaMV 35S启动子、FMV 35S启动子、NOS启动子、NOS终止子和CaMV 35S终止子定性PCR方法. 北京: 中国农业出版社.
杨立桃, 厉建萌, 刘勇, 张大兵, 宋贵文, 兰青阔, 郭金超, 宋君. 2012. 转基因植物及其产品成分检测CP4-epsps基因定性PCR方法. 北京: 中国农业出版社.
朱珠, 王永, 兰青阔, 赵新, 余景会, 郭永泽, 程奕. 2012. 抗虫转CpTI基因植物定性PCR检测技术的建立. 河南农业科学, 41(5): 56-60.
Arumuganathan K and Earle E D. 1991. Nuclear DNA content of some important plant species.PlantMolecularBiologyReporter, 9: 208-218.
Brinker R J, Burns W C, Feng P C, Gupta A, Hoi S W, Malven M and Wu K. 2013.SoybeantransgeniceventMON87708andmethodsofusethereof. US 8501497 B2. 2013-08-06.
Cui Y X, Bryan J R, Maum D G, Gilles G J, Wright T R, Hamilton J L, Arnold N L, Van Opdorp N J, Kaiser T M and Zhou N. 2012.AAD-1eventDAS-40278-9,relatedtransgeniccornlines,andevent-specificidentificationthereof. US2012/0222153A1. 2012-08-30.
Guo J C, Chen L L, Liu X, Gao Y, Zhang D B and Yang L T. 2012. A multiplex degenerate PCR analytical approach targeting to eight genes for screening GMOs.FoodChemistry, 132: 1566-1573.
James C. 2014. 2013年ISAAA全球生物技术转基因作物商业化发展态势. 中国生物工程杂志, 34(1) : 1-8..
Xu W T, Liang Z H, Rong Y, Luo Y B, Zhang F F, Yuan Y F and Huang K L. 2009. Characterization and event-specific quantitative detection of DAS-59122-7 maize insert with the application of plasmidic reference material.JournaloftheScienceofFoodandAgriculture, 89: 494-503.
Zhang D B and Guo J C. 2011. The development and standardization of testing methods for genetically modified organisms and their derived products.JournalofIntegrativePlantBiology, 53: 539-551.

