不同淋巴结转移潜能口腔鳞癌细胞株的形态学分析及流式细胞周期分析的研究
申叶春 曹岩 蔡艳霞 张凡
·论著·
不同淋巴结转移潜能口腔鳞癌细胞株的形态学分析及流式细胞周期分析的研究
申叶春 曹岩 蔡艳霞 张凡
目的探讨口腔鳞癌不同转移潜能细胞株形态学的变化,及对细胞周期、凋亡指数的影响。方法复苏传代口腔鳞癌高、低淋巴结转移潜能细胞株,利用倒置显微镜观察不同细胞株的形态学差异,采用病理图像分析系统对两种不同细胞株的形态学参数进行分析;利用免疫细胞化学检测两种细胞株中CEA、EMA的表达;流式细胞术检测培养12 h、24 h、36 h、48 h、60 h、72 h时间节点细胞周期分布差异。结果高淋巴结转移细胞株呈梭形外形,粘附性较差,随传代时间的延长,细胞异型性更加明显、且梭形变较突出;低淋巴结转移细胞株呈圆形或卵圆形,细胞粘附性差,体积较小,细胞异型性不明显;高淋巴结转移细胞株CEA、EMA的阳性细胞比率为(84±7)%和(83±5)%,在低淋巴结转移细胞株中的阳性细胞比率分别为(89±7)%和(81±6)%,两种指标在不同细胞株中的阳性率比较差异无统计学意义(P>0.05)。细胞形态学图像分析结果显示2种细胞株在细胞面积、周长、等效直径、长径、短径高转移组明显高于低转移组,差异有统计学意义(P<0.05);2组细胞株的细胞变异参数面积、周长、等效直径、长径、短径高转移组明显低于低转移组(P<0.05)。流式细胞术结果显示高淋巴结转移细胞株的细胞凋亡指数明显低于低转移组细胞凋亡指数(P<0.05)。高淋巴结转移细胞株G1细胞比值明显低于低转移细胞株,差异有统计学意义(P<0.05); G2期高低转移组,差异无统计学意义(P>0.05);S期明显高于低淋巴结转移组,差异有统计学意义(P<0.05)。结论不同淋巴结转移潜能的口腔鳞癌细胞株在形态学参数方面存在一定的差异,这可能是造成其具有不同转移潜能的结构基础;口腔鳞癌细胞株凋亡抑制和细胞合成期比例优势是导致淋巴结转移的分子基础。
口腔鳞癌;细胞形态学;流式细胞术;凋亡指数;免疫细胞化学
口腔鳞癌的恶性程度取决于其局部浸润和淋巴结转移的能力,侵袭临近组织和远处淋巴结转移是导致复发、放化疗不敏感的主要因素,也是常见死因,而细胞形态学改变和凋亡抑制是导致肿瘤侵袭能力增强、恶性程度增加的原因,与淋巴结转移间的关系少见报道,本实验利用细胞培养、免疫细胞化学、流式细胞术检测口腔鳞癌不同淋巴结转移潜能细胞株的差异,从形态和分子机制对淋巴结转移与凋亡关系进行研究。
1 材料与方法
1.1 实验材料与设备 口腔鳞癌淋巴结高转移细胞株(SCC-LH)、低转移细胞株(SCC-LL)由北京大学医学部口腔医学院惠赠。RPMI- 1640细胞培养基(lnvin’ogen公司);新生小牛血清 (杭州四季青生物工程有限公司);胰蛋白酶A 、青霉素、链霉素(华北制药股份有限公司);二甲基亚砜(DMSO) (美国Sigma公司);EMA鼠抗人单克隆抗体、CEA鼠抗人单克隆抗体 (北京中杉试剂公司);倒置显微镜(日本Olympus);PI粉(美国Sigma公司);AnnexinV-FITC 细胞凋亡检测试剂盒 (南京凯基生物);CO2培养箱 (科俊仪器有限公司);低温高速离心机D-78532(德国 Hettich Zentrifugen 公司) FAC Sort 流式细胞仪 (美国BD公司)。
1.2 细胞复苏 实验室常规消毒,紫外照射40 min,培养液(DMEM)、0.25%胰蛋白酶(Trypsin)恒温水浴箱37℃预热20 min,从液氮保存罐中取出冻存管,立即放入40℃水浴中,快速摇晃,直至冻存液完全融化,将细胞悬液移入15 ml离心管,缓慢加入4 ml培养液,离心(1 000 r/min,5 min),用培养液悬液混悬沉淀细胞,调整细胞浓度,放培养箱中培养。
1.3 细胞传代培养 紫外线照射超净工作台30 min,用75%乙醇擦拭双手,预热培养液,两种细胞株均在含10%小牛血清、青霉素(100 U/ml)、链霉素(100 U/ml)双抗的RPMI-1640培养液中培养,温度37℃、相对湿度90%、体积分数为5% CO2的培养箱中进行培养,定期观察细胞生长情况,每隔2~3 d用0.25%胰酶消化,进行传代培养。在倒置显微镜下观察消化细胞,当原贴壁细胞逐渐趋于圆形,细胞质回缩,细胞间不在连接成片时为合适消化程度,加入新的培养液停止消化。用弯头吸管吸取培养液,反复吹打成细胞悬液,吸出适量细胞悬液分装到2~3个培养瓶中,加入适量的培养液后旋紧瓶盖,以乙醇棉球擦拭外壁适当旋松瓶盖,放入二氧化碳培养箱中继续培养,换液及传代时间有细胞生长情况而定。
1.4 细胞形态学图像分析系统 每张细胞爬片放入95%乙醇中固定15 min,HE染色,置于40倍显微镜下观察,选择细胞密集重叠较少的区域采图, 使用CMIAS真彩色病理图像分析系统采集细胞涂片的显微图像, 然后选择细胞分布较均匀、细胞边界清晰的视野采集4~10幅400倍图片,保证有核细胞200个以上,对有核细胞进行自动分割,辅以手工分割,对分割出的单个细胞进行各种形态学参数(面积、周长、等效直径、长径、短径、长短径比、形状因子、圆形度、异形指数)自动测量;对不同细胞株间的细胞核、浆的面积、核浆比例、细胞周长、平均直径、圆度、形状因子进行分割,编辑,统计,获得细胞学变异系数。
1.5 流式细胞仪检测细胞周期的分布 0.25%胰蛋白酶消化细胞制成细胞悬液,1 000 r/min离心5 min,PBS 洗涤2次,冰乙醇固定,-20℃过夜。取出悬液1 000 r/min离心5 min,弃乙醇固定液,PBS洗涤2次,调整细胞浓度为5×105/ml,加入PI染液1 ml,4℃孵育60 min,200 目钢筛过滤。以488 nm 氩离子激光激发,应用ModFit LT2.0软件和CELLQuest 软件进行细胞周期的检测和分析。
1.6 流式细胞仪检测细胞凋亡 0.25%胰蛋白酶消化收集细胞,制成悬液1 000 r/min离心5 min,用PBS洗涤细胞2次,调整细胞浓度为(1~5)×105/ml,加入500 μl的Binding Buffer 悬浮细胞,加入5 μl Annexin V-FITC混匀后,加入5 μl Propidium Iodide,混匀;室温、避光、反应5~15 min;用流式细胞仪检测,激发波长Ex=488 nm;发射波长Em=530 nm。应用CELLQuest软件进行凋亡数据的分析。
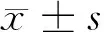
2 结果
2.1 不同培养时间不同细胞株的形态学观察 高淋巴结转移细胞株呈梭形排列,粘附性较差,随传代时间的延长,细胞异型性更加明显、且梭形变较突出;低转移细胞株呈圆形或卵圆形,细胞粘附性差,体积较小,细胞异型性不明显。见图1~4。
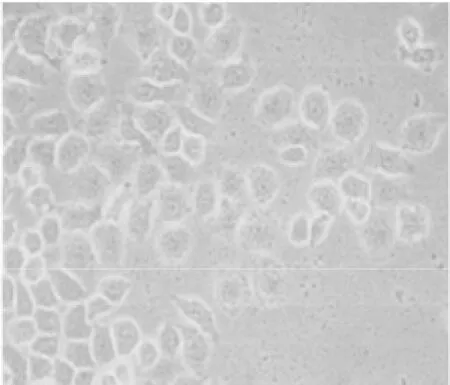
图1 高转移细胞株传代培养(12 h)(HE×40)

图2 高转移细胞株传代培养(36 h)(HE×40)

图3 低转移细胞株传代培养(12 h)(HE×40)
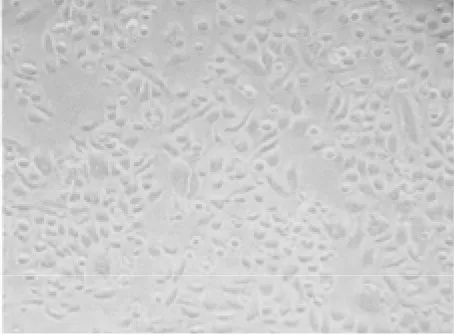
图4 低转移细胞株传代培养(36 h)(HE×40)
2.2 CEA、EMA单克隆抗体在传代细胞的表达 传代细胞均高比例表达CEA、EMA,证明细胞株的传代培养成功;高淋巴结转移细胞株中CEA、EMA的阳性细胞比率(84±7)%和(83%±5)%,与低淋巴结转移细胞株的(89±7)%和(81±6)%比较,差异无统计学意义(P>0.05)。见图5、6。

图5 CEA在癌细胞浆的表达(HE×100)

图6 EMA在癌细胞膜的表达(HE×100)
2.3 不同细胞株间细胞学形态参数和变异系数的比较 高淋巴结转移细胞株细胞面积、周长、等效直径、长径、短径明显高于低转移组,差别有统计学意义(P<0.05);长短比、形状因子、圆形度、异形指数间比较无统计学意义(P>0.05);高转移细胞株的细胞变异参数在面积、周长、等效直径、长径、短径间明显高于低转移组组(P<0.05);长短比、形状因子、圆形度、异形指数间比较无统计学意义(P>0.05)。见表1、2。
表1 不同细胞株细胞形态学参数测定结果比较
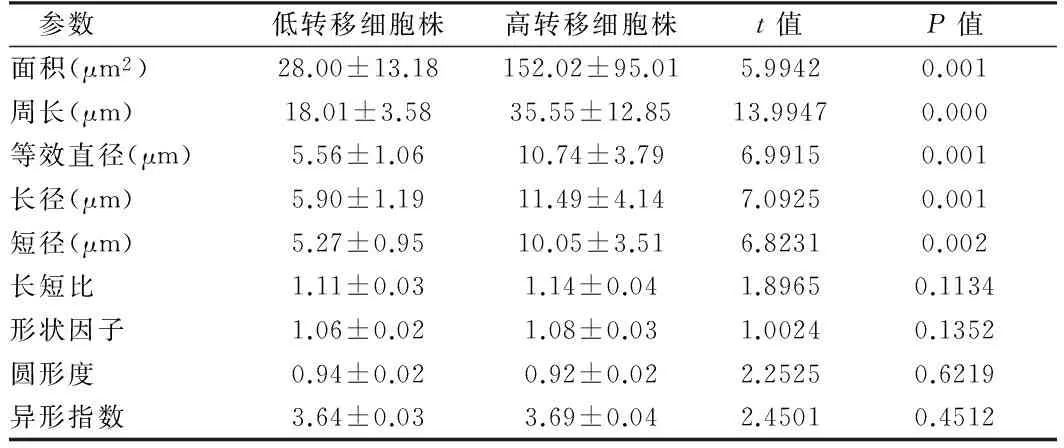
表1 不同细胞株细胞形态学参数测定结果比较
参数低转移细胞株高转移细胞株t值P值面积(μm2)28.00±13.18152.02±95.015.99420.001周长(μm)18.01±3.5835.55±12.8513.99470.000等效直径(μm)5.56±1.0610.74±3.796.99150.001长径(μm)5.90±1.1911.49±4.147.09250.001短径(μm)5.27±0.9510.05±3.516.82310.002长短比1.11±0.031.14±0.041.89650.1134形状因子1.06±0.021.08±0.031.00240.1352圆形度0.94±0.020.92±0.022.25250.6219异形指数3.64±0.033.69±0.042.45010.4512
2.4 2种细胞株不同培养时间的凋亡指数、细胞周期分布比较 低淋巴结转移组细胞凋亡指数,高于高淋巴结转移细胞株的细胞凋亡指数差异有统计学意义(P<0.05)。高转移细胞株G1期比率明显低于低转移细胞株(P<0.05);G2期比率在2组细胞株间无明显差异(P>0.05);S期比率在高转移细胞株明显高于低转移细胞株(P<0.05)。见表3,图7、8。
表2 不同细胞株细胞形态学参数变异系数比较
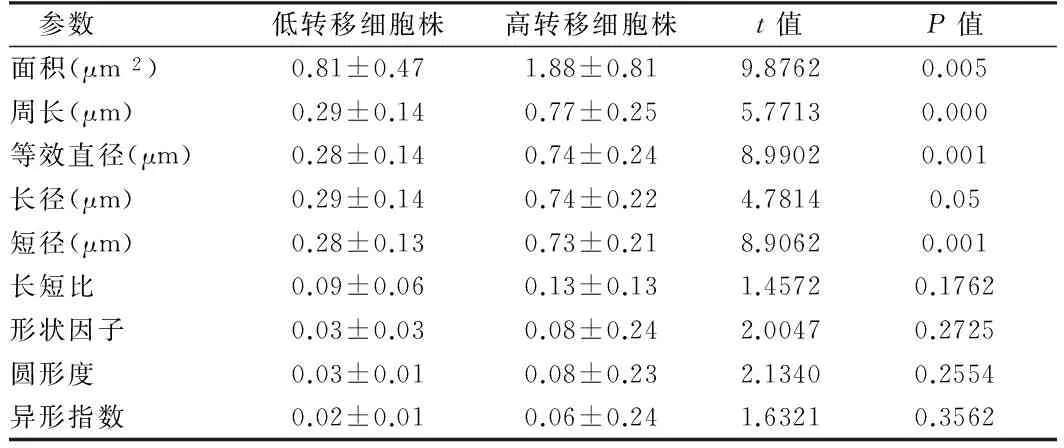
表2 不同细胞株细胞形态学参数变异系数比较
参数低转移细胞株高转移细胞株t值P值面积(μm2)0.81±0.471.88±0.819.87620.005周长(μm)0.29±0.140.77±0.255.77130.000等效直径(μm)0.28±0.140.74±0.248.99020.001长径(μm)0.29±0.140.74±0.224.78140.05短径(μm)0.28±0.130.73±0.218.90620.001长短比0.09±0.060.13±0.131.45720.1762形状因子0.03±0.030.08±0.242.00470.2725圆形度0.03±0.010.08±0.232.13400.2554异形指数0.02±0.010.06±0.241.63210.3562
表3 不同淋巴结转移潜能细胞株细胞周期的分布比较

表3 不同淋巴结转移潜能细胞株细胞周期的分布比较
组别G1G2St值P值高转移78.4±5.964.20±0.4517.40±4.25tG1=13.79240.001低转移56.44±4.78 6.40±1.6637.22±5.37tG2=3.42500.2456tS=9.76540.005

图7 高淋巴结转移口腔鳞癌细胞株细胞周期分布流式曲线

图8 低淋巴结转移口腔鳞癌细胞株细胞周期分布流式曲线
3 讨论
口腔鳞癌是颌面部常见的恶性肿瘤,治疗方式以手术为主的综合序列治疗模式不断推广,尽管肿瘤的局部控制率有了显著提高,但口腔鳞癌患者的5年生存率仍然维持在50%~55%,无明显改善,主要原因是局部侵袭和远处转移[1,2]。口腔鳞癌患者在局部复发和远处转移等方面存在明显差异,导致不同的预后,与肿瘤细胞自身不同的异质性和基因组不稳定性密切相关。肿瘤的淋巴结转移始动因素与细胞表面的粘附分子改变以及细胞形态变异密切相关, 两者协同作用导致肿瘤细胞脱离原发灶进入间质,与间质细胞粘附,侵袭能力增加,同时肿瘤细胞进入间质或血流后受到多种局部微环境及机体免疫促凋亡因素调控,克服失巢凋亡成为其发展过程中的重要环节。Chien等[3]于描述了失巢凋亡这种特殊的凋亡形式,认为正常上皮或内皮细胞存在粘附依赖性,其存活依赖于细胞间和细胞与基质间的信号传递,称之为锚定依赖。如正常上皮或不具备转移性质的实体瘤细胞从原发部位脱落进入血流后就会引发凋亡,称之为失巢凋亡[3-5]。恶性肿瘤在离开原发部位后仍能长时间保持存活,其抗失巢凋亡的能力的获得是肿瘤细胞进行侵袭、转移的先决条件。恶性肿瘤的这种抗失巢凋亡的特性已经在包括肺癌、大肠癌、卵巢癌、恶性黑色素瘤的体外细胞培养中得到证实,而口腔鳞癌极易出现局部复发和肿瘤浸润前沿明显的异质性也提示肿瘤细胞可能存在抗凋亡特性[6]。本实验证实:不同淋巴结转移潜能的细胞株细胞外形存在明显差别,高淋巴结转移细胞株细胞粘附性差,外形梭形变明显,低淋巴结转移细胞株外形圆形比率较高,同时图像分析软件对细胞形态学指标分析显示高淋巴结转移组细胞异型性更加明显,高淋巴结转移细胞株细胞面积、周长、等效直径、长径、短径明显高于低转移组;长短比、形状因子、圆形度、异形指数间比较无明显差别;高转移细胞株的细胞变异参数在面积、周长、等效直径、长径、短径间明显高于低转移组组;长短比、形状因子、圆形度、异形指数间比较无明显差别,说明高转移细胞株的梭形变和粘附力降低是恶性程度增加的形态学基础,提示参与上皮间质转换为间质浸润提供表面分子表型改变。
肿瘤细胞获得侵袭转移能力是完成转移过程的前提,但并非所有的肿瘤细胞都具有这种能力并完成整个过程,经典理论认为转移是癌细胞高度克隆选择的过程。肿瘤转移潜能在原发瘤阶段即已获得,在进展过程中受到内外界因素的影响而调节。同时细胞凋亡是一种由基因控制的细胞自主性死亡过程,是在促凋亡因素和抗凋亡因素共同调节下得以正常进行的,是维持体内环境稳定的重要机制之一。细胞凋亡调节平衡紊乱与肿瘤的发生密切相关。因此运用基因增补法将能有效促进肿瘤细胞凋亡的目的基因导入肿瘤细胞,使其表达产物补偿缺陷基因的功能或使原有的促凋亡功能得到加强,从而达到治疗肿瘤的目的[7-9]。肿瘤细胞在抑制失巢凋亡同时获得基因型及细胞表型的改变,使其更具侵袭和转移能力,而细胞周期是最能反映细胞增殖活性改变的客观指标。本实验显示:口腔鳞癌细胞株高淋巴结转移细胞株的细胞凋亡指数明显低于低淋巴结转移组细胞凋亡指数(P<0.05)。高转移细胞株G1期比率明显低于低转移细胞株;G2期比率在2组细胞株间无明显差异(P>0.05);S期比率在高转移细胞株明显高于低转移细胞株(P<0.05),说明高淋巴结转移组细胞明显处于高代谢状态,增殖活性较高,遗传物质合成占优势,而低淋巴结转移肿瘤细胞G1期占优势,说明其增殖活性低于高淋巴结转移组。因此,对细胞凋亡调控因子的研究将有利于探索恶性肿瘤发生的奥秘,为进一步治疗肿瘤奠定基础。
1 Praper T,Sonnen AF,Kladnik A.Perforin activity at membranes leads to invaginations and vesicle formation.Proc Natl Acad Sci USA,2011,108:21016-21021.
2 Wu YV,Okada T,DeCarolis P.Restoration of C/EBPα in dedifferentiated liposarcoma induces G2/M cell cycle arrest and apoptosis.Genes Chromosomes Cancer,2012,51:313-327.
3 Chien CC,Ko CH,Shen SC.The role of COX-2/PGE2 in gossypol-induced apoptosis of colorectal carcinoma cells.J Cell Physiol,2012,227:3128-3137.
4 Wang J,Ding W,Sun B.Targeting of colorectal cancer growth,metastasis,and anti-apoptosis in BALB/c nude mice via APRIL siRNA.Mol Cell Biochem,2012,363:1-10.
5 Wirawan E,Lippens S,Vanden Berghe T.Beclin1: a role in membrane dynamics and beyond.Autophagy,2012,8:6-17.
6 Black SM,Benson BA,Idossa D.Protection of porcine endothelial cells against apoptosis with interleukin-4.Xenotransplantation,2011,18:343-354.
7 Spotin A,Majdi MM,Sankian M.The study of apoptotic bifunctional effects in relationship between host and parasite in cystic echinococcosis: a new approach to suppression and survival of hydatid cyst.Parasitol Res,2012,110:1979-1984.
8 Gortat A,San-Roman MJ,Vannier.Single point mutation in Bin/Amphiphysin/Rvs (BAR) sequence of endophilin impairs dimerization,membrane shaping,and Src homology 3 domain-mediated partnership.J Biol Chem,2012,287:4232-4247.
9 Yee NS,Zhou W,Lee M.Targeted silencing of TRPM7 ion channel induces replicative senescence and produces enhanced cytotoxicity withgemcitabine in pancreatic adenocarcinoma.Cancer Lett,2012,318:99-105.
10.3969/j.issn.1002-7386.2014.08.012
075000 河北省张家口市,河北北方学院附属第一医院口腔科
R 78
A
1002-7386(2014)08-1154-04
2013-12-11)

