肝癌患者术中循环血肿瘤细胞的变化
, ,
(1.遵义医学院附属医院麻醉科,贵州 遵义 563003;2.四川大学华西医院麻醉科,四川 成都 610038;3.第三军医大学西南医院麻醉科,重庆 400038)
肝癌是中国乃至全世界发病率最高的肿瘤之一[1],目前手术切除仍然是治疗肝癌最有效的方法。作为人体内最大的器官,肝脏本身以及周围邻近组织丰富的血运,使得肝癌具有较高术后复发率和转移率,预后较差[2]。因此肿瘤术后复发及转移仍是外科医生面临的重大难题。本研究通过对肝癌患者术中循环血肿瘤细胞的研究,确定肝癌切除手术是否会增加肝癌患者术后肿瘤转移率及复发率,为临床治疗方式的选择提供参考。
1 资料与方法
1.1 病例收集
本研究为开放式研究,选取行手术治疗的肝癌患者为研究对象,以健康志愿者作为对照。记录所有研究对象的性别、年龄、体质量。本研究共纳入38名研究对象。肝癌患者18名,男17名(94.4%),女1名(5.6%),平均年龄(51.19±12.41)岁,体质量(60.81±9.99) kg;健康志愿者20名,男8名(40%),女12名(60%),平均年龄为(30.90±7.13)岁,体质量(57.43±9.56) kg。
1.2 样本采集及实验分组
用无菌抗凝注射器抽取每位研究对象的循环血。肝癌患者在手术切皮开始后分别抽取切肝前和切肝后循环血各20 mL;因本研究纳入的所有手术患者手术开始的时间均为上午9:00~10:00,故健康志愿者采血时间定为9:00~10:00,每人抽血20 mL。
1.3 实验方法
1.3.1 血液样本检测 所有样本采集离体后即刻4 ℃保存,于24 h内进行实验。常规检测:每例样本取2 mL进行血常规检测,主要对白细胞进行计数;取20 μl用牛鲍氏计数板进行显微镜下全血有核细胞计数。免疫荧光法检测:每例样本取2 mL血样,使用红细胞裂解法富集有核细胞,富集的有核细胞即刻进行细胞涂片,每例样本涂片2张,经4%多聚甲醛固定后晾干备用。使用荧光抗体CD133标记细胞膜、荧光抗体AE1/AE3标记细胞浆,荧光染料DAPI标记细胞核进行荧光染色。染色完成后在多通道、放大倍数可调式荧光显微镜下进行观察和计数。随机选取20个视野计数其内的所有有核细胞数及抗体阳性表达的细胞数。
1.3.2 细胞培养 每例样本取16 mL血样在无菌环境下进行密度梯度离心分离富集有核细胞,制成细胞悬液用于细胞原代培养。培养10~15 d,培养过程中观察细胞生长情况及细胞克隆成株情况,并记录克隆株的数量及形态。培养结束后将标本用4%多聚甲醛固定,再进行免疫荧光法检测。
1.4 统计学处理
2 结果
2.1 血常规检测与有核细胞计数
比较切肝前后样本经血常规检测到的白细胞数量和经显微镜计数到的全血有核细胞数,肝癌患者切肝后的白细胞数上升,切肝后血中的有核细胞总数也较切肝前增加(表1)。

表1 切肝前后白细胞数及有核细胞计数
*:与切肝前比较,P<0.01
2.2 免疫荧光检测结果
2.2.1 免疫荧光染色结果 免疫荧光检测发现的阳性细胞有3种表现,分别为AE1/AE3阳性和CD133阴性、AE1/AE3阴性和CD133阳性、AE1/AE3阳性和CD133阳性,3种阳性细胞在各组样本中均有发现(图1)。
2.2.2 各类阳性细胞样本例数比较 统计出各组样本中存在不同阳性细胞的样本例数如表2所示,各类阳性样本例数在各组间比较,无统计学差异(P>0.05)。3组AE1/AE3阳性细胞的总样本数为55例(98.2%),与CD133阳性细胞样本总数10例(17.9%)和双阳性细胞的样本总数28例(50.0%)比较,差异有统计学意义(χ2=74.137,P<0.001)。
2.2.3 各组阳性细胞数比较 由全血有核细胞计数结果和显微镜下的阳性细胞计数结果换算得出每例样本中各类阳性细胞的总数量(公式:阳性细胞数=全血有核细胞计数×镜下观察到的细胞涂片上阳性细胞所占比率),结果显示AE1/AE3阳性细胞的个数两两比较,对照组与切肝前、后组阳性细胞数量存在统计学差异(P<0.05),CD133阳性细胞和双阳性细胞数量在各组间比较差异均无统计学意义(P>0.05)(表3)。
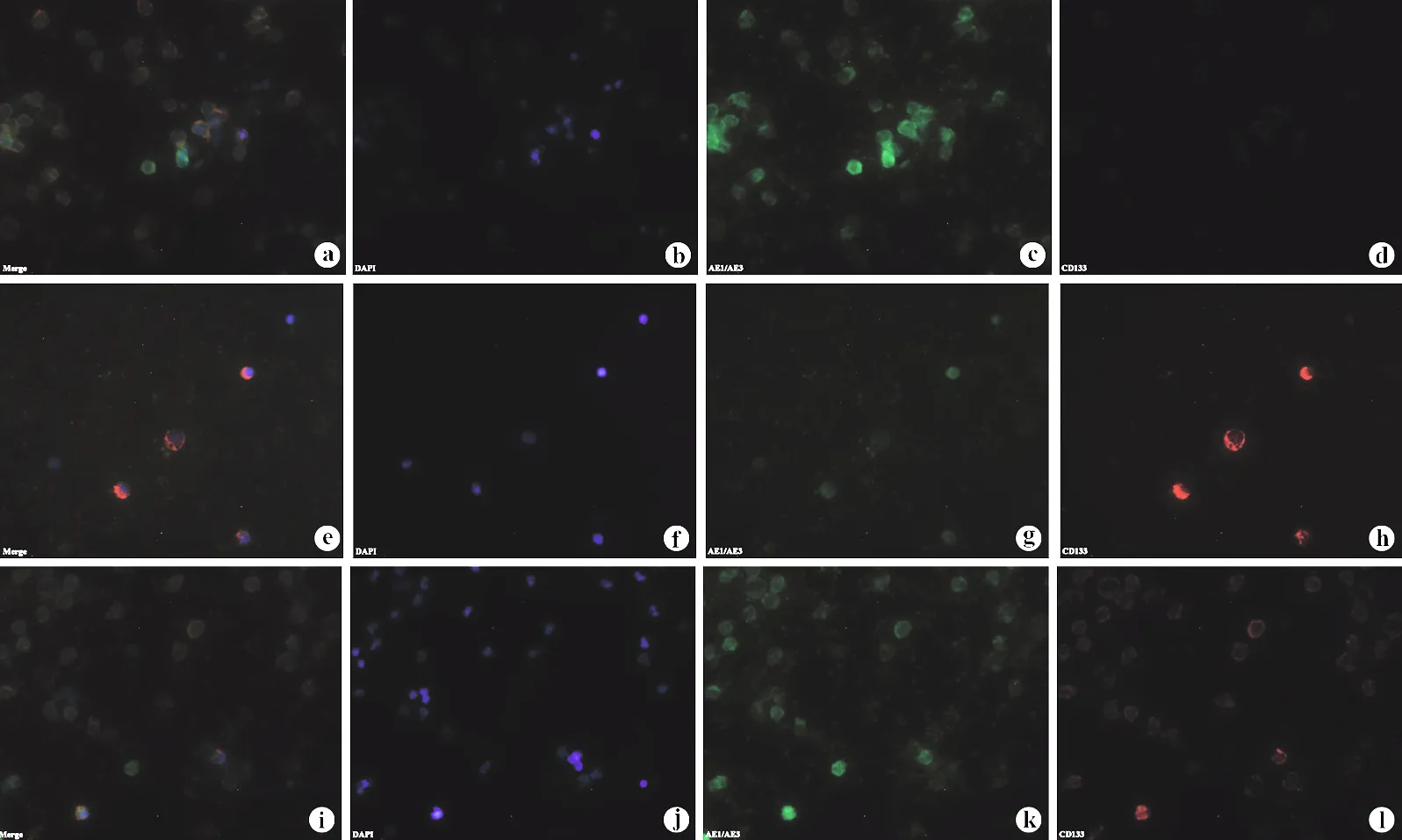
a、b、c、d:AE1/AE3+& CD133-;e、f、g、h:AE1/AE3-& CD133+;i、j、k、l:AE1/AE3+& CD133+
图1免疫荧光染色阳性细胞(10×40)

表2 各组样本存在各类阳性细胞的样本[例(%)]


分组AE1/AE3+CD133+双阳性切肝前0.014±0.0110.007±0.0190.002±0.004切肝后0.007±0.0070.007±0.0200.004±0.011对照组0.024±0.022*0.003±0.0110.009±0.029
*:与切肝前、切肝后比较,P<0.05
2.3 各组细胞培养克隆生成率比较
细胞培养过程中,各组样本均发现有克隆株生成(图2)。比较各组的克隆生成率并无统计学差异(χ2=0.634,P>0.05)。培养后免疫荧光染色结果提示,各组均发现抗体阳性表达的单细胞,各组发现的阳性细胞染色亮度、形态无明显差别(图3)。

图2 各组样本细胞培养克隆生成率

a、b、c、d、e:切肝前;f、g、h、i、j:切肝后;k、l、m、n、o:对照组
3 讨论
肝脏是人体内最大的实体器官,门静脉、肝动脉血液流经肝脏经肝血窦-肝静脉汇入下腔静脉,进入体循环。肝脏组织丰富的血运也往往造成肝癌组织体积较大、切除困难,手术操作对肿瘤组织机械刺激较多。不排除有肿瘤细胞因受手术操作的机械挤压而随肝脏血流进入体循环,造成肝癌的术后血行性转移复发的可能。本研究结果提示,肝癌患者切肝后白细胞数和总的有核细胞数均明显高于切肝前,手术操作对肝癌患者的白细胞数和有核细胞总数造成一定影响,可能是由于机体对手术所产生应激反应的结果。
既往大量研究已经证实,在恶性肿瘤患者循环血中存在具有增殖特性的肿瘤细胞[3-7]。Riethdorf等[7]通过一种用于富集和计数的实验系统即CellSearch system检测了92名患有转移性乳腺癌的患者的外周血,在这些样本中,发现循环血肿瘤细胞最高达1 920个/7.5 mL。同时,Cristofanilli等[5]的研究还证实,循环肿瘤细胞数量与肿瘤患者预后有关,当每7.5 mL循环血液中含有的肿瘤细胞大于5时,患者的总体生存率要显著小于每7.5 mL循环血液含有小于5个肿瘤细胞的患者。肿瘤细胞具有自我复制、更新以及分化的能力[8-9],与干细胞特性类似,也有人称肿瘤细胞的这种特性为无法控制的自我复制和更新能力[10]。干细胞标记物CD133已经被证实与多种肿瘤的形成相关,如大脑肿瘤、膀胱癌、结肠癌、胶质母细胞瘤等[7,11-12]。我国学者Yin等[13]证实CD133阳性的肝细胞性癌癌细胞具有更高的成瘤活性。肝癌属于上皮来源的肿瘤,表达上皮细胞相关抗体,即角蛋白抗体[14]。Pantel等[15]的综述中提到角蛋白抗体CK阳性的肿瘤细胞更易表达多种特异性癌基因,并且比CK阴性的肿瘤细胞更易发生远处转移。AE1/AE3的生物效能相当于CK1-CK7、CK10、CK14-CK16、CK19,并且在大鼠、小鼠、人、灵长类动物等多种生物体内的上皮细胞中表达[16-17]。因此,本研究选取CD133和AE1/AE3标记肿瘤细胞。AE1/AE3和CD133均为阳性的双阳性细胞表示该细胞为来源于上皮细胞的干细胞,具有明显的肿瘤干细胞特性,因此,我们把这类细胞归为高危细胞。只单独表达AE1/AE3或CD133的细胞为无分化增殖能力的肝癌细胞、正常上皮类细胞或者正常组织的干细胞,因此,这两类细胞成为相对安全细胞。
本研究免疫荧光法检测结果提示,在肝癌患者循环血中发现有AE1/AE3和CD133均表达的双阳性细胞,说明在肝癌患者血液中存在有循环肿瘤细胞(CTCs,circulating tumor cells);同时细胞培养结果提示肝癌患者无论是切肝前循环血还是切肝后循环血,均培养有克隆株形成。说明肝癌患者血液中存在的CTCs具有自我复制增殖的能力,这可能是肝癌患者术后仍有高复发率的原因。比较各类阳性细胞在2组样本中的数目发现,肝癌患者切肝前后并无差别,并且CD133阳性及双阳性的细胞数目在所有实验组间比较均无统计学差别;细胞培养结果也提示,肝癌患者术中切肝后血液培养并不比切肝后血液培养更易形成克隆株,并且形成克隆株的样本病例的肿瘤来源、肿瘤病理类型及分化程度在两组间也无明显区别。这说明手术操作并不影响肝癌患者循环血AE1/AE3阳性、CD133阳性及双阳性细胞的数量。也就证明肝癌切除手术并不会对肝癌患者血液中的CTCs造成影响,手术操作本身不会增加肝癌术后转移复发的概率。免疫荧光法检测结果也发现,存在AE1/AE3阳性细胞的样本总例数多于存在CD133阳性细胞和双阳性细胞的样本总例数,说明健康人血液中即存在有大量的上皮类细胞。健康志愿者循环血中的AE1/AE3阳性细胞数量多于肝癌患者术中切肝后的循环血AE1/AE3阳性细胞数量。因此,本研究推测,肿瘤可能会影响血液中正常上皮细胞的数量,导致其数量减少。
对于健康人群循环血中的肿瘤细胞,本研究的结果与既往研究并不一致。Allard等[3]的研究证实循环血肿瘤细胞仅存在于恶性肿瘤患者的循环血液中,而不存在于非肿瘤患者及健康人循环血液中。而本研究的免疫荧光法检测结果则发现,健康人群循环血液中存在一定数量的AE1/AE3和CD133双阳性的细胞,细胞数量范围分别为0~6.5×107/mL、0~1.3×107/mL。细胞培养结果发现在这两组样本中均有克隆株生成,然而免疫荧光染色并未发现抗体表达强阳性的同源多核细胞克隆株,故推测这可能为成纤维类细胞分裂增殖所形成。因此,对于健康人群血液中的CTCs,还有待进一步的研究证实。
[参考文献]
[1] Chen ZM,Liu BQ,Boreham J,et al.Smoking and liver in China:Case-control comparison of 3,6000 liver cancer deaths vs 1,7000 cirrhosis deaths[J].International Journal of Cancer,2003,107(1):106-112.
[2] 曾永毅,张 翔,刘景丰,等.肝癌发生肺转移的危险因素分析[J].中华消化外科杂志,2013,12(9):668-671.
[3] Allard WJ,Matera J,Miller MC,et al.Tumor cells circulate in the peripheral blood of all major carcinomas but not in healthy subjects or patients with nonmalignant diseases[J].Clinic Cancer Research.2004,10(20):6897-6904.
[4] Nagrath S,Sequist LV,Maheswaran S,et al.Isolation of rare circulating tumour cells in cancer patients by microchip technology[J].Nature,2007,450(20):1235-1239.
[5] Cristofanilli M,Budd GT,Ellis MJ,Stopeck A,et al.Circulating tumor cells,disease progression,and survival in metastatic breast cancer[J].The New England Journal of Medicine,2004,351(8):781-791.
[6] Cohen SJ,Punt CJA,Iannotti N,et al.Relationship of circulating tumor cells to tumor response,progression-free survival,and overall survival in patients with metastatic colorectal cancer[J].Clinic Oncology,2008,26(19):3213-3221
[7] Riethdorf S,Fritsche H,Miller V,et al.Detection of circulating tumor cells in peripheral blood of patients with metastatic breast cancer:a validation study of the CellSearch system[J].Clinic Cancer Research.2007,13(3):920-928.
[8] Visvader JE,Lindeman GJ.Cancer stem cells in solid tumors:accumulating evidence and unresolved questions[J].Nature Reviews Cancer,2008,10(8):755-768.
[9] Sullivan JP,Minna JD,Shay JW.Evidence for self-renewing lung cancer stem cells and their implications in tumor intiation progression and targeted therapy[J].Cancer Metastasis Review,2010,29(1):61-72.
[10] Stephanie MA,Chan KW,Hu L,et al.Identification and characterization of tumorigenic liver cancer stem/progenitor cells[J].Gastroenterology,2007,132(7):2542-2556.
[11] Tabatabai G.Glioblastama Stem Cells[J].Cell and Tissue research.2011,343(3):459-465.
[12] Collins AT,Berry PA,Hyde C,et al.Prospective identification of tumorigenic prostate cancer stem cells[J].Cancer Research,2005,65(23):10946-10951.
[13] Yin SY,Li J,Hu C,et al.CD133 positive hepatocellular carcinoma cells possess high capacity for tumorigenicity[J].International Journal of Cancer,2007,120(7):1444-1450.
[14] Karantza V.Katatins in Health and Cancer:More than Mere Epithelial Cell Markers[J].Oncogene,2010,30(2):127-138.
[15] Pantel K,Cote RJ,Fodstad Y.Detection and clinical importance of micrometastatic disease[J].Journal of the National Cancer Institute,1999,91(13):1113-1123.
[16] Woodman JR,Mansfield KJ,Lazzaro VA,et al.Immunoctochemical characterisation of cultures of human bladder mucosal cells[J].BMC Urology,2011,11(5):1471-1480.
[17] Rasweiler JJ,Badwaik NK,Salame G,et al.Endothelial cell hyperroliferation ans stratification in uteropalcental blood vessels of the black mastiff bat,molossus refus[J].Placenta,2011,32(9):633-644.

