坐骨神经损伤后雏菊叶龙胆的修复作用实验研究
,,,,,
(1.内蒙古包钢第三职工医院外二科,内蒙古 包头 014010;2.内蒙古包头医学院人体解剖学教研室,内蒙古 包头 014060)
坐骨神经损伤临床比较多见,发病率高、症状明显、危害较大[1]。因此,坐骨神经损伤后如何能有效促进损伤神经功能再生,提高修复治疗效果,一直是临床和基础的关注焦点,也是一个迄今没有完全解决的难题。中药治疗有着整体和局部双重兼顾的优势,其过程也符合神经损伤修复的综合过程[2],是非常具有发展前景的治疗方式。睫状神经营养因子(ciliary neurotrophic factor,CNTF)能促进多种运动神经元的存活,具有多种生物活性[3],在神经系统发育、分化和神经损伤修复过程中具有重要意义[4]。雏菊叶龙胆(Bellidifolin)为龙胆科1年生植物,全草入蒙药,蒙古族医学上作为“桑地格”使用,有清热解毒的功效。近些年发现,该药对脑出血、脑血栓等脑血管疾病也有很好的疗效[5-6]。尽管许多研究都报道其对中枢神经系统功能恢复有一定的促进作用,但对周围神经功能恢复方面的研究尚处于起步阶段,国内外的报道并不多见。因此,我们以大鼠坐骨神经损伤模型来进行观察,探讨雏菊叶龙胆是否对神经损伤有促进功能修复的作用,并探讨其作用机制中是否有局部释放睫状神经营养因子的机制参与。
1 材料与方法
1.1 实验动物及材料
取2月龄清洁成年雄性Wistar大鼠,体质量250~300 g,共225只。动物及饲料均购于内蒙古大学动物实验中心(SCXK(蒙)2002-0001),实施手术前先进行适应性饲养3~5 d。雏菊叶龙胆由包头医学院药学院提供,用生理盐水配成25 mg/kg、50 mg/kg、75 mg/kg不同浓度的药液,置于4 ℃条件下保存备用。甲钴胺片购于北京星吴医药有限公司,每片0.5 mg,用生理盐水配制成100 μg/kg的溶液。
1.2 实验方法
1.2.1 坐骨神经损伤模型的制备 10%水合氯醛进行腹腔注射麻醉(3 mL/kg),仰卧固定、脱毛、消毒,无菌条件下右下肢股后纵切口约1.5 cm,分离骨骼肌,充分显露并游离坐骨神经,于梨状肌下缘0.8 cm处离断,缝合神经外膜并做标记,逐层关闭切口。所有操作均由1人完成。术后观察动物清醒后,分笼饲养,勤换垫料以防止足底溃疡发生。
1.2.2 实验动物分组 将造模成功的大鼠以每组45只随机数字表法分为5组。实验组以25 mg/kg、50 mg/kg、75 mg/kg的剂量分别腹腔注射雏菊叶龙胆,连续5周,每天1次。甲钴胺组注射100 mg/kg甲钴胺,该药广泛应用于周围神经病的临床治疗;对照组给予同样剂量生理盐水。各组又都以右侧为损伤侧,左侧为健康对照进行对比。
1.2.3 检验指标及方法 于第1周、3周、5周时重新麻醉动物,将原来的切口切开,暴露出坐骨神经吻合口处。采用BL-420 F电生理仪检测记录神经平均传导速度(motor nerve conduction velocities,MNCV)。取手术侧腓肠肌,用4%多聚甲醛溶液进行固定,脱水、石蜡包埋、切片及HE染色。利用Imagin-J图像软件放大1 000倍下进行测量计算肌细胞截面积,求其平均值。术后3周时,取切口吻合处远端坐骨神经组织5 mm,正常侧也取相应节段的神经组织,用4%多聚甲醛PBS液进行固定,脱水、透明、石蜡包埋、切片及烤片,按照购买的免疫组化试剂盒说明方法,对切片的CNTF蛋白进行检测,摄取图像。每组随机取15张切片,显微镜下图像分析软件测定阳性细胞面积与总面积比值,分析计算每组细胞的阳性比率。
1.3 数据统计及分析
2 结果
2.1 各组神经传导速度测定值
第1、3、5周检测记录神经平均传导速度结果见表1。各组大鼠的坐骨神经平均传导速度检测中,生理盐水组在1、3、5各周都较低,而甲钴胺组传导速度值较高,与生理盐水组、雏菊叶龙胆25 mg组相比,差异有明显的统计学意义(P=0.019)。但在各时间点雏菊叶龙胆25 mg组与生理盐水组相比,差异不明显,还不能说明这二者之间有统计学差异(P=0.17)。而雏菊叶龙胆50 mg组与75 mg组相比,差异也没有明显统计学意义。而这2组与甲钴胺组相比,差异有统计学意义(P=0.035)。

表1 各时间段坐骨神经平均传导速度
*:与生理盐水组和雏菊叶龙胆25 mg组比较,P<0.01;#:与生理盐水组、甲钴胺组和雏菊叶龙胆25 mg组比较,P<0.05
2.2 腓肠肌肌细胞截面积测量结果
利用Imagin-J图像分析系统对各组大鼠不同时间的腓肠肌HE染色切片(图1)中肌细胞截面积进行测定,结果见表2。术后3周可见甲钴胺组、雏菊叶龙胆50 mg组与75 mg组细胞截面积较大。细胞排列整齐,紧密。生理盐水组可见细胞排列紊乱,细胞间隙增加。其中甲钴胺组、雏菊叶龙胆50 mg组、75 mg组与其他组比较,差异具有统计学意义(P=0.016),而这3组之间无显著性差异。
表2 各组不同时间腓肠肌细胞截面积
*:与其他组比较,P<0.05
2.3 免疫组化检测CNTF结果
各组分别于第3周行免疫组织化学方法检测坐骨神经中CNTF,检测结果中阳性细胞占细胞总面积的比例结果见图2。由图中可见生理盐水组与雏菊叶龙胆25 mg组比较,2者之间没有显著统计学差异,这2组与甲钴胺组、雏菊叶龙胆50 mg组、75 mg组比较,差异有统计学意义(P=0.033),而在甲钴胺组与雏菊叶龙胆50 mg组、75 mg组之间相比,差异没有统计学意义(P=0.065)。
3 讨论
平均传导速度作为电生理的一项指标,其值大小与纤维直径、髓鞘厚度及成熟程度有关[7]。神经胶质细胞包绕轴突形成髓鞘和神经膜,在神经纤维的再生修复中起诱导营养及促进轴突生长和成熟的作用[8]。坐骨神经损伤后,肌细胞直径及其截面积随失神经支配时间的延长呈进行性下降,是肌肉萎缩的可靠形态学指标。本实验中雏菊叶龙胆各剂量组与甲钴胺组相比,甲钴胺对改善坐骨神经离断缝合术后功能恢复方面作用相对要优于雏菊叶龙胆25 mg组,可能因为临床应用雏菊叶龙胆也是组入方剂,单独用药效果不如联合其他中、蒙药使用效果好。提示本实验室进一步的研究可以在蒙药的组合作用方面进行深入研究。
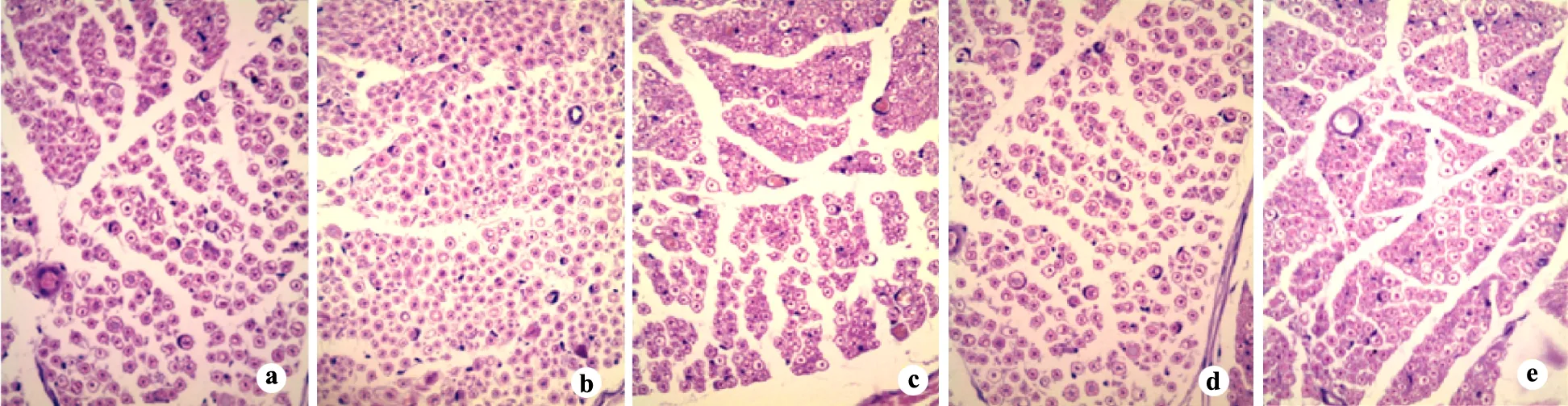
a:生理盐水对照组;b:甲钴胺组;c:雏菊叶龙胆25 mg组;d:雏菊叶龙胆50 mg组;e:雏菊叶龙胆75 mg组
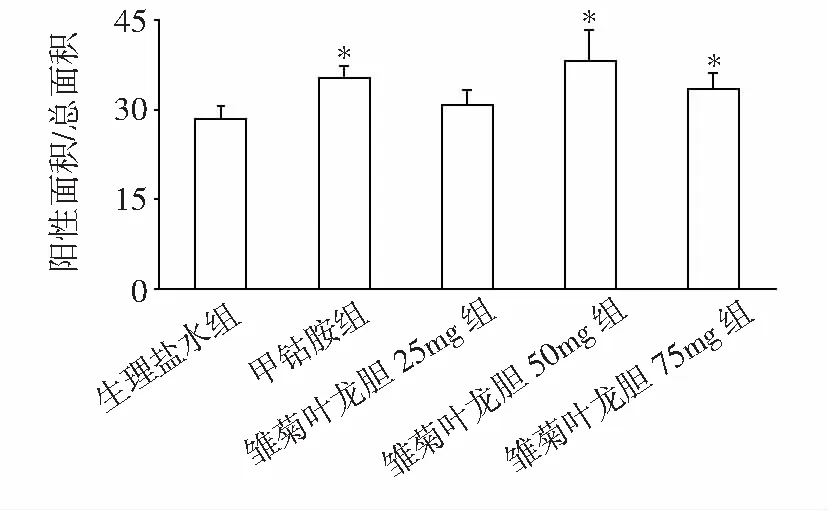
*:与生理盐水组和雏菊叶龙胆25 mg组比较,P<0.05
雏菊叶龙胆25 mg组的效果与其他2组相比,在提高实验动物神经传导速度和腓肠肌肌细胞截面积方面,效果相对差一些,结果有明显统计学差异。考虑该药物的作用也有一定的浓度范围[9-11],低于此浓度则药物不能发挥作用,与注射生理盐水的作用无显著统计学差异。50 mg与75 mg剂量组相比,更大剂量可见效果与50 mg组作用相当,还不能说明剂量增加后作用更强,2者相比没有明显统计学差异。可能是因为药物本身选择的浓度范围比较大,进一步可适当用不同剂量细分,深入探索药物的量效关系,为临床有效用药积累实验资料。通过本实验的研究发现,雏菊叶龙胆50 mg、75 mg组在促进神经功能恢复的过程中,神经远端的CNTF含量增高,提示在雏菊叶龙胆促进神经生长的过程中有CNTF局部释放增加的过程,为进一步研究其作用机理奠定了基础。
[参考文献]
[1] 郑玉涛,叶维健.诊疗坐骨神经损伤的局部解剖学基础及临床分析[J].局解手术学杂志,2008,17(5):322-324.
[2] Toth CC,Willis D,Twiss JL,et al.Locally synthesized calcitonin gene-related Peptide has a critical role in peripheral nerve regeneration[J].Neuropathol Exp Neurol,2009,68(3):326-337.
[3] McDonald JR,Ko C,Misner D,et al.Expression and characterization of recombinant human ciliary neurotrophic factor from E.Coli [J].Blochem Biophys Acta,1991,1090(1):70.
[4] Lindsay RM,Weigand SJ,Altar CA,et al.Neurotrophic fators:from molecule to man[J].Trends Neurosci,1994,17(5):182-190.
[5] 张剑辉,宋慧君,李淑媛,等.雏菊叶龙胆酮对局灶性脑缺血性操作的保护作用及机制探讨[J].中国药理学通报,2005,21(2):220-224.
[6] 宋慧君,张建辉,闫 平,等.雏菊叶龙胆酮对缺血性脑损伤保护作用的实验研究[J].大连医科大学学报,2007,29(2):110-112.
[7] 周 鹏,董乐乐,杨占君,等.人参皂甙Rg1促大鼠坐骨神经再生的初步研究[J].内蒙古医学杂志,2011,43(4):413-415.
[8] 陈 惠,向唯聂,杨耀防,等.微囊化兔坐骨神经组织细胞移植对脊髓损伤后大鼠GDNF表达的影响[J].局解手术学杂志,2011, 20(6):602-605.
[9] Kim BS,Choy WS,Chung MS,et al.Modified end-to-side neurorrhaphy enhances axonal sprouting:a motor functional and morpho-logical study[J].Orthopedics,2007,30(10):853-858.
[10] Song C,Oswald T,Yan H,et al.Repair of partial nerve injury by bypass nerve grafting with end-to-side neurorrhaphy[J].Reconstr Microsurg,2009,25(8):507-515.
[11] Yu WR,Liu T,Fehlings TK,et al.Involvement of mitochondrial signaling pathways in the mechanism of Fas-mediated apoptosis after spinal cord injury[J].Eur Neurosci,2009,29(1):114-131.

