乙烯利及水杨酸对醉马草幼苗生长及生物碱含量的影响
王 萍,张兴旭,赵晓静,李春杰
(草地农业生态系统国家重点实验室 兰州大学草地农业科技学院,甘肃 兰州 730020)
乙烯利及水杨酸对醉马草幼苗生长及生物碱含量的影响
王 萍,张兴旭,赵晓静,李春杰
(草地农业生态系统国家重点实验室 兰州大学草地农业科技学院,甘肃 兰州 730020)
本研究主要通过对醉马草(Achnatheruminebrians)幼苗进行水杨酸(Salicylic acid,SA)和乙烯利(Ethephon)处理,测定了醉马草幼苗的形态指标及其生物碱含量,探讨了醉马草幼苗在以上两种处理条件下麦角类生物碱含量的变化情况。结果表明,在Ethephon和SA处理下,与对照相比,醉马草幼苗的生物量、株高有所增加,但无显著差异(P>0.05),而带菌醉马草幼苗麦角酰胺和麦角新碱的含量显著增加(P<0.05)。
麦角酰胺;麦角新碱;外源激素;醉马草
禾草-内生真菌是指生长在植株体内并完成全部或大部分生活周期,而禾草不显示其外部症状的一大类真菌[1-3]。醉马草(Achnatheruminebrians)为禾本科芨芨草属的多年生草本植物,对马、牛、羊等家畜有毒,广泛分布在我国甘肃、新疆、内蒙古、青海、西藏等省(区)的天然草原[4],其内生真菌的带菌率近100%[5]。李春杰等将甘肃醉马草地上部分分离得到的内生真菌命名为甘肃内生真菌(NeotyphodiumgansuenseLi et Nan)[6-7],并明确了不同地理种群中醉马草的带菌状况、内生真菌的分类地位以及共生体的生态分布情况[6],提出了内生真菌检测、分离方法[6-7]。内生真菌侵染可提高醉马草的抗旱性[8-9]、抗寒性[10]、抗虫性[11-12]、耐盐碱能力[9,13]和耐重金属胁迫能力[14-15]。但带有内生真菌(E+)的醉马草草粉对家兔(Oryctolaguscuniculus)[6,16]和短尾寒羊(Ovisaries)[17-18]具有明显的致毒作用,而不带内生真菌(E-)的草粉对供试动物无不良影响,初步明确了内生真菌与宿主互作产生的生物碱是醉马草的致毒机理[16]。
在采自甘肃[19]和新疆[20]的带有内生真菌的醉马草中发现了大量的麦角酰胺和麦角新碱,而不带有内生真菌的醉马草中未检测到麦角酰胺和麦角新碱。醉马草-内生真菌共生体的种子、幼苗及成株的不同部位均含有麦角酰胺和麦角新碱[6,17],其含量水平与刈割高度、频度及植物生育期有关[21],并且施加外源磷肥和氮肥[22]及干旱和盐胁迫[23]均可促进醉马草-内生真菌共生体中麦角类生物碱的积累。
施用外源激素可影响供试植物的种子萌发和生理生化变化,喷施乙烯利(Ethephon)可以降低草地早熟禾(Poapratensis)幼苗的植株高度[24];低浓度的水杨酸(Salicylic acid, SA)可促进水稻(Oryzasativa)种子萌发[25];外源激素水杨酸预处理能减轻盐胁迫对燕麦(Avenanude)造成的伤害,使得超氧化物歧化酶和过氧化氢酶的活性增加[26]。有关外源激素的调节对禾草-内生真菌共生体种子萌发,幼苗生长和生理生化指标的影响还未见报道。本研究以醉马草-内生真菌共生体为供试对象,通过高效液相色谱检测其在水杨酸和乙烯利胁迫处理条件下麦角生物碱的含量变化,以期明确醉马草-内生真菌共生体幼苗生长和生物碱积累对外源激素诱导的响应。
1 材料与方法
1.1试验材料
试验所用的醉马草种子于2012年10月采自兰州大学榆中校区温室(103°36′52″ E, 36°28′42″ N)种植的内生真菌侵染的醉马草植株。挑选籽粒饱满、表面健康的醉马草种子于2012年11月播种于装有300 g混合培养基质的(蛭石∶珍珠岩=3∶1)聚乙烯花盆(口径15 cm,底径10 cm,深12 cm)中,在温室条件下[光周期12 h光照,温度(20±1)℃,光照强度120 μmol·m-2·s-1]培养幼苗。
1.2试验方法
1.2.1对带菌醉马草幼苗进行Ethephon和SA处理分别配制5、10和20 mg·L-1的Ethephon及50、100和200 mg·L-1的SA。待醉马草幼苗生长破土2 cm时,将不同浓度的Ethephon和SA试剂喷施在醉马草幼苗上,直至整个植株湿润(Ethephon和SA用无水乙醇溶解后再用蒸馏水稀释,乙醇终浓度为1%)。对照处理喷施1%乙醇溶液。每个处理3次重复,每周浇灌Hogland营养液和蒸馏水各一次,每次浇灌量为300 mL,处理0、7、14、21 d后分别取带菌醉马草幼苗检测其麦角生物碱含量。处理21 d后,分别测定带菌醉马草幼苗在不同质量浓度的Ethephon处理下的株高、分蘖数和地上生物量和在不同质量浓度的SA处理下的株高、分蘖数和地上生物量。
1.2.2带菌醉马草幼苗麦角生物碱的提取及其含量的测定 将待测植物样品在-20 ℃的冰箱冰冻5 h,并在-60 ℃下干燥24 h后,粉碎。称取50 mg样品装于离心管中;加入1 mL提取液(CHCl3∶MeOH∶NH4OH=75∶25∶2)。在1 000 r·min-1下15 ℃离心5 min,挥发干燥。离心管中加入0.75 mL的MeOH∶CCl4=1∶2和0.25 mL的25 mmol·L-1酒石酸,混匀,在12 000 r·min-1下21 ℃离心5 min,吸取上清液经0.45 μm孔径的过滤垫过滤,加入1.5 mL色谱瓶。每个样品3次重复。用Agilent 1100 series高效液相色谱系统,ZORBAX-XDB C18色谱柱,流动相流速1 mL·min-1,进样量20 μL,以VWD紫外检测进行检测。流动相A为0.1 mol·L-1NH4OAc,B为乙腈∶0.1 mol·L-1NH4OAc=3∶1。按照95%A液3 min,70%A液22 min,65%A液5 min,95%A液10 min流动相配比与时间,检测波长312 nm。根据相关方程和样品稀释倍数,计算两种麦角生物碱的浓度[23]。
1.2.3数据处理 所有数据均用Microsoft Excel录入,并作图。采用SPSS 16.0 for windows统计分析软件进行差异显著性分析,用Duncan法进行多重比较。
2 结果与分析
2.1外源激素对带菌醉马草幼苗形态指标的影响
2.1.1外源激素对带菌醉马草幼苗地上生物量的影响 与CK相比,随着Ethephon和SA质量浓度的增加带菌醉马草地上生物量呈不同的变化趋势(表1)。Ethephon处理下的醉马草生物量随Ethephon质量浓度的增大而增大,SA处理下的醉马草生物量随SA浓度的增大先增加后下降。10和20 mg·L-1Ethephon处理下带菌醉马草地上部生物量均显著(P<0.05)高于50和200 mg·L-1SA处理下的醉马草地上部生物量,其他各处理均与CK没有显著差异(P>0.05)。
2.1.2外源激素对带菌醉马草幼苗株高和分蘖的影响 与CK相比,随着Ethephon浓度的增大,带菌醉马草幼苗的株高呈现逐渐上升的趋势,而带菌醉马草幼苗的分蘖没有显著(P>0.05)变化。10和20 mg·L-1Ethephon及100 mg·L-1SA处理下带菌醉马草幼苗的株高均显著(P<0.05)高于CK,分别比CK增加了13.8%、14.5%和17.3%;在SA处理下,100 mg·L-1下的醉马草株高显著(P<0.05)高于200 mg·L-1SA处理下的醉马草株高(表1)。
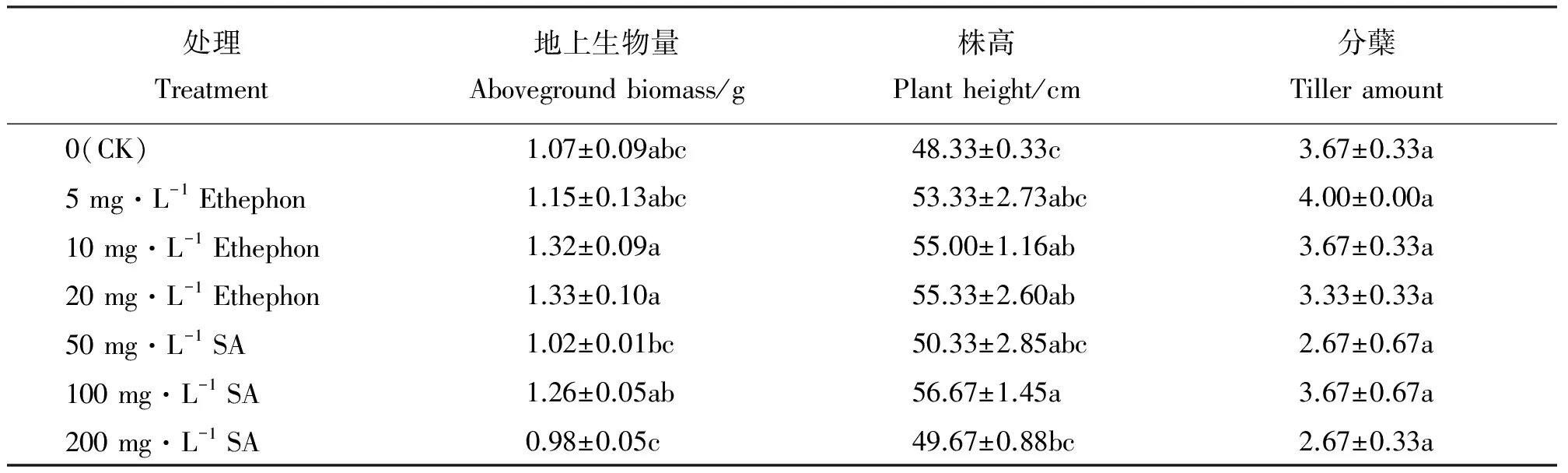
表1 外源激素对带菌醉马草幼苗的生物量、株高和分蘖的影响Table 1 Effects of exogenous hormone on the plant height, tillering amount and biomass of Achnatherum inebrians seedlings
注:表中数据为平均值±标准误(n=3),同列不同字母表示差异显著(P<0.05)。
Note: Data are present as mean±SE (n=3), different lower case letters within the same column mean significant difference at 0.05 level.
2.2Ethephon和SA处理对带菌醉马草幼苗麦角生物碱的影响
2.2.1不同浓度的Ethephon对带菌醉马草幼苗麦角生物碱的影响 用5、10、20 mg·L-1的Ethephon分别处理带菌醉马草幼苗(表2),处理21 d内,幼苗中麦角新碱和麦角酰胺含量随着Ethephon处理浓度的增加有明显先上升后降低的趋势。处理7 d时麦角新碱含量达到峰值,麦角酰胺除10 mg·L-1外也达到峰值,5和20 mg·L-1处理后的麦角酰胺和麦角新碱含量随着处理天数的延长呈降低趋势;处理14 d时,醉马草幼苗的麦角酰胺的含量显著高于CK(P<0.05);处理21 d时,只有10 mg·L-1的Ethephon处理下的麦角酰胺和麦角新碱含量显著(P<0.05)高于其他处理,麦角酰胺和麦角新碱含量分别是CK的2.1和2.5倍。
2.2.2不同浓度的SA对带菌醉马草幼苗麦角生物碱的影响 SA处理能够增加醉马草幼苗中麦角酰胺和麦角新碱的含量。不同浓度的SA作用效果有所差别,当SA质量浓度为50 mg·L-1时,不同处理天数下的麦角酰胺和麦角新碱含量均较CK有所提高;当SA为100 mg·L-1时,处理14 d后,麦角新碱的含量显著低于CK;当SA浓度为200 mg·L-1时,处理14 d后,带菌醉马草体内的麦角新碱含量较CK显著降低(表2)。
2.3不同处理天数对带菌醉马草幼苗麦角生物碱含量的影响
在处理7 d后,麦角酰胺含量在不同浓度的Ethephon处理下,均有不同程度的增加,在10 mg·L-1Ethephon处理下,麦角酰胺含量达到最大,约为CK处理下麦角酰胺含量的2倍;Ethephon和SA处理14 d后的麦角酰胺含量均显著低于处理7 d后的含量(P<0.05),而处理21 d后,麦角酰胺含量在10 mg·L-1Ethephon、50和100 mg·L-1SA处理下的麦角酰胺含量显著高于处理14 d后的含量(表2)。
在10 mg·L-1Ethephon处理下,处理7 d的麦角新碱的含量显著高于处理14和21 d后的含量,其他浓度Ethephon处理的麦角新碱含量随着处理天数增加无显著差异(P>0.05)。SA各个浓度处理下的麦角新碱的含量随着处理天数的增加无显著差异(表2)。

表2 不同浓度的乙烯利(Ethephon)及水杨酸(SA)对醉马草幼苗麦角生物碱的影响Table 2 Effects of ethephon and SA with different concentrations on alkaloid contents in Achnatherum inebrians seedlings
注:表中数据为平均值±标准误(n=3),同列中的不同字母表示差异显著(P<0.05),同行中不同大写字母表示差异显著(P<0.05)。
Note: Data are present as mean±SE (n=3), different lower case letters within the same column mean significant differences at 0.05 level, and different capital letters within the same row mean significant difference (P<0.05).
3 讨论与结论
本研究对外源激素处理条件下,醉马草-内生真菌共生体幼苗生长和生物碱含量的影响进行了研究,结果表明,施加外源激素对共生体幼苗的形态学指标(株高、分蘖和地上部生物量)和体内麦角类生物碱的积累均有明显的促进作用。
3.1Ethephon和SA处理对带菌醉马草幼苗株高、分蘖及地上生物量的影响
植物生长调节剂是通过调控植物体内源激素的含量或其出现的时间来调节和控制植物的生长发育及各项生理活动[27]。Ethephon可通过促进植物分枝生长,抑制植物节间生长[28];还可促进植物种子萌发、生根,与生长素效应相似[29-30]。SA是一种小分子酚类物质,可调节动植物许多生长发育过程。外施SA可促进小麦(Triticumaestivum)植物种子萌发和幼苗生长[31],SA浸种处理也会提高水稻(Oryzasativa)的发芽率[32]。不同浓度的多效唑和矮必施对多年生黑麦草(Loliumperenne)的株高和地上部生物量有一定的抑制作用,但对分蘖数有一定的促进作用[33]。本研究表明,喷施低浓度的植物生长调节剂(Ethephon和SA)可促进带菌醉马草幼苗的生长和生物量积累,喷施高浓度SA可抑制带菌醉马草幼苗的生物量积累。
3.2Ethephon和SA处理对带菌醉马草幼苗麦角生物碱的影响
有关醉马草-内生真菌共生体麦角生物碱的研究,张兴旭[34]通过系统分离,从带有内生真菌的醉马草地上部分分离得到了异麦角新碱及其同分异构体-麦角新碱的纯品化合物。醉马草-内生真菌共生体内的麦角酰胺和麦角新碱含量随着生育期的延长呈先增长后下降的趋势[6,17];麦角生物碱的含量与刈割频率和刈割高度有关,刈割频率和刈割高度均能影响共生体内生物碱的含量,但对产碱的影响依生物碱种类而不同[21],另外干旱胁迫和盐胁迫均能增加醉马草中麦角酰胺和麦角新碱的含量[23];醉马草中麦角生物碱的含量与种群生长的年均温度呈正相关,其中麦角新碱在醉马草茎秆中的含量与年均温度呈极显著正相关,同时对醉马草施加氮肥和磷肥均会使麦角新碱和麦角酰胺的含量有所上升[22,35]。
对赛莨菪(Scopoliaparviflora)外施SA可使其根部的莨菪碱含量发生变化,其原因可能是SA和其化学衍生物(Acetylsalicylic Acid,ASA)在植物组织中可提高次生代谢物的含量[36]。较高浓度的Ethephon对长春花(Catharanthusroseus)中生物碱含量有较大的促进作用,这可能是由于生物碱含量与其催化酶基因的表达量有关,而生物碱合成途径从上游基因表达到末端生物碱合成都受乙烯利影响[37]。本研究也发现,Ethephon和SA均会对醉马草-内生真菌共生体中的麦角酰胺和麦角新碱含量造成影响,在较低的浓度范围内(SA,0~50 mg·L-1;Ethephon,0~10 mg·L-1),醉马草幼苗的麦角酰胺和麦角新碱含量随着处理浓度的增高而相应的增加;在高浓度处理范围内(SA,100~200 mg·L-1;Ethephon,10~20 mg·L-1),醉马草麦角酰胺和麦角新碱含量随着处理浓度的增高而降低;高浓度的处理对植物的细胞组织产生毒害作用,抑制了次生代谢的正常进行。同时,生物碱的产生与植株体内菌丝含量密切相关[38],不同浓度的Ethephon和SA处理导致醉马草植株形态发生变化,从而引起醉马草内生真菌的菌丝含量不同,导致麦角酰胺和麦角新碱含量的差异,也有可能是不同浓度的Ethephon和SA影响了共生体中合成生物碱所需要的酶类和其他次级代谢物的合成而导致。
本研究在国内首次报道了乙烯利和水杨酸对醉马草-内生真菌共生体幼苗生长和生物碱含量的影响,结果表明,施加适当浓度的外源激素对共生体幼苗的生长和体内生物碱的积累均有促进作用,这对明确醉马草-内生真菌共生体幼苗生长和生物碱积累对外源激素诱导的响应具有一定意义。
[1]Hinton D M,Bacon C W.The distribution and ultrastructure of the endpophyte of toxic tall fescue[J].Canadian Journal of Botany,1985,63:36-42.
[2]Siegel M R,Latch G C M,Johnson M C.Fungal endophytes of grasses[J].Annual Review of phytopathology,1987,25:293-315.
[3]Bacon C W,Siegel M R.Endophyte parasitism of tall fescue[J].Journal of Production Agriculture,1988,1:45-55.
[4]任继周.西北草原上几种常见的毒草[J].甘肃农业大学学报,1959(1):9-16.
[5]Nan Z B,Li C J.Neotyphodium in native grasses in China and observations on endophyte/host interaction[A].Paul V H,Dapprich P D.Proceedings of the 4thInternationalNeotyphodium/Grass Interactions Symposium[C].Soest,Germany, 2000:41-50.
[6]李春杰.醉马草-内生真菌共生体生物学与生态学特性的研究[D].兰州:兰州大学,2005.
[7]Li C J,Nan Z B,Gao J H.Detection and distribution ofNeotyphodium-Achnatheruminebriansassociation in China[A].Proceedings of 5thInternationalNeotyphodium/Grass Interactions Symposium[C].Arkansas,USA,2004:24-27.
[8]李飞.内生真菌对醉马草抗旱性影响的研究[D].兰州:兰州大学,2007.
[9]Li C J,Nan Z B,Li F.Biological and physiological characteristics ofNeotyphodiumgansuensesymbiotic withAchnatheruminebrians[J].Microbiological Research,2008,163(4):431-440.
[10]陈娜.醉马草遗传多样性及内生真菌对其抗寒性的影响[D].兰州:兰州大学,2008.
[11]Zhang X X,Li C J,Nan Z B,Cory M.Neotyphodium endophyte increasesAchnatheruminebrians(drunken horse grass) resistance to herbivores and seed predators[J].Weed Research,2012,52(1):70-78.
[12]Li C J,Gao J H,Nan Z B.Interactions ofNeotyphodiumgansuense,Achnatheruminebriansand plant-pathogenic fungi[J].Mycological Research,2007,111(10):1220-1227.
[13]缑小媛.内生真菌对醉马草耐盐性影响的研究[D].兰州:兰州大学,2007.
[14]Zhang X X,Li C J,Nan Z B.Effects of cadmium stress on growth and anti-oxidative systems inAchnatheruminebrianssymbiotic withNeotyphodiumgansuense[J].Journal of Hazardous Materials,2010,175:703-709.
[15]Zhang X X,Fan X M,Li C J,Nan Z B.Effects of cadmium stress on seed germination,seedling growth and antioxidative enzymes inAchnatheruminebriansplants infected with aNeotyphodiumendophyte[J].Plant Growth Regulation,2010,60(2):91-97.
[16]李春杰,南志标,张昌吉,张崇岳,张燕慧.醉马草内生真菌对家兔的影响[J].中国农业科技导报,2009,11(2):84-90.
[17]Liang Y,Li C J,Nan Z B,Wang H C,Li F D.Neotyphodiumgansuensesymbiotic withinAchnatheruminebriansproduces clinical symptoms and physiological effects on small-tailed Han sheep[A].Proceedings of 8thInternational Symposium on Fungal Endophyte of Grasses[C].Lanzhou,China:Lanzhou University,2012:13-16.
[18]梁莹.醉马草内生真菌共生体对小尾寒羊的影响[D].兰州:兰州大学,2011.
[19]Li C J,Nan Z B,Christopher S.Levels and temporal variation of ergot alkaloids in endophyte-infected drunken horse grass,Achnatheruminebrians,in China[A].APS,CPS and MSA Joint Meeting Abstracts[C].Quebec,Canada,2006,203-204.
[20]Miles C O,Lane G,Menna M E.High levels of ergonovine and lysergic acid amide in toxicAchnatheruminebriansaccompany infection by anAcremoniumlike endophytic fungus[J].Journal of Agriculture and Food Chemistry,1996,44(5):1285-1290.
[21]Zhang X X,Li C J,Nan Z B.Effects of cutting frequency and height on alkaloid production in endophyte-infected drunken horse grass (Achnatheruminebrians)[J].Science China Life Science,2011,54(6):567-571.
[22]代乐英.醉马草内生真菌共生体麦角生物碱的研究[D].兰州:兰州大学,2007.
[23]Zhang X X,Li C J,Nan Z B.Effects of salt and drought stress on alkaloid production in endophyte-infected drunken horse grass (Achnatheruminebrians)[J].Biochemical Systematics and Ecology,2011,39:471-476.
[24]Diesburg K L,Christians N E.Seasonal application of ethphon,flurprimidol,melffuidide,paclobutrazol and amidochlor as they affected Kentucky bluegrass shoot morphogenesis[J].Crop Science,1989,29:841-847.
[25]向华,绕力群,肖立锋.水杨酸对水稻种子萌发及其生理生化的影响[J].湖农南业大学学报,2003,29(1):12-14.
[26]Xu Q,Xu X,Zhao Y,Jiao K,Herbert S J,Hao L.Salicylic acid,hydrogen peroxide and calcium-induced saline tolerance associated with endogenous hydrogen peroxide homeostasis in naked oat seedlings[J].Plant Growth Regulation,2008,54:249-259.
[27]韩德元.植物生长调节剂——原理与应用[M].北京:科学技术出版社,1997.
[28]Shatters R G,Wheeler R,West S H.Ethphon in duced changes in vegetative growth of “Tifton 85” bermudagrass[J].Crop Science,1998,38:97-103.
[29]Southwick K L,Lamb N,Storey R,Mansfield D H.Effect of ethephon and its decomposition products on germination of rice and watergrass[J].Crop Science,1986,26:761-767.
[30]Huang B R,Jahnson J W.Root characteristics and hormone activity of wheat in respone to hypoxio and ethylene[J].Crop Science,1997,37:812-818.
[31]Shakirova F M,Sakhabutdinova A R,Bczrukova M V.Changes in the hormonal status of wheat seedlings induced by salicylic acid and salinity[J].Plant Science,2003,164:317-322.
[32]杨玲,袁月星,谢双琴.次适温下水杨酸浸种对水稻种子萌发的效应[J].植物生理学通讯,2001,37(4):288-290.
[33]蔡新赟,邵秋雨,张新新,武瑞鑫.生长调节剂对坪用多年生黑麦草生长特性的影响[J]草业科学,2013,30(7):1014-1018.
[34]张兴旭.醉马草-内生真菌共生体对胁迫的响应及其次生代谢产物活性的研究[D].兰州:兰州大学,2012.
[35]代乐英,黄玺,李春杰,南志标.麦角生物碱在醉马草内生真菌共生体中的空间分布[J].草业学报,2010,19(6):215-221.
[36]Kang S M,Jung H Y,Kang Y M,Yun D J,Bahk J D,Yang J K,Choi M S.Effects of methyl jasmonate and salicylic acid on the production of tropane alkaloids and the expression of PMT and H6H in adventitions root cultures ofScopoliaparviflora[J].Plant Science,2004,166:745-751.
[37]常博文.外源乙烯对长春花生长及生物碱积累的影响[D].哈尔滨:东北林业大学,2012.
[38]姚青,王连润,陈美标,胡又厘,朱红惠,王燕.不同草种对土著AM真菌的生长和群落结构的影响[J].草业学报,2008,17(2):33-38.
(责任编辑 武艳培)
EffectsofethphonandsalicylicacidongrowthandergotalkaloidsconcentrationsofAchnatheruminebriansseedlings
WANG Ping, ZHANG Xing-xu, ZHAO Xiao-jing, LI Chun-jie
(Key Laboratory of Grassland Agro-ecosystems, College of Pastoral Agriculture Science and Technology, Lanzhou University, Lanzhou 730020, China)
Effects of ethephon and salicylic acid (SA) on growth and ergot alkaloids concentrations of drunken horse grass (Achnatheruminebrians) over a 3-week period were determined in controlled experiments in the greenhouse.The variations of the alkaloid contents with ethephon and SA treatment were measured.The results showed that plant heights and above-ground biomass ofA.inebriansincreased (P>0.05) compared with the control (CK) .However, the contents of ergine and ergonovine were higher than that of control (CK) treatment, especially for ethephon treatment which had significant effects (P<0.05).
ergine; ergonovine; exogenous hormone;Achnatheruminebrians
LI Chun-jie E-mail:chunjie@lzu.edu.cn
2014-03-21 接受日期:2014-06-25
国家973计划课题(2014CB138702);国家自然科学基金项目(31372366);中央高校基本科研业务费(lzujbky-2014-75);教育部创新团队发展计划项目(IRT13019)
王萍(1990-),女,宁夏吴忠人,在读硕士生,主要研究方向为禾草-内生真菌共生体。E-mail:pwang2008@lzu.cn
李春杰(1968-),男,甘肃镇原人,教授,博导,博士,主要研究方向为牧草与草坪草及种子病理学、禾草内生真菌及农业微生物学。E-mail:chunjie@lzu.edu.cn
S314;Q946.88
:A
:1001-0629(2014)11-2113-06
10.11829j.issn.1001-0629.2014-0121

