生物拆分制备(S)-α-乙基-2-氧-1-吡咯烷乙酸工艺研究
, , ,,2
(1.浙江工业大学 药学院,浙江 杭州 310014;2.浙江医药高等专科学校,浙江 宁波 315100)
左乙拉西坦(Levetiracetam,LEV),化学名(S)-α-乙基-2-氧-1-吡咯烷乙酰胺,是作用机制独特的新型抗癫痫类药物[1-2],目前主要通过化学法制备[3].随着LEV市场需求的增加,越来越多该药物的合成方法被报道[4-5].利用生物法制备手性药物及其手性中间体因具有立体选择性高,专一性强,反应条件温和,环境友好等特点而逐渐成为研究热点[6-8].以生物催化法合成LEV或LEV手性羧酸中间体可弥补化学法存在的不足,为研究者提供了新的思路[9].Tao等报道了通过半理性设计(semi-rational design)获得腈水合酶突变体,用于催化外消旋(R,S)-α-乙基-2-氧-1-吡咯烷乙腈不对称合成LEV,产率和ee值分别为43%和94%[10],但(R,S)-α-乙基-2-氧-1-吡咯烷乙腈的合成过程中需使用高毒性的2-氯丁腈作为原料.
耐酪氨酸冢村氏菌E105菌株系本课题组从土壤中筛选得到.该菌株可选择性催化(R,S)-α-乙基-2-氧-1-吡咯烷乙酸乙酯不对称水解制备(S)-α-乙基-2-氧-1-吡咯烷乙酸,该手性羧酸经酰胺化后即可制得LEV.笔者所在课题组前期研究中通过对培养基成分筛选和反应条件优化,在10 mL反应体系中实现了(R,S)-α-乙基-2-氧-1-吡咯烷乙酸乙酯的生物拆分,产率和ee值分别达45%和99%[11-12].为进一步提高该菌株的催化能力,有必要对其产酶培养条件进行优化,进而提高其应用潜力,进而为LEV的规模化制备提供依据.响应面法可通过对实验数据的拟合建模,分析评价多因素间的交互作用,并预测最优结果,是适合对多变量体系进行评价和优化的快捷有效方法,近年来已有一些通过响应面法对生物反应过程进行优化的报道[13-15].本研究通过单因素实验和响应面优化,得到E105细胞产胞内脂肪酶的最优条件,继而,利用其静息细胞催化(R,S)-α-乙基-2-氧-1-吡咯烷乙酸乙酯的生物拆分制备左乙拉西坦关键手性中间体(S)-α-乙基-2-氧-1-吡咯烷乙酸.
1 材料与方法
1.1 菌种与培养基
耐酪氨酸冢村氏菌E105,本课题组从土壤中筛选,并保藏.
种子培养基:葡萄糖10 g/L,蛋白胨5 g/L,酵母膏2 g/L,(NH4)2SO42 g/L,K2HPO42 g/L,KH2PO41 g/L,NaCl 0.5 g/L,MgSO4·7H2O 0.5 g/L,pH 7.0.
初始发酵培养基:葡萄糖15 g/L,NH4Cl 9.5 g/L,酵母膏12.1 g/L,K2HPO42 g/L,KH2PO41 g/L,NaCl 0.6 g/L,MgSO4·7H2O 0.5 g/L,pH 7.0.
1.2 分析方法与酶活力测定
生物拆分(R,S)-α-乙基-2-氧-1-吡咯烷乙酸乙酯的反应过程:

α-乙基-2-氧-1-吡咯烷乙酸产率及ee值参照本课题组报道的HPLC和GC法测定[11,16].
α-乙基-2-氧-1-吡咯烷乙酸产率为
产率=Cp/Cs×100%
式中:Cp表示产物α-乙基-2-氧-1-吡咯烷乙酸的浓度;Cs表示底物(R,S)-α-乙基-2-氧-1-吡咯烷乙酸乙酯的浓度.
(S)-α-乙基-2-氧-1-吡咯烷乙酸的光学纯度通过对映体过量值(enantiomeric excess,ee)表征为
t1为烟气在第1区域停留时间(s);t2为烟气在第2区域停留时间(s);t3为烟气在第3区域停留时间(s);t4为烟气在第4区域停留时间(s);v1为烟气在第1区域平均速度(m/s);v2为烟气在第2区域平均速度(m/s);v3为烟气在第3区域平均速度(m/s);v4为烟气在第4区域平均速度(m/s)。
ee=(AS-AR)/(AS+AR)×100%
式中:AS为S型产物峰面积;AR为R型产物峰面积.
酶活力定义:30 ℃下,每分钟生成1 μmol(S)-α-乙基-2-氧-1-吡咯烷乙酸所需的酶量定义为一个酶活力单位(U).
酶活力测定:称取0.3 g(DCW)菌体,重悬于10 mL磷酸钾缓冲液中,加入30 mmol/L的(R,S)-α-乙基-2-氧-1-吡咯烷乙酸乙酯,30 ℃,200 r/min反应1 h,9 000 r/min离心10 min,除去菌体以终止反应,取上清液检测(S)-α-乙基-2-氧-1-吡咯烷乙酸生成量,计算得到单位重量的菌体酶活力(U/g).
1.3 单因素实验设计
采用初始发酵培养基配方,考察不同装液量(150~350 mL/L),接种量(2%~6%)和培养时间(24~48 h)对菌体产酶的影响,确定E105菌株最佳的产酶培养条件.
1.4 响应面优化实验设计
运用Design Expert 8.0.6软件设计响应面优化实验方案,考察发酵培养基组成对产酶的影响.
1.4.1 Plackett-Burman(PB)实验
对初始发酵培养基中葡萄糖(A),酵母膏(B),氯化铵(C),磷酸二氢钾-磷酸氢二钾(D),pH(E),硫酸铵(F),氯化钠(G)7个因素和2个虚拟变量(H,I),进行N=12的9因素PB实验,筛选出对产酶影响显著的因素.
1.4.2 最陡爬坡实验
1.4.3 Box-Behnken(BB)实验
对由PB实验确定的显著因子和最陡爬坡实验确定的中心点,根据Box-Behnken中心组合原理,设计N=17的3因素3水平实验,其中5个为零点重复实验.
1.5 (R,S)-α-乙基-2-氧-1-吡咯烷乙酸乙酯的生物拆分
(R,S)-α-乙基-2-氧-1-吡咯烷乙酸乙酯的生物拆分反应在500 mL摇瓶中进行.将培养获得的E105菌体重悬于磷酸钾缓冲液中,摇瓶装液量为300 mL,菌体添加量为30 g/L(DCW),加入不同浓度的(R,S)-α-乙基-2-氧-1-吡咯烷乙酸乙酯(40~90 mmol/L),30 ℃,200 r/min反应32 h,以考察不同底物浓度对生物拆分的影响.通过测定产物(S)-α-乙基-2-氧-1-吡咯烷乙酸浓度、产率和ee值,确定拆分反应的最佳底物浓度,并考察在该底物浓度下的生物拆分过程曲线.
2 结果与讨论
2.1 培养条件单因素实验考察
分别考察了装液量,接种量和培养时间对菌体产酶的影响.如图1所示,当摇瓶装液量为300 mL/L,接种量为4%,培养时间为36 h时,酶活力分别达到最大值.当培养时间超过36 h后,菌体增长速度开始减缓,菌体生长进入稳定期.
2.2 Plackett-Burman实验
按照Design Expert 8.0.6软件的设计,对初始发酵培养基中7个因素(葡萄糖,酵母膏,氯化铵,磷酸二氢钾-磷酸氢二钾,pH,硫酸铵,氯化钠)和2个虚拟变量进行N=12的9因素PB实验(表1),以筛选出对产酶影响显著的因素.由表2可知:A,B,E三因素的P值均小于0.05,是影响菌体产酶的显著因子.因此,选取葡萄糖和酵母膏质量浓度,以及培养基初始pH值三因素进行后续实验.

图1 培养条件对产酶的影响

表1 Plackett-Burman实验设计和响应值

表2 Plackett-Burman实验因素、水平和结果分析
2.3 最陡爬坡实验
根据PB实验结果,对葡萄糖和酵母膏质量浓度,及培养基初始pH进行最陡爬坡实验,3因素的步长选择分别为2.5 g,3 g和0.5,并同步逐渐增大,寻找最优区域.表3结果表明:第3组实验的酶活力最高,为19.03 U/g,表明此时3个变量的取值已经接近最优点附近区域.因此,选择这一组数据作为中心点,进行后续的响应面优化.

表3 最陡爬坡实验设计及结果
2.4 Box-Behnken中心组合实验
如表4所示,以最陡爬坡实验确定的中心点,根据Box-Behnken中心组合原理,设计N=17的3因素3水平实验,其中5个为零点重复实验,并运用Design-Expert 8.0.6对所得数据进行回归分析,得到如下的拟合方程模型:
Y=19.1+0.45X1+0.64X2+0.95X3-0.28X1X2-
0.47X1X3-0.48X2X3-2.71X12-2.07X22-
0.68X32
表5对模型回归系数显著性的检验表明:该模型中每个因子对Y值的影响均高度显著,表明葡萄糖和酵母膏质量浓度与培养基初始pH值三者之间存在明显的交互作用.对该模型进行方差分析,模型P<0.000 1,失拟项P=0.201 6,R2=0.994 5,表明该模型高度显著,拟合度良好,能够用于预测.由图2可知:当pH取值为中心点7.0时,酶活力最大值出现在曲面的中央区域,表明葡萄糖和酵母膏的质量浓度过高或过低,都会影响菌体产酶;而当葡萄糖和酵母膏质量浓度分别位于中心点17.5 g/L和16.0 g/L时,适当提高培养基的初始pH值,有利于产酶.
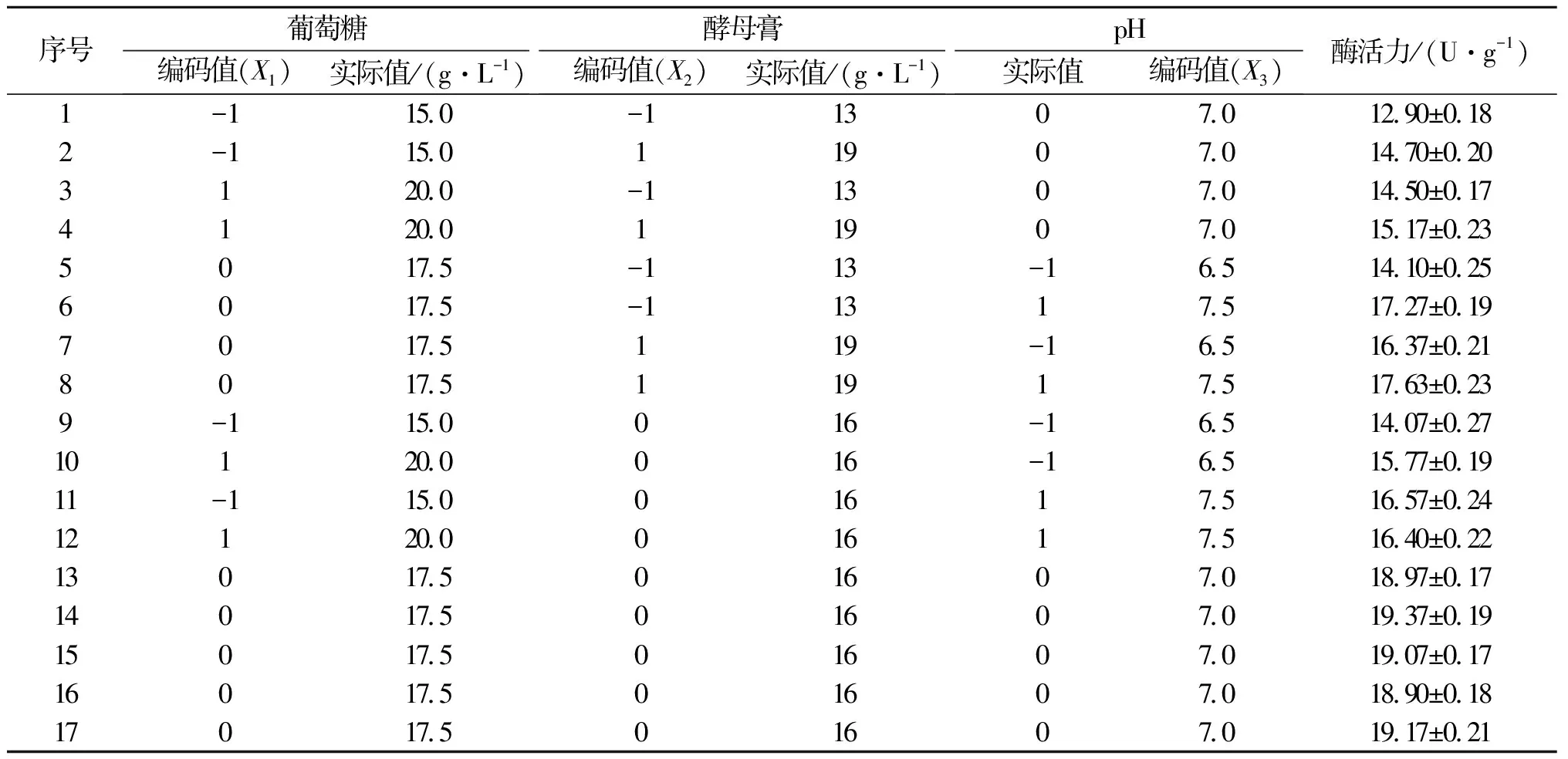
表4 中心组合实验设计及结果

表5 回归模型系数显著性检验
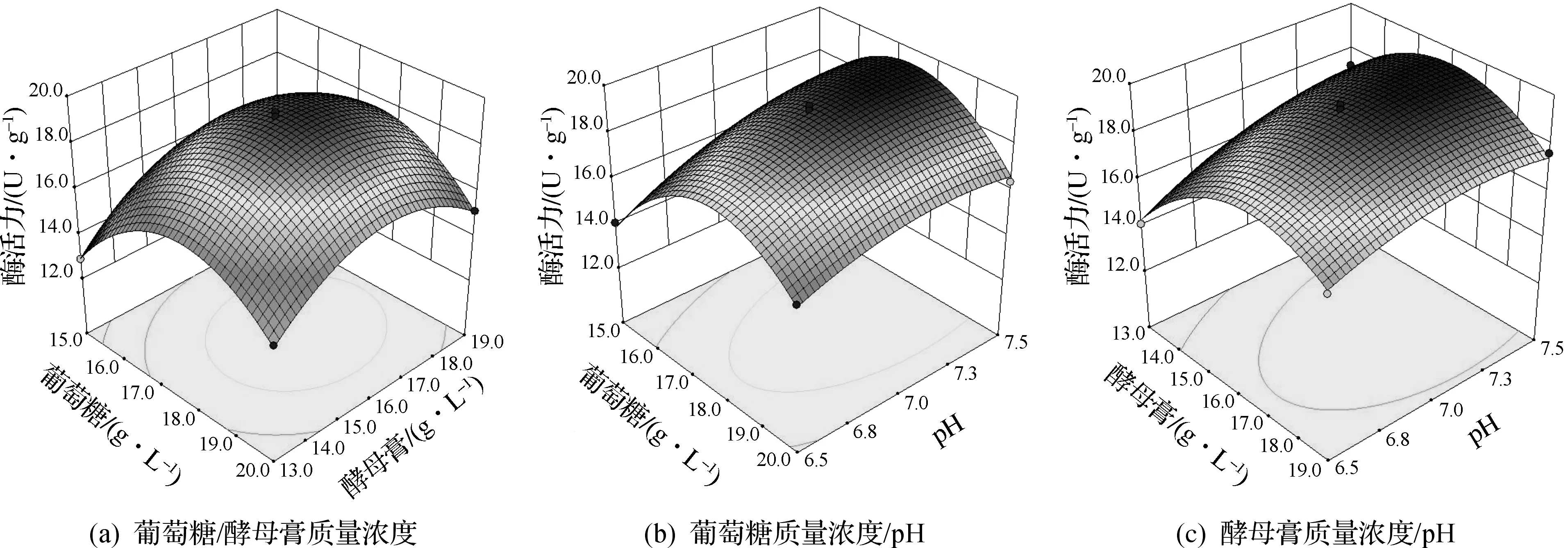
图2 各因素对菌体产酶的交互影响影响曲面图
2.5 最优条件的实验验证
根据拟合方程,可求得当Y为最大值19.41 U/g时,对应的X1,X2,X3编码值分别为0.079,0.177,0.642.转换为实际值可得到预测结果:葡萄糖17.70 g/L,酵母膏16.53 g/L,pH 7.32.经3次实验验证,实际酶活力为19.33 U/g,较优化前的14.58 U/g提高了32.6%,且实际值接近理论预测值,表明该模型可较好预测E105菌体的实际发酵情况.同时,在最优产酶条件下,E105菌体细胞干重为4.13 g/L,较优化前提高了60.1%.
2.6 (R,S)-α-乙基-2-氧-1-吡咯烷乙酸乙酯的生物拆分
底物浓度是影响生物拆分反应的重要因素之一.为考察经产酶条件优化后制备得到的E105细胞催化(R,S)-α-乙基-2-氧-1-吡咯烷乙酸乙酯不对称水解反应的最佳底物浓度,实验选取40~90 mmol/L的底物浓度进行生物拆分,反应介质为300 mL磷酸钾缓冲液,细胞加量为30 g/L(DCW),30 ℃,200 r/min反应32 h.由图3可知:当底物浓度为60 mmol/L时,(S)-α-乙基-2-氧-1-吡咯烷乙酸产率达48.5%,ee值为99%.继续提高反应的底物浓度,产率逐渐降低.与产酶条件优化前相比,E105细胞催化拆分的底物浓度可提高至60 mmol/L,较优化前提高了20%,且底物浓度的增加对ee值影响较小.

图3 底物浓度对E105细胞催化生物拆分反应的影响
底物浓度为60 mmol/L时的生物拆分反应过程曲线如图4所示.结果表明:反应24 h后,(S)-α-乙基-2-氧-1-吡咯烷乙酸产率和ee值分别达到48%和99%,最佳拆分反应时间以24 h为宜.

图4 耐酪氨酸冢村氏菌E105细胞生物拆分(R,S)-α-乙基-2-氧-1-吡咯烷乙酸乙酯的过程曲线
图5为产酶条件优化前后制备得到的E105细胞催化(R,S)-α-乙基-2-氧-1-吡咯烷乙酸乙酯生物拆分反应结果的比较.结果表明:在优化的产酶条件下制备得到的含酶细胞催化拆分24 h后,产物(S)-α-乙基-2-氧-1-吡咯烷乙酸生成量为8.64 mmol,终浓度达28.8 mmol/L,较优化前提高了32.1%.

图5 产酶条件优化前后制备得到的E105细胞催化生物拆分反应结果的比较
3 结 论
对耐酪氨酸冢村氏菌E105菌株产胞内脂肪酶的产酶条件进行了优化.基于响应面分析,建立了葡萄糖和酵母膏质量浓度,培养基初始pH值三因素对产酶影响的数学模型.经方差分析表明:该模型高度显著,拟合度良好.在优化的产酶条件下,E105菌体的酶活力为19.33 U/g,细胞干重达4.13 g/L,分别较优化前提高了32.6%和60.1%.将培养得到的E105静息细胞用于催化(R,S)-α-乙基-2-氧-1-吡咯烷乙酸乙酯的不对称水解,当底物浓度为60 mmol/L时,反应24 h,(S)-α-乙基-2-氧-1-吡咯烷乙酸生成量为8.64 mmol,产率和ee值分别为48%和99%,产物终浓度为28.8 mmol/L,较优化前提高了32.1%,有效提高了耐酪氨酸冢村氏菌E105催化生物拆分反应的效率,为后续研究奠定了较好的基础.
参考文献:
[1] SHORVON S D, RIJCKEVORSEL K V. A new antiepileptic drug[J]. Journal of Neurology Neurosurgery and Psychiatry,2002,72(4):426-429.
[2] BIALER M, WHITE H. Key factors in the discovery and development of new antiepileptic drugs[J]. Nature Reviews Drug Discovery,2010,9:68-82.
[3] BOSCHI F, CAMPS P. A synthesis of levetiracetam based on (S)-N-phenylpantolactam as a chiral auxiliary[J]. Tetrahedron: Asymmetry,2005,16:3739-3745.
[4] MUJAHID M, MUJUMDAR P. An alternate synthesis of enantiomerically pure levetiracetam[J]. Tetrahedron: Asymmetry,2012,23:1512-1515.
[5] 汪洪湖,韦亚锋,陈文婕.左乙拉西坦合成工艺优化研究[J].安徽医药,2011,15(6):681-683.
[6] PANDA T, GOWRISHANKAR B S. Production and applications of esterases[J]. Applied Microbiology and Biotechnology,2005,67:160-169.
[7] BORNSCHEUER U T. Microbial carboxyl esterase: classification, properties and application in biocatalyst[J]. FEMS Microbiology Review,2002,26:73-81.
[8] TIAN Xin, ZHENG Gao-wei, LI Chun-xiu, et al. Enantioselective production of (S)-1-phenyl-1,2-ethanediol from dicarboxyesters by recombinantBacillussubtilisesterase[J]. Journal of Molecular Catalysis B-Enzymatic,2011,73:80-84.
[9] 王井玲,欧阳启,钟成刚,等.新型抗癫痫药物左乙拉西坦制备技术研究进展[J].中国生化药物杂志,2012,33(4):504-508.
[10] TAO Jun-hua, XU Jian-he. Biocatalysis in development of green pharmaceutical processes[J]. Current Opinion in Chemical Biology,2009,13(1):43-50.
[11] HE Jun-yao, YUAN Shuai, WANG Pu.Tsukamurellasp. E105 as a new biocatalyst for highly enantioselective hydrolysis of ethyl 2-(2-oxopyrrolidin-1-yl) butyrate[J]. Journal of Industrial Microbiology & Biotechnology,2012,39:1261-1268.
[12] 袁帅,王普,何军邀.α-乙基-2-氧-1-吡咯烷乙酸乙酯水解酶产生菌发酵培养基的响应面优化[J].浙江工业大学学报,2011,39(5):536-540.
[13] 王普,孙立明,何军邀.响应面法优化热带假丝酵母104菌株产羰基还原酶发酵培养基[J].生物工程学报,2009,25(6):863-868.
[14] LI Yin, CUI Feng-jie, LIU Zhi-qiang, et al. Improvement of xylanase production byPenicilliumoxalicumZH-30 using response surface methodology[J]. Enzyme and Microbial Technology,2007,40:1381-1388.
[15] YIN Xiu-lian, YOU Qing-hong, JIANG Zhong-hai. Optimization of enzyme assisted extraction of polysaccharides fromTricholomamatsutakeby response surface methodology[J]. Carbohydrate Polymers,2011,86:1358-1364.
[16] 王普,袁帅,何军邀.柱前衍生化气相色谱法测定α-乙基-2-氧代-1-吡咯烷乙酸光学异构体[J].药物分析杂志,2010,30(10):1891-1894.

