原发性帕金森病患者皮肤活检术检测自噬功能研究
王雪晶 丁雪冰 马明明 殷竞争 滕军放(通讯作者)
1)郑州大学第一附属医院神经内科 郑州 450052 2)河南省高等学校临床医学重点学科开放实验室 郑州 450052 3)河南省人民医院神经内科 郑州 450003
原发性帕金森病患者皮肤活检术检测自噬功能研究
王雪晶1,2)丁雪冰1,2)马明明3)殷竞争1,2)滕军放1,2)(通讯作者)
1)郑州大学第一附属医院神经内科 郑州 450052 2)河南省高等学校临床医学重点学科开放实验室 郑州 450052 3)河南省人民医院神经内科 郑州 450003
目的 运用皮肤活检术分别从自噬以及分子伴侣介导的自噬两个方面评价原发性帕金森病(parkinson’s disease,PD)患者皮肤成纤维细胞的自噬水平的变化,初步探讨自噬在PD发病机制中的作用。方法 收集PD患者23例及正常对照20例皮肤标本,并对PD病人进行UPDRSⅡ、UPDRSⅢ、Hoehn & Yahr分级法量表评分,运用皮肤活检术收集PD组的皮肤标本。通过免疫组化法检测微管相关蛋白轻链3(microtubule associated protein 1 light chain3,LC3)、Beclin-1的表达,用蛋白质印迹法(Western blot)检测LC3Ⅱ/LC3Ⅰ的比值变化以及Beclin-1。结果 与正常对照组相比,PD患者皮肤成纤维细胞Beclin-1、LC3表达上调,差异有统计学意义(P<0.05),LC3Ⅱ/LC3Ⅰ比值升高,差异有统计学意义(P<0.05)。PD患者皮肤成纤维细胞巨自噬水平明显上调,自噬水平异常调控可能参与PD的发生、发展过程。结论 通过皮肤活检术检测PD患者皮肤自噬水平用于帕金森病的早期诊断具有一定的临床价值。
帕金森病;皮肤活检;自噬
帕金森病(Parkinson’s Disease,PD)是一种中老年人常见的神经退行性疾病,临床表现为随意运动减少、行动迟缓、静止性震颤以及姿势反射障碍。帕金森病的运动障碍主要归因于大脑中黑质纹状体多巴胺能神经元的进行性变性缺失[1]。PD因其高致残性、目前无法根治等特点,不仅严重影响患者的生活质量,同时给患者家庭及社会都造成了负面影响。目前,诊断主要依据为所表现的特征典型临床症状。PD起病隐袭,对于早期临床症状并不典型的病人,早期临床症状特异性并不强,且缺乏有效的早期的分子诊断标志物,早期诊断仍比较困难[2]。自噬(autophagy)是真核细胞所特有的一种重要的高度保守的防御和保护机制,是细胞亚细胞膜结构发生动态的形态改变,并通过细胞溶酶体介导自身的大分子物质或受损的细胞器的吞噬降解过程[3]。目前,有不少学者对自噬与PD等神经退行性疾病的关系进行研究,但多以动物模型、细胞培养以及尸解脑组织为研究对象,而在体中自噬功能的评估研究甚少[4]。
1 材料与方法
1.1 一般资料 选取2012-06—2014-03在郑州大学第一附属医院神经内科就诊的原发性PD患者23例,均符合2006年中华医学会神经病学分会运动障碍与帕金森病学组制订的帕金森病诊断标准,未合并其他神经系统疾病。男13例,女10例;年龄42~64岁,平均(54.0±6.7)岁;病程2~5 a,平均(3.2±1.8)a。正常对照组20例来自郑州大学第一附属医院外科手术病人,排除神经系统变性疾病以及其他慢性疾病,男12例,女8例;年龄41~65岁,平均(51.9±6.9)岁。2组一般资料比较见表1。本研究经郑州大学第一附属医院医学伦理委员会批准,所有受试者或家属均签署知情同意书。对所有的病人进行详细的病史采集,填写问卷调查,包括年龄、性别、文化程度、首发症状及其出现时间、病程进展情况、生活工作环境,有无毒物接触史、有无家族史、有无吸烟、饮酒等嗜好;曾服用或正在服用的药物及其服用剂量、时间,有无其他并发症等。由研究者(神经内科专业医师)对PD病人进行UPDRSⅡ、UPDRSⅢ、Hoehn & Yahr分级法量表。
1.2 皮肤活检 在所有患者一侧上臂背侧肘关节上约10 cm处定位,用1%碘伏溶液常规消毒皮肤,2%利多卡因针对定位皮肤进行局部浸润麻醉,数分钟后选用皮肤大小合适孔径的打孔机样取皮器,左手固定皮肤,右手持取皮器在取材部位边旋转,边向下用力,旋取5 mm×5 mm的皮肤标本,含皮下脂肪组织及真皮层,用带齿镊轻轻夹起标本并提起,用剪刀将皮肤标本从底部剪断,取皮过程严格按照无菌操作要求进行,取皮后创口消毒、压迫止血,用无菌纱布加压包扎。
1.3 免疫组化法检测皮肤组织Beclin-1、LC3Ⅰ/LC3Ⅱ的分布 皮肤标本浸泡入4%多聚甲醛磷酸缓冲液(pH 7.4)内,在4℃环境下固定24 h,常规脱水、透明、浸润,石蜡包埋,后应用组织切片机将标本连续切片,每片厚度6 μm,用于免疫组织化学染色。
1.4 免疫印迹检测皮肤组织Beclin-1、LC3I/LC3II的表达 皮肤标本迅速置于已编号的冻存管中,然后立即放入盛有液氮的低温保温瓶中,后将冻存管移入-80℃低温冰箱中保存。将蛋白样本转移至硝酸纤维滤膜上。用5%脱脂奶粉封闭1 h,TBST洗3次,加入抗Beclin 1(1∶800)、抗LC3(1∶500)抗体,4℃过夜。加人过氧化物酶标记山羊抗兔IgG(1∶5000),置于水平脱色摇床上孵育1 h,TBST漂洗5次,ECL光化学法显色。凝胶成像分析系统分析扫描。

2 结果
2.1 免疫组化检测皮肤组织内源性Beclin 1 蛋白、LC3Ⅱ/LC3Ⅰ的表达 显微镜观察,每个病人皮肤样本取5张切片,选大致相同的位置技术阳性细胞数(10×40倍),然后用数码相机拍照。其中LC3、Beclin-1、LAMP2a免疫反应阳性细胞计数胞浆和胞核均呈棕褐色着色。如图1、2所示。

图1 免疫组化检测皮肤组织内源性LC3蛋白的表达
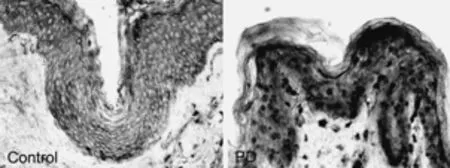
图2 免疫组化检测皮肤组织内源性Belin-1蛋白的表达
2.2 免疫印迹检测皮肤组织内源性Beclin 1 蛋白、LC3Ⅱ/LC3Ⅰ的表达 与正常对照组相比,PD的LC3Ⅱ/LC3Ⅰ表达明显上调(P<0.05);与正常对照组相比,PD的Beclin-1表达明显上调(P<0.05)。见图3。

图3 Western-blot检测皮肤组织内源性LC3蛋白的表达
3 讨论
PD多发于中老年人,为起病隐匿的慢性中枢神经系统退行性疾病。目前,PD的病因及发病机制尚不完全明确。多数学者认为PD是环境因素和遗传因素共同作用的结果,环境中的神经毒素、年龄的老化、遗传导致的突变蛋白等因素均可通过导致线粒体功能障碍、增加细胞氧化应激等机制诱导多巴胺能神经元的变性死亡[5]。大量研究表明,α-synuclein蛋白的错误折叠、降解障碍、异常聚集等可具有神经毒性,影响突触功能以及信号的传递,最终亦可导致神经元变性,而所有的这些机制都与自噬机制紧密联系。近期对常染色显性和隐性遗传家族性PD家系研究中发现,其相关基因产物也参与自噬的调控中。因此,近年来,越来越多的研究开始关注自噬在PD以及其他神经系统退行性疾病中所起到的作用,认识到有效的自噬调节可能成为将来PD等变性疾病治疗的新突破。
自噬是真核细胞所特有的一种重要的高度保守的防御和保护机制,自噬介导真核细胞中长半衰期蛋白、功能异常或冗余的细胞器的代谢降解。目前广泛认为,基础水平的自噬活性在维持神经元细胞内环境稳态中起到必不可少的作用,自噬机制的失调可导致神经元变性[6]。自噬活性可多种不利条件下如营养缺乏、缺氧状态、低能量供应等可被诱导,释放降解产物,尤其是氨基酸等重新进入细胞质以供机体循环再利用。根据自噬过程中底物的种类、底物运送到溶酶体腔的方式不同,自噬可分为三种类型,微自噬(microautophagy)、巨自噬(macroautophagy)以及分子伴侣介导的自噬(chaperone-mediated autophagy)。巨自噬特征性标志是双层膜自噬小体的形成,即细胞质中产生一C形双层膜结构,其两端延伸形成空泡,空泡中包裹部分细胞质、细胞器或者错误折叠、聚合的蛋白质,随后自噬小体与溶酶体融合,自噬小体内层膜包裹的内容物进入溶酶体进行降解,从而有利于一些重要的细胞成分,尤其是必需氨基酸的再循环利用。
本研究对23例PD患者的皮肤进行活检,并通过LC3、Beclin-1指标来评估自噬水平,由于考虑到年龄相关的因素,我们设立了年龄匹配的有效的健康对照组,其来源主要是在烧伤科以及外科手术的无神经系统疾病的患者。通过研究发现,与正常对照组相比,PD患者皮肤成纤维细胞Beclin-1、LC3II/I比值表达水平均上调,差异有统计学意义(P<0.05),间接提示PD患者体内可能存在异常聚集、错误折叠的蛋白或受损、功能异常的细胞器,从而机体通过上调自噬水平来清除降解这些异常成分,起到保护作用。自噬在PD等神经退行性疾病的发生、发展过程中扮演着重要的角色,自噬上调的可能原因以及PD的发病过程中起到保护作用。
自噬调节有希望成为将来治疗PD的潜在靶向目标。目前广泛认为,氧化应激在PD的发病机制中起重要的作用。许多与PD相关的基础以临床研究均发现自噬和氧化应激是相互依赖的关系,从而提出通过自噬调节来抑制氧化应激很可能成为未来治疗PD的新靶点。自噬在多种PD模型中均证实起到保护多巴胺神经元的作用,如通过雷帕霉素诱导自噬水平可有效抵抗鱼藤酮导致的神经毒性发挥保护作用,防止多泛素化的聚合物形成[7]。为预防对免疫系统有害的不良反应,目前小剂量雷帕霉素联合特异的抗氧化剂遏制黑质致密部进行性的氧化损伤已被接受。然而,另一些研究提出初级皮层神经元中海藻糖和雷帕霉素诱导的自噬可被巯醇抗氧化酶抑制。除此之外,一些物质可通过抑制基础自噬活性水平从而导致PD模型中α-synuclein蛋白聚合物的增加[8]。另外,近些年,一些学者专家围绕PD治疗的热点问题进行研究。首先,有神经病理学分析和动物实验表明注射Beclin-1可促进边缘系统中α-synuclein蛋白的清除,可能成为治疗PD的创新性方法。其次,研究发现,敲除Rab1a基因可抑制自噬小体形成,促进α-synuclein蛋白的异常聚积[9]。因此,若Rab1的基因表达水平调控适当,从而可能启动自噬途径,加速异常聚积α-synuclein蛋白的清除。
综上所述,PD的病因、发病机制十分复杂,多种机制相互作用参与其发病及发展过程中。本研究并不拘泥于某一种机制与自噬的关系,而从宏观上观察自噬活性在活体患者中的水平,并对造成这种现象的可能原因进行分析,对自噬在PD发病中的所扮演的角色有了初步了解。但这些复杂的机制如何调控自噬活性,其生物学意义是什么以及自噬发挥其细胞保护作用的具体机制如何,都需要有更多更深入样本量更大的研究来进一步发掘验证,为将来寻找PD有效可行的生物学标志物及开发治疗这些疾病的新手段奠定理论基础。
[1] Kondo Y, Kanzawa T, Sawaya R, et al. The role of autophagy in cancer development and response to theraphy[J]. Nat Rev Cancer, 2005, 5(9):726-734.
[2] Mizushima N, Levine B, Cuervo AM, et al. Autophagy fights disease through cellular self-digestion [J].Nature, 2008, 451(7182): 1 069-1 075.
[3] Suzanne SM, James AH. Molecular characterization of light chain 3.A microtubule binding subunit of MAP1A and MAP1B [J].J Biol Chem, 1994, 269(15):11 492-11 497.
[4] Kabeya Y, Mizushima N,Yamamoto A,et al. LC3, G-ABARAP and GATE16 localize to autophagosomal membrane depending on form-II formation [J]. J Cell Sci, 2004,117(13):2 805-2 812.
[5] Mizushima N. Methods for monitoring autophagy[J].Int J -Biochem Cell Biol, 2004, 36(12):2 491-2 502.
[6] Bandhyopadhyay U, Cuervo AM. Chaperone-mediated autophagy in aging and neurodegeneration: Lessons from a-synuclein [J].Exp Gerontol, 2007, 42(1): 120-128.
[7] Kon M, Cuervo AM. Chaperone-mediated autophagy in health and disease [J]. FEBS Lett, 2010, 584(1):1 399-1 404.
[8] Massey AC, Zhang C, Cuervo AM. Chaperone-mediated autophagy in aging and disease[J].Curr Top Dev Biol, 2006, 73:205-235.
[9] Boehncke WH,Dahlke A,Zollner TM,et al.Differential expression of heat shock protein 70(HSP70)and heat shock cognate protein 70(HSC70)in human epidermis[J]. Arch Dermatol Res, 1994, 287(1): 68-71.
(收稿2014-05-15)
Skin biopsy for assessment of autophagy dysregulation in the pathogenesis of Parkinson’s disease
WangXuejing*,DingXuebing,MaMingming,YinJingzheng,TengJunfang
*DepartmentofNeurology,theFirstAffiliatedHospitalofZhengzhouUniversity,Zhengzhou450003,China
Objective To assessment the function of chaperone-mediated autophagy (CMA), and macroautophagy in Parkinson’s disease patients using skin biopsy, and explore the role of autophagy in pathogenesis of Parkinson’s disease. Methods The study samples included 23 PD patients and 20 normal controls. Clinical data of all PD patients were collected, and graded by UPDRSⅡ, Hoehn & Yahr scales. Punch skin biopsies were taken from PD patients. Skin biopsy specimens were immunohistochemically stained with anti-LC3, anti-Beclin-1 and anti-LAMP2a antibodies. The expression of microtubule-associated protein1 light chain 3(LC-3), beclin-1, heat shock cognate protein70 (HSC-70), lysosome-associated membrane protein 2a (LAMP2a) were detected by Western blot.Results Beclin-1, LC3 immune positive cells optical density value in skin fibroblasts of PD was significantly more than that of the healthy controls(P<0.05). Western blot result showed LC3Ⅱ/LC3Ⅰ, Beclin-1 expression was significantly higher than that of control subjects(P<0.05).Conclusion Macroautophagy activity was higher in PD patients’ fibroblasts, and dysregulation of macroautophagy may participate in the process of PD.
Parkinson’s disease; Skin biopsy; Autophagy
国家自然科学基金项目(81100949,81301086)
R742.5
A
1673-5110(2014)23-0010-03

