高效液相色谱法测定川陈皮素PLGA纳米粒的含量
雒西萍,李维凤,牛晓峰*,赵新荣,张 浩,李华妮(.西安交通大学药学院,西安 7006;.西安碑林药业股份有限公司,西安 70048)
川陈皮素(nobiletin,NOB) 又称蜜橘黄酮,是从芸香科柑桔属橘子CitrusreticulaiaBlanco 果皮中提取的一种黄酮化合物[1-2],据报道,川陈皮素对肺癌、腹膜肿瘤、胃癌、皮肤癌等多种癌细胞均具有极强的抑制活性[3]。但由于川陈皮素在乙醚等脂溶性溶剂及水中的溶解度极小,且口服给药的生物利用度极低(仅约4%),而药物制成纳米粒具有提高生物利用度、降低用药次数、减少给药量等特点。乳酸-羟基乙酸共聚物(PLGA)是美国FDA批准的药用辅料,具有良好的组织相容性和生物可降解性。近几年被大量用作纳米载药体系的骨架材料[4-5],PLGA纳米粒具有延长药物释放时间、降低药物毒性和刺激性的特点,适用于口服生物利用度低而又需长期使用的药物[6]。川陈皮素PLGA纳米粒为一种具有抗癌作用的新型制剂,为了更好地发挥川陈皮素的药理作用、控制制剂质量,现采用高效液相色谱法测定PLGA纳米粒中川陈皮素的含量。
1 仪器与试药
1.1仪器 Agilent 1100型高效液相色谱仪;H-1850R高速冷冻离心机(湖南湘怡离心机仪器有限公司);BP211D型电子天平(赛多利斯(北京)中国有限公司);KQ-250B 型超声波清洗仪(250 W,50 kHz,江苏昆山仪器有限公司)。
1.2试药 川陈皮素对照品(西安小草植物科技有限公司,质量分数98.0%);川陈皮素PLGA纳米粒(自制);乙腈为色谱级;水为超纯水;其他试剂均为分析纯。
2 方法与结果
2.1色谱条件 色谱柱:ODS-C18(250 mm×4.6 mm,5 μm)不锈钢柱;流动相:乙腈-水(45∶55);检测波长:333 nm;流速:1 mL·min-1。
2.2溶液的制备方法
2.2.1对照品溶液的制备 精密称取川陈皮素对照品11.66 mg,置于25 mL量瓶中,加甲醇溶解至刻度,摇匀。精密吸取上述溶液1 mL,加甲醇制成每1 mL含46.64 μg的溶液,即得。
2.2.2供试品溶液的制备 总川陈皮素质量浓度测定:精密吸取川陈皮素PLGA纳米粒混悬液0.5 mL,置于1.5 mL离心管中,加乙腈0.5 mL超声(250 W,50 kHz)5 min,离心(14 000 r·min-1,6 ℃)10 min,上清液用0.45 μm微孔滤膜滤过,即得。
包封川陈皮素质量浓度的测定:精密吸取川陈皮素PLGA纳米粒混悬液1 mL,置于1.5 mL离心管中,离心(14 000 r·min-1,6 ℃)20 min,弃去上清液,残渣加纯化水洗涤,离心(14 000 r·min-1,6 ℃)10 min,残渣加乙腈1 mL超声(250 W,50 kHz)5 min,上清液过0.45 μm微孔滤膜,即得。
2.2.3空白对照溶液制备 精密吸取不含川陈皮素的空白PLGA纳米粒混悬液0.5 mL,照上述供试品溶液的制备方法制备,即得。
2.3专属性考察 分别吸取上述对照品溶液、供试品溶液、空白对照溶液,在上述2.1色谱条件下进样,结果供试品溶液在与对照品溶液保留时间相同位置有吸收峰出现,而空白对照溶液无吸收峰,即制剂中的辅料对川陈皮素测定不产生干扰。 见图1。
2.4线性关系考察 分别吸取川陈皮素对照品溶液(质量浓度为46.64 μg·mL-1)2,6,10,14和18 μL,按上述色谱条件进样测定,以峰面积(A)为纵坐标、质量浓度(C)为横坐标,进行线性回归,得回归方程:A=170.15C+27.156,r=0.999 0,川陈皮素在93.28~839.52 μg范围内呈良好的线性关系。
2.5精密度考察 精密吸取质量浓度为23.32μg·mL-1的川陈皮素对照品溶液10 μL,按上述2.1色谱条件,分别进样5次,测定川陈皮素的峰面积,结果RSD为0.83%,表明精密度良好。

图1 HPLC图
2.6稳定性考察 精密吸取已测知含量的供试品溶液(5~10 ℃保存),在0,4,8,12和24 h分别取样10 μL,在上述2.1色谱条件下测定峰面积值,结果RSD为1.30%,表明溶液在24 h内基本稳定。
2.7重复性实验 平行吸取5份川陈皮素PLGA纳米粒混悬液,按供试品溶液项下的方法制备,在上述色谱条件下进样,测定川陈皮素的含量,结果本方法重复性良好,RSD为1.0%。
2.8回收率实验 精密量取不含川陈皮素的空白纳米粒混悬液9份各1 mL,分别准确加入不同质量浓度的川陈皮素对照品溶液,按照样品测定项的方法操作,计算回收率,结果见表1。
2.9样品测定 分别吸取川陈皮素PLGA纳米粒混悬液适量,按供试品方法制备,进样,测定川陈皮素的含量,结果见表2。
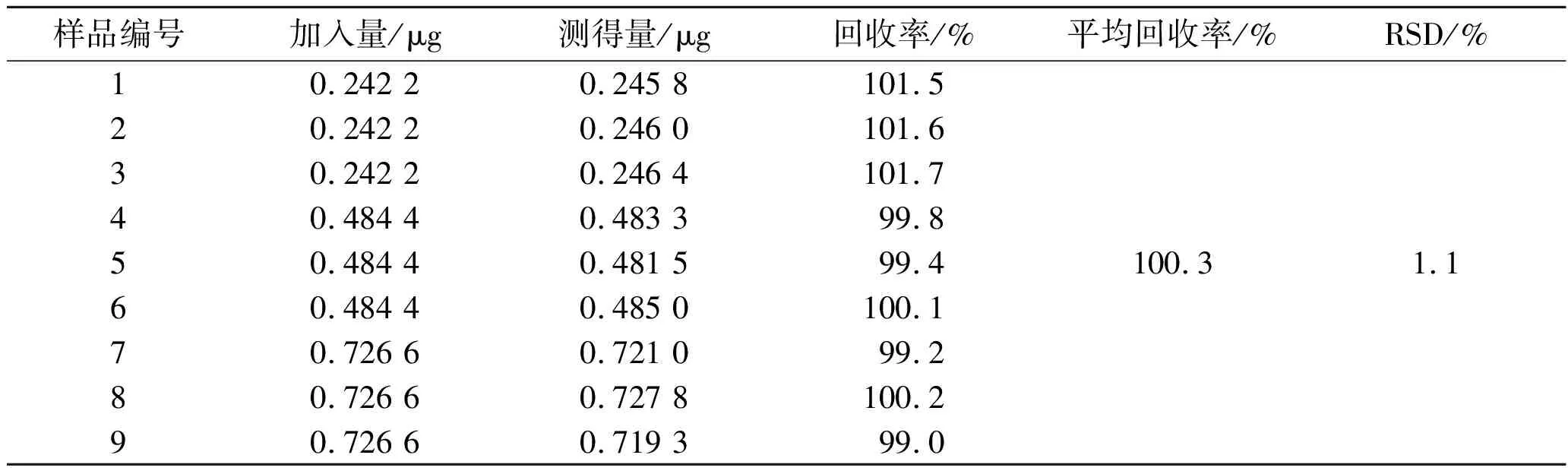
表1 川陈皮素PLGA纳米粒回收率实验结果

表2 川陈皮素PLGA纳米粒含量测定结果
包封率计算公式:包封率=包封NOB质量浓度/总NOB质量浓度×100%。
3 讨论
文献报道有用高效液相色谱法测定药材中川陈皮素的含量[7-8],但用高效液相色谱法测定川陈皮素PLGA纳米粒的含量笔者未见报道。本文采用低温高速离心乙腈破解的方法测定川陈皮素PLGA纳米粒包封的药物量,但由于纳米粒在制备过程中,所投放的药物定会有些损失,所以直接通过测定包裹在纳米粒中的药量计算包封率并不准确。我们采用乙腈为破解剂,分别测定纳米粒中所包裹的川陈皮素和纳米粒混悬液中实际的总药量,以此来计算纳米粒的包封率。以乙腈-水(45∶55)为流动相系统,样品分离效果良好。该测定方法快捷、准确、专属性强,且其中的辅料不会对主药含量测定产生干扰,因此可用于川陈皮素PLGA纳米粒的质量控制。
参考文献:
[1] Li S,Yu H,Ho C T.Nobiletin:efficient and large quantity isolation from orange peel extract[J].Biomed Chromatogr,2006,20(1):133-138.
[2] 张志海,王彩云,杨天鸣,等.陈皮的化学成分及药理作用研究进展 [J].西北药学杂志,2005,20(1):47-48.
[3] 管晓琳,朱玲,周黎明.川陈皮素对非小细胞肺癌A549细胞的抑制作用[J].四川生理科学杂志,2005,27(2):54-55.
[4] Zhang Z P,Tongchusak S,Mizukami Y,et al.Induction of anti-tumor cytotoxic T cell responses through PLGA-nanoparticle mediated antigen delivery[J]. Biomaterials,2011,32(14):3666-3669.
[5] Jain R A.The manufacturing techniques of various drug loaded biodegradable poly(D,L-lactide-co-glycolide acid)(PLGA) devices[J]. Biomaterials,2000,21(23):2475-2478.
[6] Ghobad M,Ali N,Mohammad B J,et al. Physicochemical and anti-bacterial performance characterization of clarithromycin nanoparticles as colloidal drug delivery system [J]. Colloid Surface B,2011,88(1):39-43.
[7] 徐欢,陈海芳,余宝金,等.HPLC法测定枳壳中川陈皮素[J].中草药,2009,40(1):142-143.
[8] 钱士辉,朱玲英,陈廉.RP-HPLC法测定陈皮药材中川陈皮素的含量[J].南京中医药大学学报,1998,14(4):219-220.
