互花米草黄酮含量分析及其生态学意义
刘金珂, 王天弘, 周长芳, 胡楚琦, 王涵兴
南京大学生命科学院,江苏 南京 210093
禾本科米草属植物共有14个物种(包含部分杂交种),其中在全球范围内形成入侵的物种有3个,包括互花米草SpartinaalternifloraLoisel、密花米草SpartinadensifloraBrongn(也译作多花米草)以及大米草SpartinaanglicaC.E.Hubb.(Strong & Ayres,2013)。中国目前所涉及的2种米草属植物均为引进种。其中,大米草于1963年引自英国和丹麦,20世纪80年代在中国沿海扩散面积达36000 hm2,后期因不明原因萎缩,目前分布面积不足50 hm2(Anetal.,2007)。互花米草于1979年底引自美国的北卡罗来纳、佐治亚和佛罗里达州,目前国内分布的米草属植物主要为该物种,最新统计面积为34178 hm2(Lu & Zhang,2013)。
互花米草为多年生C4草本植物,原产于北美洲大西洋沿岸和墨西哥海湾,并已入侵至北美洲太平洋沿岸、澳大利亚、法国、英国和中国等国家和地区(邓自发等,2006;Strong & Ayres,2009)。互花米草于1979年底引入中国,20世纪80~90年代在保滩护岸、促淤造陆方面发挥了显著效果(Chungetal.,2004)。但近年来其在我国东南沿海潮间带的迅速扩张也给当地盐沼生态系统带来了显著的负效应(Anetal.,2007)。互花米草的扩散改变了潮间带原有的地貌特征,并与芦苇等土著植物竞争,影响了底栖动物、土壤微生物等的多样性,改变了盐沼土壤碳、氮库及硫的生物地球化学循环特征,进而影响了整个海滨湿地系统的生态功能(周长芳等,2009;Chenetal.,2008;Zhouetal.,2009)。鉴于此,有关互花米草扩张的机制和种群控制策略已成为当前全球生态学研究的热点(Hedgeetal.,2003;Roberts & Pullin,2008)。互花米草也被我国农业部列为第一批重点管理的外来入侵物种之一(《中华人民共和国农业部公告》第1897号)。
黄酮类化合物是广泛存在于植物体内的一类次生代谢物。该物质被认为是植物重要的抗氧化成分之一,可清除羟自由基等活性氧组分,并在植物光保护过程中发挥作用(Agatietal.,2013)。黄酮类成分在入侵植物的化感机制中也起着重要作用,例如Maetal.(2009)在入侵植物五爪金龙IpamoeacairicaL.中分离到2种黄酮类化合物3-3′-5-Trillydroxy-4′-7-dimethoxyflavone和3-3′-5-Trihydroxy-4′-7-dimethoxyflavone-3-O-sulfate,并发现这2类化合物能抑制萝卜、黄瓜、白菜和黄帚橐吾等种子的萌发;郭亚姣等(2011)发现黄顶菊Flaveriabidentis(L.) Kuntzed的叶片中黄酮类物质能抑制白菜种子的萌发。在医学上黄酮类物质还具有较好的消炎、免疫、降血糖等功效,因此植物源黄酮的药用价值与保健功能也备受关注(阎祥华等,1997;Pérez-Gregorioetal.,2014)。
本研究拟比较互花米草不同器官中黄酮的含量,分析其越冬芽黄酮含量与所在盐沼中不同地理位置的关系,以了解黄酮成分是否与该物种在盐沼滩涂中的扩散有关。鉴于目前市场上对黄酮物质的需求量巨大,试验还将针对互花米草黄酮的提取工艺进行优化,以期通过互花米草生物质的开发利用为该种群的生态控制提供思路。
1 试验方法
1.1 芦丁标准曲线绘制
以芦丁(99%,泽朗植提)作为黄酮标准参照物,以95%乙醇配成0.2 mg·mL-1的标准溶液备用。分别将芦丁标准溶液0、0.1、0.2、0.3、0.4、0.5 mL移至5 mL塑料离心管中,加入95%乙醇使各管溶液体积至0.5 mL。以NaNO2-Al(NO3)3法反应显色,加入5% NaNO20.3 mL,摇匀后静置6 min,再加入10% Al(NO3)30.3 mL,摇匀后静置6 min,最后加入5% NaOH 1.9 mL,摇匀后静置15 min。每个浓度重复3次。以不加芦丁的样本为空白对照,用紫外分光光度计(U-5100,日本HITACH)于490~510 nm波长范围内扫描芦丁反应物,测得其最大吸收峰出现于500 nm处,由此测定所有反应物在此处的光密度。以芦丁浓度为横坐标,光密度为纵坐标绘制标准曲线。所得标准回归方程为:y=12.203x-0.0023,R2=0.9977。
1.2 互花米草不同器官黄酮含量分析
于2011年10月采集温室培养的互花米草植株,分成根、根状茎、茎、叶鞘、叶、颖稃及种子共7个部分,105 ℃烘1 h后转至65 ℃烘至恒重。称取0.02 g样本,用多样品组织研磨仪(上海净信科技)以65 Hz的频率研磨3次,每次45 s。加入70%乙醇1 mL,70 ℃水浴2 h。5000 r·min-1离心10 min后收集上清液,以0.5 mL等浓度的乙醇洗涤残余物并重复一次,合并上清液。以NaNO2-Al(NO3)3法显色,测定D500 nm,并对照芦丁标准曲线计算提取物中的总黄酮含量。
1.3 互花米草越冬芽黄酮含量与所在盐沼中地理位置的关系
经实测江苏盐城丹顶鹤国家级珍禽自然保护区沿海滩涂互花米草植被总宽为1250 m(垂直于海岸线方向)。于2011年12月选取向陆侧互花米草植被边缘为零点,每隔250 m向海推进采集越冬芽地上部分。每个位点在平行于海岸线方向上相距100 m设置3个重复。样本带回实验室洗净,同上述方法烘干,用小型粉碎机粉碎后过60目筛,以同样方法提取显色后测定总黄酮含量。
1.4 黄酮提取工艺优化设计
为探索互花米草黄酮工业化提取工艺,以秋季野外采集烘干并储存半年以上的互花米草叶片为材料,分析提取过程中液料比、乙醇浓度、提取温度和提取时间等4个因素对黄酮提取效率的影响。将上述4个因素各取3个水平,采用L9(34)正交表进行正交试验(表1)。植物材料经小型粉碎机粉碎后过60目筛,按预设料液比(重量∶体积,g∶mL)的3/5体积和预设浓度加入乙醇,以预设温度和时间恒温水浴。5000 r·min-1离心10 min后收集上清液,以1/5体积的等浓度乙醇洗涤残余物并重复一次,合并上清液。以上述相同的方法测得提取物中的总黄酮含量。每个处理设5个重复。

表1 互花米草总黄酮提取因素及水平Table 1 Extraction conditions and concentrations to extract flavonoids from S.alterniflora, collected from Yancheng, eastern China
1.5 数据分析
文中所列数据为平均值±标准误。以单因素方差分析和Duncan′s检验比较互花米草不同器官间以及盐沼中不同地理位置样本间黄酮含量的差异,以Pearson相关性检验分析盐沼中样本地理位置和黄酮含量的相关性,以多因素方差分析和Duncan′s检验比较正交试验中不同组合处理间黄酮提取效率的差异。
2 结果与分析
2.1 互花米草各部位黄酮含量分析
试验在秋季互花米草样本的根、根状茎、茎、叶鞘、叶片、颖稃和种子中均测出了黄酮类物质(图1)。互花米草叶片中总黄酮含量远高于其余各器官,达到了29.128 mg·g-1,为其余各器官的3.6~5.4倍(P<0.05)。其余各器官中,种子的黄酮含量相对偏高,根状茎的黄酮含量最低,但差异未达到显著性程度(P>0.05)。
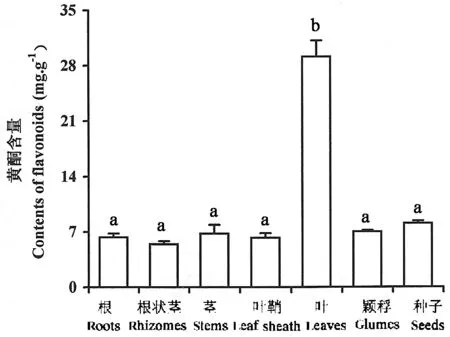
图1 互花米草各器官黄酮含量Fig.1 Flavonoid contents in different organs of S.alterniflora plants
2.2 互花米草越冬芽黄酮含量与所在盐沼中不同地理位置的关系
由图2可知,不同地理位置的互花米草越冬芽黄酮含量差异很大。该指标随着植被向海方向的延伸而上升,并与越冬芽所在位置与陆侧植被边缘的距离呈显著正相关(P<0.05)。除陆侧植被边缘位点与第2、3位点(250和500 m处)之间差异不显著以外,第4、5、6位点(750、1000和1250 m处)越冬芽黄酮含量与其余位点都具显著差异(P<0.05)。在互花米草草滩前缘与潮间带裸滩相交处,越冬芽黄酮含量最高,达到了17.923 mg·g-1。
2.3 黄酮提取工艺优化分析
以提取液中的黄酮含量为指标,互花米草叶片黄酮提取工艺优化的正交试验结果如表2。由多因素方差分析和极差值可知,影响互花米草黄酮提取效果各因素由强至弱依次为水浴温度>水浴时间>乙醇浓度>料液比。80 ℃水浴温度下互花米草黄酮提取效果显著高于60和70 ℃(P<0.05),后两者差异不显著。水浴2 h后提取物中的黄酮含量高于水浴3 h(P>0.05)和水浴1 h(P<0.05)。70%乙醇黄酮提取效率略高,60%乙醇黄酮提取效率略低,但试验范围内乙醇浓度差异对互花米草黄酮提取率的影响不显著(P>0.05)。60和80 ℃水浴温度下提取效果均有所下降,但差异不显著。1∶30料液比试验组黄酮浸出率略高于1∶20和1∶25试验组,但三者之间差异不具显著性(P>0.05)。由此初选出适宜互花米草干叶的黄酮提取工艺可能为料液比1∶30,乙醇浓度70%,水浴温度80 ℃,水浴时间2 h。因该组合不在正交表中,取相同材料进行重复验证,获得该工艺条件下互花米草叶片黄酮提取量为18.090 mg·g-1,高于原正交表中所有试验组的提取结果。

图2 互花米草越冬芽黄酮含量随地理位置的变化情况Fig.2 Flavonoid contents in winter shoots of S.alterniflora in relation to the shoot location, measured as distance from the landside edge of vegetation in the saltmarsh at Yancheng, eastern China
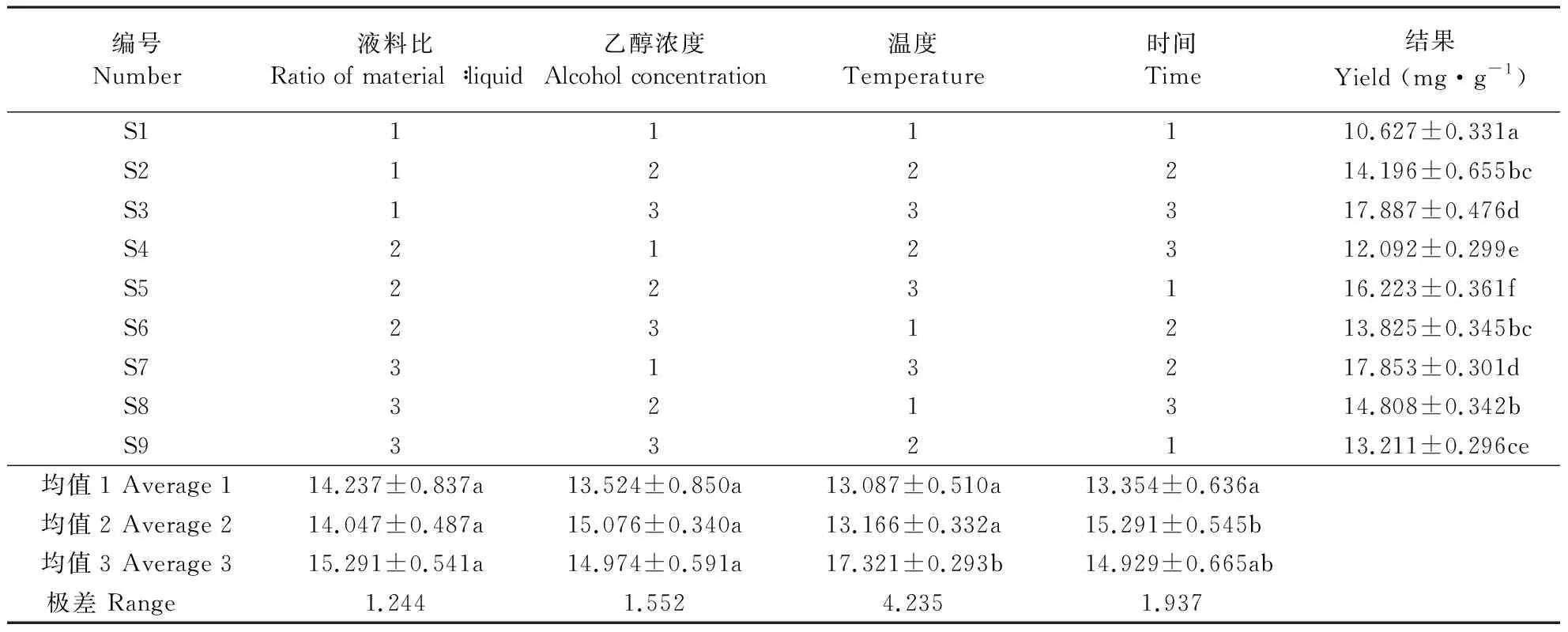
编号Number液料比Ratio of material∶liquid乙醇浓度Alcohol concentration温度Temperature时间Time结果 Yield (mg·g-1)S1111110.627±0.331aS2122214.196±0.655bcS3133317.887±0.476dS4212312.092±0.299eS5223116.223±0.361fS6231213.825±0.345bcS7313217.853±0.301dS8321314.808±0.342bS9332113.211±0.296ce均值1 Average 114.237±0.837a13.524±0.850a13.087±0.510a13.354±0.636a均值2 Average 214.047±0.487a15.076±0.340a13.166±0.332a15.291±0.545b均值3 Average 315.291±0.541a14.974±0.591a17.321±0.293b14.929±0.665ab极差 Range 1.2441.5524.2351.937
数据为平均值±标准误,n=5,同列数据后附不同字母者代表在0.05水平上差异显著。 Numbers represent means±SE,n=5, different letters after the numbers in the "Yield" column indicate significant differences at the level ofP=0.05.
3 讨论
互花米草中黄酮含量很高,并主要集中于叶片,这一特征可能与互花米草高光合效率有关。黄酮是一种高效的抗氧化物质,有报道黄酮类化合物在光合作用过程中可很快产生,并在植物光保护过程中具有重要作用(Agatietal.,2013)。研究发现,互花米草干储叶片中黄酮含量(18.090 mg·g-1)与目前市场上热销的银杏叶黄酮含量(18.8 mg·g-1)相当(林建原和季丽红,2013),并远高于大豆异黄酮含量(4.784 mg·g-1)(黄芸等,2007)。互花米草快速烘干叶片中黄酮含量更高(29.128 mg·g-1DW)。
盐沼互花米草植被中越冬芽的黄酮含量沿着向海方向逐渐升高。由于研究地互花米草植被位于潮间带内偏上的位置,离海越近,受海水潮汐的影响越大,生境也越恶劣,因此推测互花米草组织内的黄酮含量可能与该植被抵御盐沼恶劣生境有关。钦佩等(1991)发现互花米草在光合过程中能迅速合成黄酮类物质。杨晓梅等(1997)进一步研究发现,一定范围内盐度越高黄酮含量越高。其他盐生植物中黄酮含量与环境盐度的关系也有报道(万洪善和李凡,2012;Buhmann & Papenbrock,2013)。值得关注的是,其他一些入侵植物中,黄酮含量也相对丰富,如紫茎泽兰Ageratinaadenophora6.14%(李焱等,2011)、假臭草EupatoriumcatariumVeldkamp 1.36%(汤丽昌等,2011)。较高的黄酮含量可能有助于入侵植物对新环境尤其是恶劣生境的适应。入侵植物黄酮含量与其入侵性之间的相关性尚待深入探讨。
互花米草黄酮提取工艺优化分析过程中,水浴温度是影响最大的因素,适当的水浴加热有助于互花米草黄酮的浸出,但过高的水浴温度和和过长的水浴时间反而对黄酮浸出不利。张彩霞等(2011)推测温度太高将导致黄酮类化合物的破坏,且乙醇的挥发也可能使黄酮提取率降低。同样,如果水浴时间过长,也增加了黄酮在空气中的氧化时间,降低总黄酮得率(杨红玲等,2009)。本试验中70%的乙醇浓度优于60%和80%的乙醇,1∶30的料液比也优于1∶20和1∶25,但相关因素导致的差异并无显著性。唐军等(2008)曾对米草属大米草黄酮的提取工艺进行优化,得出最佳提取工艺为料液比1∶10,乙醇浓度70%,温度80 ℃,提取时间3 h,提取3次。该研究中乙醇浓度和提取温度与本试验一致,但提取时间较本试验长。另外,唐军等(2008)在正交试验中没有分析料液比对提取效率的影响,而是直接采用了1∶10,尝试了5次提取,发现前3次提取后,得率已达总提取量的91.2%。本试验直接借鉴该研究成果,统一提取3次。另外,李盈蕾等(2010)也就大米草黄酮的提取工艺进行了研究,得出优化工艺:固液比1∶40,乙醇浓度70%,微波萃取功率400 W,提取6 min。本试验在早期提取分析过程中也曾尝试超声波辅助提取,后因无明显效果而放弃(数据未报道)。
值得注意的是,本试验初次分析互花米草不同器官中黄酮含量时,所得叶片黄酮含量为后续提取工艺中最优方案所得率的1.6倍。其原因可能为材料差异,前者所用材料为温室采得的互花米草叶经105 ℃快速杀青后烘干至恒重的样本,由采集至提取未超过7 d。后者为野外采集样本,由野外至实验室运输过程超过2 d,后经烘干后又储存了半年以上才开始分析,其运输过程中植物细胞中的酶促代谢反应没有迅速终止,可能会消耗一部分黄酮类次生代谢产物,而后长期的储存过程也有可能导致部分黄酮物质的氧化和降解。因此,互花米草生物质的收割和储存方式在后续黄酮开发应用中也应引起注意。另一个原因也可能是在初次分析时,所用料液比达到了1∶100 (0.02 g∶2 mL),但在以开发应用为目的的大规模提取过程中,过高的料液比显然不合适。
鉴于黄酮类物质显著的保健和药用功能,其市场开发潜力巨大。互花米草生物质资源丰富,黄酮含量很高,可以成为商品黄酮的一个有效来源。早期有专家曾就米草黄酮的抗炎和免疫活性进行分析,并提出了以生物矿质液和总黄酮为核心的米草绿色食物生态工程理念(张康宣等,1992;Qinetal.,1998)。本研究中互花米草黄酮提取工艺的优化为推进相关产业化提供了技术支持。
从另一个角度考虑,互花米草有效成分和生物质的输出,在带动地方经济的同时,也为该物种的生态控制创造了机会。Wangetal.(2008)曾就互花米草生态控制和综合利用进行过探讨,包括直接作为畜禽饲料、其提取物(生物矿质液)作为饲料添加剂和动物着色剂、提取后的残余物作为肥料等。有关黄酮成分的开发将大大提高互花米草生物质的利用价值。本研究希望以适度的经济利益促使当地百姓主动参与生态控制,并相信该途径可以成为解决当前我国生物入侵问题的有效策略之一。
邓自发, 安树青, 智颖飙, 周长芳, 陈琳, 赵聪蛟, 方淑波, 李红丽. 2006. 外来种互花米草入侵模式与爆发机制. 生态学报, 26(8): 2678-2686.
郭亚姣, 郑书馨, 李洁, 江莎. 2011. 黄顶菊叶中类黄酮对白菜种子萌发的影响. 内蒙古农业大学学报, 32(4): 105-109.
黄芸, 崔力剑, 窦玉红, 王鑫国, 牛丽颖. 2007. 紫外分光光度法测定大豆中异黄酮的含量. 大豆科学, 26(2): 273-275.
李焱, 黄筑艳, 宴雨寒, 张磊. 2011. 紫茎泽兰中黄酮类色素含量的三氯化铝比色法测定. 时珍国医国药, 22(6): 1363-1364.
李盈蕾, 陈建华, 宋晓凯, 孙吉佑, 詹永成, 吴同岩. 2010. 大米草总黄酮微波提取工艺及其抗氧化活性研究. 中成药, 32(11): 1983-1985.
林建原, 季丽红, 2013. 响应面优化银杏叶中黄酮的提取工艺. 中国食品学报, 13(2): 83-90.
钦佩, 谢民, 周爱堂. 1991. 互花米草的初级生产与类黄酮的生成. 生态学报, 11(4): 293-298.
汤丽昌, 王宁, 李慧, 杨先会, 邓世明. 2011. 外来入侵植物假臭草总黄酮提取工艺研究. 安徽农业科学, 39(30): 18594-18595, 18598.
唐军, 徐年军, 何艳丽, 严小军. 2008. 大米草黄酮的提取工艺及清除羟自由基作用的研究. 食品科技, 33(2): 149-152.
万洪善, 李凡. 2012. 盐生植物碱蓬黄酮类物质的提取及抗氧化活性研究. 江苏农业科学, 40(4): 296-298.
阎祥华, 顾景范, 孙存普. 1997. 大豆异黄酮的抗癌作用机制研究进展. 生理科学进展, 28(4): 362-364.
杨红玲, 吴鸣建, 张宏韬, 田海英, 张东豫. 2009. 射干黄酮提取工艺的响应面设计优化. 食品科技, 34(3): 188-192.
杨晓梅, 谢民, 徐国万. 1997. 人工海水环境中互花米草总黄酮等生理成分与盐浓度的相关性研究. 生态学杂志, 16(3): 7-10.
张彩霞, 蔡定建, 方文英. 2011. 白花蛇舌草中黄酮提取工艺的优化及其结构鉴定. 安徽农业科学, 39(1): 131-133, 136.
张康宣, 钦佩, 钱红美, 谢民. 1992. 互花米草总黄酮(TFS)局部抗炎作用及其免疫活性初探∥钦佩, 仲崇信. 米草的应用研究. 北京: 海洋出版社, 61-66.
周长芳, 安树青, 赵聪蛟, 方超, 陆霞梅, 赵晖, 刘静娜. 2009. 互花米草入侵对海岸盐沼二甲基硫及氧化亚氮气体释放的影响. 海洋科学, 33(2): 17-21.
Agati G, Brunetti C, Ferdinando M D, Ferrini F, Pollastri S and Tattini M. 2013. Functional roles of flavonoids in photoprotection: new evidence, lessons from the past.PlantPhysiologyandBiochemistry, 72: 35-45.
An S Q, Gu B H, Zhou C F, Wang Z S, Deng Z F, Zhi Y B, Li H L, Chen L, Yu D H and Liu Y H. 2007.Spartinainvasion in China: implications for invasive species management and future research.WeedResearch, 47: 183-191.
Buhmann A and Papenbrock J. 2013. An economic point of view of secondary compounds in halophytes.FunctionalPlantBiology, 40: 952-967.
Chen J, Zhao B, Ren W, Saunders S C, Ma Z, Li B, Luo Y and Chen J. 2008. InvasiveSpartinaand reduced sediments: Shanghai′s dangerous silver bullet.JournalofPlantEcology, 1: 79-84.
Chung C H, Zhuo R Z and Xu G W. 2004. Creation ofSpartinaplantations for reclaiming Dongtai, China, tidal flats and offshore sands.EcologicalEngineering, 23: 135-150.
Hedge P, Kriwoken L K and Patten K. 2003. A review ofSpartinamanagement in Washington State, US.JournalofAquaticPlantManagement, 41: 82-90.
Lu J and Zhang Y. 2013. Spatial distribution of an invasive plantSpartinaalternifloraand its potential as biofuels in China.EcologicalEngineering, 52: 175-181.
Ma R J, Wang N L, Zhu H, Guo, S J and Chen D S. 2009. Isolation and identification of allelochemicals from invasive plantIpomoeacairica.AllelopathyJournal, 24: 77-84.
Pérez-Gregorio M R, Regueiro J, Simal-Gándara J, Rodrigues A S and Almeida D P F. 2014. Increasing the added-value of onions as a source of antioxidant flavonoids: a critical review.CriticalReviewsinFoodScienceandNutrition, 54: 1050-1062.
Qin P, Xie M and Jiang Y. 1998.Spartinagreen food ecological engineering.EcologicalEngineering, 11: 147-156.
Roberts P D and Pullin A S. 2008. The effectiveness of management interventions for the control ofSpartinaspecies: a systematic review and meta-analysis.AquaticConservation:MarineandFreshwaterEcosystems, 18: 592-618.
Strong D R and Ayres D R. 2009.Spartinaintroductions and consequences in salt marshes: arrive, survive, thrive, and sometimes hybridize∥Silliman B R, Bertness M D and Grosholz E D.HumanImpactsonSaltMarshes:AGlobalPerspective. Berkeley: University of California Press, 3-22.
Strong D R and Ayres D R. 2013. Ecological and Evolutionary misadventures ofSpartina.AnnualReviewofEcology,EvolutionandSystematics, 44: 389-410.
Wang G, Qin P, Wan S, Zhou W, Zai X and Yan D. 2008. Ecological control and integral utilization ofSpartinaalterniflora.EcologicalEngineering, 32: 249-255.
Zhou C, An S, Deng Z, Yin D, Zhi Y, Sun Z, Zhao H, Zhou L, Fang C and Qian C. 2009. Sulfur storage changed by exoticSpartinaalterniflorain coastal saltmarshes of China.EcologicalEngineering, 35: 536-543.

