我院“药品说明书之外的用法”现状调查和探讨
张 波,赵 彬,张钰宣,梅 丹
0 引言
“药品说明书之外的用法”(Unlabeled uses,off-label uses,out-of-label usage or outside of labeling)是指药品使用的适应证、给药方法或剂量不在国家药监局批准的说明书之内的用法。它的具体含义包括适应证、给药途径、给药剂量、使用人群等与药品说明书内容不同。尽管“说明书之外的用法”在当前药物治疗中发挥着重要的作用,但它涉及到医疗责任、伦理学、医保报销以及药品安全性和有效性等一系列问题。“药品说明书之外的用法”在国内外广泛存在[1-5]。本文对我院“药品说明书之外的用法”现状进行调查,探讨“药品说明书之外的用法”相关问题和对策。
1 资料与方法
1.1 调查对象 对我院“药品说明书之外的用法”的现状进行调查。
1.2 研究方法 本项目设计了“药品说明书之外的用法”申报表,内容包括药品基本信息(通用名、商品名、剂型和规格)、“药品说明书之外的用法”基本信息(包括适应证、剂量、人群、给药途径和依据等),收集各临床科室常用的“药品说明书之外的用法”。在本研究中,上报“药品说明书之外的用法”的入选标准应满足以下条件之一:符合国际指南用法;符合国内指南用法;符合专家共识(专著、诊疗常规);或有其他循证医学证据支持(文献报道、个案报道)。
1.3 数据分析 本文从临床科室分布、药品种类、超说明书用药类型、循证医学证据等方面对“药品说明书之外的用法”进行分析。采用WHO的ATC分类系统对药品种类进行分类。有多个ATC编码的药品,根据其说明书主要适应证分类;无ACT编码的药品,根据ATC分类原则及其说明书主要适应证分类[3]。
2 结果
2.1 科室分布和药物分布 全院共有18个临床科室上报了548项“药品说明书之外的用法”,占全院总科室的42.9%(18/42)。从科室来看,排在前6位的科室依次是呼吸科(136项,24.8%)、儿科(111项,20.3%)、肿瘤内科(95项,17.3%)、心理医学科(54项,9.9%)、皮肤科(43项,7.8%)和风湿免疫科(27项,4.9%),上述6个科室上报的“说明书之外的用法”占全院“药品说明书之外的用法”的85%(466/548)。
从药物来看,涉及“超药品说明书用药”的药品品种有155种,占我院全部药品种类的15.6%(155/993)。排名前3位的药品类别分别是抗肿瘤药及免疫调节剂(53种,34.2%)、神经系统用药(17种,11.0%)、消化和代谢用药(13种,8.4%)和心血管系统用药(13种,8.4%)。
2.2 “药品说明书之外的用法”分类 我院超说明书用药主要表现在超适应证用药(95.4%),其次是药品的使用人群不在说明书批准范围(16.6%)。另外,约21.2%的“药品说明书之外的用法”同时在适应证、给药剂量、给药途径或使用人群等2个或2个以上方面存在超说明书用药。见表1。

表1 我院“药品说明书之外的用药”类型(n=548)
2.3 “药品说明书之外的用法”的评价
2.3.1 依据分类 我院548项说明书之外的用法均有依据,其中,91项用法(16.6%)是被美国食品药品监督管理局(FDA)批准的说明书用法,见表2;256项用法(46.7%)符合国际指南用法;122项用法(22.3%)符合专家共识。上述3种“说明书之外的用法”证据等级类型占总数的84.5%(463/548),见表3。

表2 由于国内外药品说明书不同造成的“药品说明书之外的用法”

表3 我院“药品说明书之外的用药” 依据分类(n=548)
2.3.2 MICROMEDEX有效性、推荐级别和证据等级评价 MICROMEDEX 推荐、证据和有效性评价(Micromedex Recommendation,Evidence and Efficacy Rating)是用于评价药物用法循证医学证据的常用方法,也是美国决定“说明书之外的用法”是否报销的重要依据。它主要从有效性、是否推荐和证据等级等3方面进行详细的描述。有效性等级包括治疗有效(Class Ⅰ)、证据支持有效(Class Ⅱa)、有效性具有争议(Class Ⅱb)和治疗无效(Class Ⅲ) 4个等级,有效性等级依次减弱;推荐等级包括推荐使用(Class Ⅰ)、大多数情况下推荐使用(Class Ⅱa)、在某些情况下推荐使用(Class Ⅱb)、不推荐使用(Class Ⅲ)和不明确(Class indeterminate)5个等级,推荐等级依次减弱;证据等级包括A类、B类、C类和没有证据4类,证据等级依次减弱。
在548项“说明书之外的用法”中,260项(42.8%)已被MICROMEDEX收录,有效性、推荐级别和证据等级见表4。
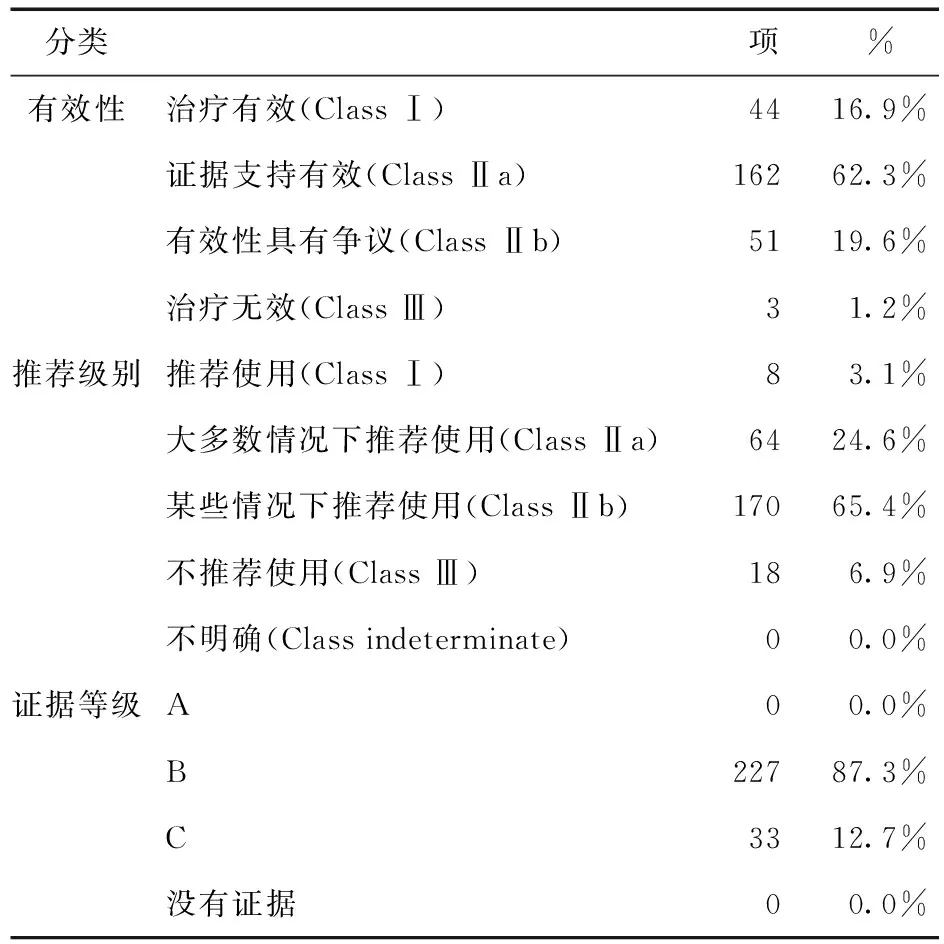
表4 “说明书之外的用法”的有效性、推荐级别和证据等级分类(n=260)
在MICROMEDEX收录的260项用法中,有3项“说明书之外的用法”的疗效评价是无效的;18项 “说明书之外的用法”是不推荐使用的,见表5。其余288项(52.6%)用法未被MICROMEDEX收纳和评估,表明尽管我院上报的“说明书之外的用法”具有各种依据,但仍有52.6%用法未被MICROMEDEX收录,表明这些“说明书之外的用法”值得进一步商榷,部分未被MICROMEDEX收录的用法见表6。

表5 MICROMEDEX不推荐使用的“药品说明书之外的用法” 举例

表6 MICROMEDEX未收录的“药品说明书之外的用法” 举例
3 讨论
3.1 “说明书之外的用法”产生的原因和相关问题 造成“说明书之外的用法”产生的原因是多方面的[6]。首先是药品审批方面,1938年美国的FDA只要求制药公司提供药品安全性数据,1962年Kefauver-Harris修正案强制要求FDA批准的新药应提供有效性证据。因此,FDA批准的药物对于某个适应证具有安全性和有效性。药品审批整个过程大概需要10年。制药公司若修改说明书也需要花费大量时间和费用。另外,某些说明书之外的用法已经大量临床试验验证,获得美国FDA审批,成为说明书批准的适应证,但国内制药厂家未对药品说明书进行更新,也造成了“说明书之外的用法”,如甲氨蝶呤、羟氯喹等。本研究显示,约16.6%(91项)“说明书之外的用法”已在美国FDA批准,在美国属于说明书用法,但国内药品说明书由于未进行申报或更新,造成了“药品说明书之外的用法”。此外,为加快进口药品申报和审批速度,国外制药厂家仅对部分药品适应证进行申报,造成了同一厂家生产的药品在不同国家批准的适应证不同,如替加环素,阿加曲班和厄洛替尼等(见表2)。一旦药品上市,FDA并未限制或管控医生如何使用。其次是临床需求方面,当患者病情危重或在终末期时,没有合理的替代药品,医生可能会尝试使用临床实践、专业讨论或文献报道获得了“说明说之外的用法”。另外,某些特殊人群(儿科、老年、妊娠或肿瘤患者)由于临床试验的操作可行性和伦理学因素,并未进行临床研究和批准,造成了“药品说明书之外的用法”在儿科患者和肿瘤患者广泛存在[5,7-8]。
“药品说明书之外的用法”会引起一系列问题[7,9-10]。首先,药品的安全性和有效性是否得到验证。某些“药品说明书之外的用法”缺乏大量、科学的临床试验验证,其安全性和有效性仍需要进一步的验证。其次,医疗责任和伦理学问题。《赫尔辛基宣言》明确表明“若医生认为新的治疗方法能够治愈疾病、恢复健康或缓解痛苦,那么医生有权使用新的治疗方法”。医生有责任告知患者治疗步骤、预后情况及可能出现的危险,必要时签署知情同意书等。另外还有药品报销问题。各国的政策差别很大,某些保险公司通常对“已接受的标准治疗”和说明书用法给予报销。
3.2 “说明书之外的用法”对策和建议 “药品说明书之外的用法”在国外非常普遍。1982年4月,美国FDA对“药品说明书之外的用法”发表声明,“不强迫医生必须完全遵守官方批准的药品说明书用法”。2011年,FDA发布了“说明书之外用法”的说明,强调“若使用药品说明书之外用法,医生应充分了解该药品,并且具有强有力的科学依据和临床证据,并就药品的使用和效果做好记录”,但FDA不允许制药公司对“说明书之外的用法”进行推广。英国药品和健康产品管理局(The Medicine and Healthcare Products Regulatory Agent,MHRA)发表声明,强调医生在“药品说明书之外用法”问题上的建议和责任,如开具“药品说明书之外的用法”前,应有充分的证据和相关经验,使用过程对患者进行监测和随访,并记录使用“说明书之外的用法”的原因[11]。澳大利亚药品管理局(Therapeutic Goods Administration,TGA)并没有“说明书之外用法”的特别声明或指导原则,但有学者建议,如果有高质量的证据支持,允许说明书之外的用法,否则不得使用[]。日本药品和医疗器械局(Pharmaceutical and Medical Devices Agent,PDMA)目前没有对“说明书之外用法”发表声明。从全球角度考虑,通常认为医生开具“说明书之外的用法”是允许的,它引起了各国药品监督机构的关注[11]。
广东省药学会发布了国内首个专家共识,共识建议在具备了某些条件后,临床可以使用“说明书之外用法”[12]。国内也出现了《超药品说明书用药参考》的专著,它根据临床实际应用情况,收集了目前临床常用的、主要的“药品说明书之外的用法”,并列举了大量国内外参考文献,编写成本书。该书不但列出各主要药品的说明书之外的用法,还按照循证医学的要求,列举了证据等级和文献来源[13]。
本研究结果显示,“药品说明书之外的用法”现象在客观上现实存在,它产生的原因很多,它涉及到药品有效性、医疗责任、伦理学和报销等问题,存在巨大法律风险。卫生行政部门应明确对待“药品说明书之外的用法”的态度,建立相应的管理制度;制药公司应积极推荐说明书的更新,特别是跨国公司在药品申报时应维持药品说明书在不同国家的一致性;医疗机构应规范医生医疗行为,慎重使用“药品说明书之外的用法”。
参考文献:
[1] Sonntag D,Trebst D,Kiess W,et al.Off-label drug prescriptions among outpatient children and adolescents in Germany-a database analysis[J].Dtsch Med Wochenschr,2013,138(44):2239-2245.
[2] Borges AP,Campos MS,Pereira LR.Evaluation of unlicensed and off-label antiepileptic drugs prescribed to children:Brazilian Regulatory Agency versus FDA[J].Int J Clin Pharm,2013,35(3):425-431.
[3] Ling-li Zhang,You-ping Li,Liang Huang,et al.Survey on off-label drug use in Pediatric outpatient of West China Second University Hospital in 2010[J].Chin J Evid-based Med,2012,12 (3):267-273.
[4] Zhang L,Li Y,Liu Y,Zeng L,et al.Pediatric off-label drug use in China:risk factors and management strategies[J].J Evid Based Med,2013,(1):4-18.
[5] Wang W,Zhu M,Guo D,et al.Off-Label and Off-NCCN Guidelines Uses of Antineoplastic Drugs in China[J].Iran J Public Health,2013,42(5):472-479.
[6] Wittich CM,Burkle CM,Lanier Wl.Ten common questions (and their answers) about off-label drug use[J].Mayo Clin Pro,2012,87(10):982-990.
[7] Bo Zhang,Shuoqi Ru,Dan Mei.Off label drug use in pediatrics abroad[J].Prac Pharm Clin Rem,2008,11(5):270-272.
[8] Lenk C.Off-label drug use in peadiatrics:a world wide problem[J].Curr Drug Targets,2012,13(7):878-884.
[9] Messori A,Fadda V,Trippoli S.A uniform procedure for reimbursing the off-label use of antineoplastic drugs according to the value-for-money approach[J].J Chemother,2011,23(2):67-70.
[10]Mason J,Pirmohamed M,Nunn T.Off-label and unlicensed medicine use and adverse drug reactions in children:a narrative review of the literature[J].Eur J Clin Pharmacol,2012,68(1):21-28.
[11]Ruble J.Off-label prescribing of medications for pain:maintaining optimal care at an intersection of law,public policy,and ethics[J].J Pain Palliat Care Pharmacother,2012,26 (2):146-152.
[12]Zheng Z,Xu F.Chinese pharmacists propose patient consent for unlabeled use of medications[J].J Manag Care Pharm,2010,16(8):640.
[13]Bo Zhang,Zhihua Zheng,Dakui Li.Reference for unlabeled use of medication [M].1st ed.Beijing:People′s Medical Publishing House,2013:5-7.

