NVP-BEZ235对卵巢癌细胞系SKOV3增殖及体内、体外迁移的影响
秦 宇,赖慧玲,赵雪娇,王常玉
0 引言
卵巢癌是女性第七大致死癌症相关性疾病,并且是第二大常见妇科恶性肿瘤[1]。近30年来,虽然医疗及科研工作者在各种层面对卵巢癌进行研究、尝试,但卵巢癌患者的5年生存率一直保持在30%左右,并未得到极大改善[2]。近年来,由于人们对卵巢癌发生的内在分子机制的了解不断加深,更特异的分子通路靶向治疗得到极大重视。其中PI3K-mTOR通路在卵巢癌中被发现普遍活化,且参与卵巢癌细胞的生存、增殖、耐药及侵袭转移。因此,PI3K-mTOR通路相应抑制剂雷帕霉素及雷帕霉素类似物在卵巢癌的治疗过程中得到了极大重视。NVP-BEZ235是一种PI3K-mTOR 双通路抑制剂,不仅可以显著抑制PI3K活性,同时也能抑制mTOR复合体活性,在前列腺癌、结肠癌及乳腺癌等恶性肿瘤中通过引起细胞周期阻滞、细胞凋亡抑制肿瘤增殖[3-5]。比传统mTOR通路抑制剂雷帕霉素及类似物更具杀伤效应。本文通过研究NVP-BEZ235对卵巢癌细胞系SKOV3体外、体内转移的影响,检测PI3K-mTOR通路抑制剂在治疗卵巢癌方面的可能性。
1 材料和方法
1.1 仪器 全波段酶标仪(美国 Bio-tek公司);相差显微镜(日本OLYMPUS公司);荧光体式显微镜(日本OLYMPUS公司);细胞培养箱(美国Termo公司);Western Blot电泳及转膜仪(美国 Bio-rad)。试剂:NVP-BEZ235(美国Cayman公司);CCK-8(日本Dojindo公司);P-AKT、P-mTOR一抗(美国Cell signal公司);GAPDH一抗(中国三鹰公司);SKOV3卵巢癌细胞系(美国ATCC公司);Transwell小室(美国Corning公司);Mcoy5a培养基(中国博士德公司);胎牛血清(中国四季青公司)。
1.2 方法
1.2.1 细胞培养及药物预处理 人卵巢癌细胞系SKOV3置于Mcoy5a完全培养基(10%胎牛血清,DMEM培养液)中,37 ℃、5% CO2培养箱中培养,细胞融合率达90%时进行胰蛋白酶消化,传代或种于孔板进行下一步实验。按照实验目的分为对照组和NVP-BEZ235处理组,对照组中细胞不加NVP-BEZ235,处理组培养基中给予125 nmol/mL和250 nmol/mL NVP-BEZ235持续加药。
1.2.2 CCK8法测NVP-BEZ235对卵巢癌细胞SKOV3增殖抑制试验 将胰酶消化过的SKOV3单细胞悬液在调整密度后,以每孔100 μL体积,1×104接种于96孔板中,贴壁24 h后,加入含NVP-BEZ235浓度为0、125、250、500、1 000 nM的100 μL培养基,置于37 ℃、5% CO2培养箱培养至48 h,加入37 ℃预热的Cell counting kit-8(Dojindo,日本),继续培养4 h,酶标仪450 nm处读取吸光度值。计算生长抑制率(IR):IR=[(对照组-实验组)/对照孔]×100%。实验重复3次。
1.2.3 构建稳定表达绿色荧光蛋白(GFP)的SKOV3细胞株 将SKOV3细胞以每孔5×104接种至12孔板中(1 mL),融合率为30%~50%,加入GFP慢病毒,并用5 μg/polybrene提高感染率。等细胞长满后传代扩增。
1.2.4 免疫印迹法检测NVP-BEZ235对PI3K-mTOR通路的抑制 胰酶消化对照组和处理组细胞,再用PBST洗3次,加细胞裂解液提取细胞总蛋白质,用BCA法测蛋白浓度后,加蛋白上样液,加热变性后取40 μg进行SDS-聚丙烯酰胺凝胶电泳,转移到PVDF膜,5%脱脂牛奶室温孵育30 min,分别用P-AKT(1∶1 000),P-mTOR(1∶1 000)抗体4 ℃孵育过夜,洗涤3次,再用相应辣根过氧化物酶标记的二抗(1∶4 000)孵育1 h,PBST洗膜3次,采用ECL试剂盒反应,Bio-Rad成像系统采集图像。
1.2.5 体外迁移试验 将消化成单细胞悬液的对照组和处理组SKOV3细胞以2×104个细胞,200 μL含2% FBS Mcoy5a培养基的体积种于transwell上层小室中,下层中加入500 μL 5% FBS Mcoy5a培养基。继续于37 ℃细胞培养箱中培养40 h。用棉签轻轻擦去未穿过的细胞后用PBS洗3遍,再用4%多聚甲醛固定15 min。PBS洗3遍,再用结晶紫染色,后再用PBS将多余结晶紫洗净。随机取5个视野,取平均数,重复3次实验。迁移抑制率=[(对照组平均数-实验组平均数)/对照组平均数]×100%。
1.2.6 斑马鱼体内迁移试验 对照组与实验组细胞用正义表达绿色荧光蛋白的慢病毒转染48 h后,用显微注射仪注射约200个细胞于2 d大的斑马鱼胚胎卵黄囊中,每组10只。注射48 h后,用荧光体式显微镜观察并拍摄、计数尾部细胞转移情况。迁移抑制率=[(对照组平均数-实验组平均数)/对照组平均数]×100%。
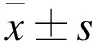
2 结果
2.1 CCK-8法检测NVP-BEZ235抑制卵巢癌SKOV3增殖 使用浓度分别为125、250、500、1 000 nM NVP-BEZ235对SKOV3作用48 h,通过CCK-8法检测NVP-BEZ235对卵巢癌的增殖影响,发现NVP-BEZ235在浓度为125、250 nM时,对SKOV3细胞增殖抑制差异无统计学意义(P>0.05),而浓度在500~1 000 nM时,对SKOV3细胞有抑制增殖的作用(P<0.05)。见表1。

表1 NVP-BEZ235对SKOV3细胞体外增殖的影响
2.2 NVP-BEZ 235显著抑制PI3K-mTOR通路 Western blot结果表明,在NVP-BEZ235浓度为125、250 nM时与对照组相比,PI3K-mTOR通路中的AKT及mTOR的磷酸化水平显著抑制。见图1。
2.3 NVP-BEZ235抑制SKOV3细胞体外迁移选取对卵巢癌无增殖抑制的低浓度125、250 nM NVP-BEZ235处理后的细胞种植在Transwell小室,24 h后通过随机选取5个视野计数,结果表明,该浓度下明显抑制SKOV3细胞的体外迁移,差异有统计学意义(P<0.05)。见表2。
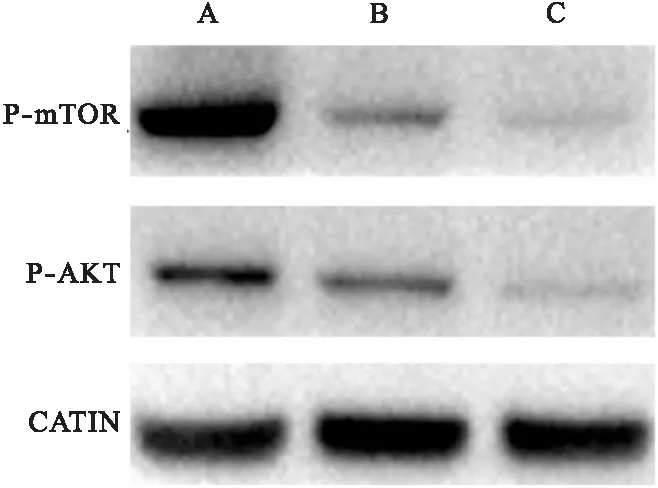
图1 NVP-BEZ235抑制卵巢癌SKOV3细胞中PI3K-mTOR通路
注:A:对照组,B:NVP-BEZ235 125 nM处理组,C:NVP-BEZ235 250 nM处理组
2.4 NVP-BEZ235抑制卵巢癌斑马鱼体内迁移与对照组未处理的卵巢癌细胞相比,NVP-BEZ235 250 nM处理后的细胞在斑马鱼尾部的荧光点明显减少,差异有统计学意义(P<0.05),NVP-BEZ235显著抑制了SKOV3细胞在斑马鱼体内的转移。见表3、图2。
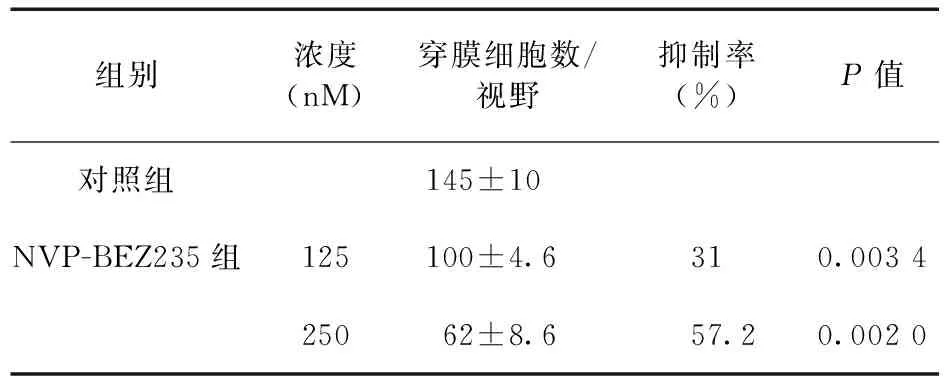
表2 NVP-BEZ235对SKOV3细胞体外迁移的影响(n=3)
注:P值为与对照组比

表3 NVP-BEZ235对SKOV3细胞体内迁移的影响(n=10)
注:P值为与对照组比

图2 NVP-BEZ235抑制卵巢癌SKOV3细胞斑马鱼体内转移(绿色荧光点为转移灶细胞)
3 讨论
PI3K-mTOR通路是调控细胞生长过程的关键通路,在多种恶性肿瘤中存在异常活化[6]。PI3K-mTOR通路可以通过多种方式激活,其中包括PTEN的缺失或突变[7]、PIK3CA的突变[8]以及mTOR复合体的调控异常[9]等等。抑制该通路可以降低肿瘤细胞增殖、引起细胞自噬,同时增加癌细胞对化疗的敏感性,但是对正常细胞却没有影响[4],因此,被认为是改善治疗结果的一个很好的靶点。PI3K-mTOR信号通路同样在卵巢癌中也存在异常活化,根据美国癌症和肿瘤基因图谱(TCGA)最近公布的数据表明,约有34%的卵巢癌样本中存在PI3K-mTOR通路异常,提示此通路在卵巢癌的发生发展中起着至关重要的作用[10]。目前mTOR抑制剂已开发出三代,第一代以Rapamycin为代表,虽可部分抑制mTOR通路活性,但存在通过PI3K而引起生存通路ERK/RSK2、Akt和Mnk/eIF4F等的负反馈激活现象,导致疗效减弱的问题[11]。第二代为mTOR的ATP竞争性抑制剂,如PP242、INK126、Torin1等,可完全抑制mTOR的激酶活性,而取得更好的肿瘤细胞杀伤效果[12]。目前,前两代抑制剂已经有部分药物进入临床前期研究且取得了不错进展。第三代以NVP-BEZ235为代表,其是一种新型的PI3K、mTOR双通路抑制剂。不仅能在降低mTOR的激酶活性的基础上同时抑制PI3K的激酶活性,避免了第一代mTOR抑制剂存在的负反馈激活生存通路问题,而有效地增加了mTOR通路的抑制效果。NVP-BEZ235通过拮抗PI3K/mTOR信号通路,可引起细胞周期阻滞、自噬等杀伤效应,在很多肿瘤中有很好的治疗前景[6]。本研究中,随着NVP-BEZ235浓度的增高,SKOV3的增殖能力被显著抑制且呈剂量依赖关系。本实验通过免疫印记法检测到,当SKOV3细胞经NVP-BEZ235处理后,PI3K及mTOR通路得到了抑制。
卵巢癌是一种高转移率和高复发率的疾病,复发和转移占卵巢癌患者死亡原因的90%。如何有效地抑制卵巢癌细胞转移,对延长卵巢癌病人的生存,改善生存质量具有极其重要的意义[13]。PI3K-mTOR通路居于调控肿瘤细胞转移能力的核心位置。经典的肿瘤分泌因子TGFβ通过激活PI3K-mTOR,引起肿瘤细胞的上皮间质化而导致侵袭能力增强,抑制mTOR通路活性,从而能够逆转该过程,减少癌细胞转移[14]。有研究表明,在胰腺神经分泌型肿瘤中,同时加入PI3K和mTOR抑制剂后,除肿瘤细胞增殖受到明显抑制外,体内外转移能力也大大减弱[15]。本研究中,NVP-BEZ235在不影响卵巢癌增殖的浓度剂量下,Transwell实验证明其显著抑制了卵巢癌细胞的体外迁移能力。本文另一新颖之处为运用了斑马鱼移植瘤这一很好的体内验证模型,验证了NVP-BEZ235的体内抑制活性。实验结果证明,该药也有很好的抑制体内转移的功能。以上结果表明,NVP-BEZ235作为PI3K-mTOR通路抑制剂,不仅可以抑制卵巢癌的增殖,同时对于卵巢癌的转移起到了很好的抑制作用,在治疗卵巢癌方面有很好的应用前景。
参考文献:
[1] Lowe KA,Chia VM,Taylor A,et al.An international assessment of ovarian cancer incidence and mortality[J].Gynecologic Oncology,2013,130(1):107-114.
[2] Jelovac D,Armstrong DK.Recent progress in the diagnosis and treatment of ovarian cancer[J].CA:A cancer Journal For Clinicians,2011,61(3):183-203.
[3] Yasumizu Y,Miyajima A,Kosaka T,et al.Dual PI3K/mTOR inhibitor NVP-BEZ235 sensitizes docetaxel in castration resistant prostate cancer[J].J Urol,2014,191(1):227-234.
[4] Mueller A,Bachmann E,Linnig M,et al.Selective pi3k inhibition by bkm120 and bez235 alone or in combination with chemotherapy in wild-type and mutated human gastrointestinal cancer cell lines[J].Cancer Chemotherapy and Pharmacology,2012,69(6):1601-1615.
[5] Cavazzoni A,Bonelli MA,Fumarola C,et al.Overcoming acquired resistance to letrozole by targeting the pi3k/akt/mtor pathway in breast cancer cell clones[J].Cancer Letters,2012,323(1):77-87.
[6] Yan-Na L,Ren-Zhong W,Zhao-Peng L.Recent developments of small molecule pi3k/mtor dual inhibitors[J].Mini Rev Med Chem,2013,13(14):2047-2059.
[7] Wallin JJ,Edgar KA,Guan J,et al.Gdc-0980 is a novel class i pi3k/mtor kinase inhibitor with robust activity in cancer models driven by the pi3k pathway[J].Molecular Cancer Therapeutics,2011,10(12):2426-2436.
[8] Jiang G,Huang Z,Zhang S,et al.Pik3ca gene mutations and amplifications in Chinese patients with ovarian clear cell carcinoma[J].Cancer Investigation,2013,31(10):639-644.
[9] Gomez-Pinillos A,Ferrari AC.Mtor signaling pathway and mtor inhibitors in cancer therapy[J].Hematol Oncol Clin North Am,2012,26(3):483-505.
[10]Cancer Genome Atlas Research N.Integrated genomic analyses of ovarian carcinoma[J].Nature,2011,474(7353):609-615.
[11]Carracedo A,Ma L,Teruya-Feldstein J,et al.Inhibition of mtorc1 leads to mapk pathway activation through a pi3k-dependent feedback loop in human cancer[J].The Journal of Clinical Investigation,2008,118(9):3065-3074.
[12]Zhou HY,Huang SL.Current development of the second generation of mtor inhibitors as anticancer agents[J].Chinese Journal of Cancer,2012,31(1):8-18.
[13]Amate P,Huchon C,Dessapt AL,et al.Ovarian cancer:sites of recurrence[J].Int J Gynecol Cancer,2013,23(9):1590-1596.
[14]Lamouille S,Connolly E,Smyth JW,et al.Tgf-beta-induced activation of mtor complex 2 drives epithelial-mesenchymal transition and cell invasion[J].Journal of Cell Science,2012,125(Pt 5):1259-1273.
[15]Djukom C,Porro LJ,Mrazek A,et al.Dual inhibition of pi3k and mtor signaling pathways decreases human pancreatic neuroendocrine tumor metastatic progression[J].Pancreas,2014,43(1):88-92.

