淫羊藿苷上调PPARα和PGC-1α蛋白的表达改善慢性脑低灌注大鼠模型的空间学习记忆
李雯娴,邓媛媛,石京山,李 菲,刘 波,龚其海
(遵义医学院 药理学教研室暨基础药理省部共建教育部重点实验室, 贵州 遵义 563099)
脑血流减少是老年人认知功能障碍的重要危险因素之一,其引起的慢性脑低灌注可加快老年痴呆的病程。临床研究发现,轻度认知障碍患者存在脑血流减少。因此,慢性脑低灌注被认为是导致老年人认知障碍、轻度认知损害、血管性痴呆和迟发性阿尔茨海默病(Alzheimer’s disease,AD)的关键因素[1-3]。尽管慢性脑低灌注引起的认知缺陷的发病机制已取得显著进展,但目前仍缺乏理想的药物治疗。因此,继续研究抗慢性脑低灌注所致认知功能减退的药物意义重大。
淫羊藿苷(icariin, ICA)是淫羊藿的主要成分之一。研究表明,ICA可改善由脂多糖引起的脑功能障碍,抑制神经皮质酮诱导的细胞凋亡,具有抗炎和神经保护作用[4-5]。我们的前期研究发现,ICA可改善脑慢性低灌注诱导的大鼠学习记忆减退[6],但其作用机制尚不完全清楚。因此,本文观察了ICA对双侧颈总动脉结扎所致大鼠慢性脑缺血模型空间学习记忆减退的影响,并探索其可能的作用机制。
1 材料与方法
1.1 材料
1.1.1 实验动物 成年雄性SD大鼠60只,SPF级,体重250±20g, 购自重庆第三军医大学动物实验中心,合格证号:SCXK-( 渝) 2007-00005。
1.1.2 试剂和药品 淫羊藿苷购自南京泽朗医药有限公司(纯度经HPLC检测大于98%);PPARα和PGC-1α抗体购于英国Abcam公司。
1.1.3 仪器 MT-200 Morris水迷宫,成都泰盟科技公司;全自动凝胶图象分析仪,美国BIO-RAD公司;i-mark酶标仪,美国BIO-RAD公司。
1.2 方法
1.2.1 动物分组和造模 60只大鼠,随机分为4组:假手术组、模型组、低和高剂量ICA治疗组( 10、40 mg/kg) (n=15)。模型组、ICA低和高剂量组用丝线将双侧颈总动脉结扎,假手术组只分离出颈总动脉, 不结扎。造模10 d后,ICA低、高剂量组分别连续灌胃ICA10、40 mg/kg ,连续23 d,假手术组和模型组灌胃等体积生理盐水。
1.2.2 Morris水迷宫 造模后第28天进行水迷宫检测。方法参照本研究组既往方法进行[7]。
1.2.3 Western blot测定蛋白表达 水迷宫检测结束后,处死大鼠,取海马。称取100 mg海马组织,匀浆离心取上清液。在570 nm波长处,用酶标仪进行检测样品和标准品吸光度值, 根据标准品吸光度值和标准品已知浓度作标准曲线,计算上清液蛋白浓度,8% SDS-PAG凝胶电泳后转膜, 封闭、抗体孵育,ECL发光显影,实验结果采用凝胶成像系统测定泳带光密度积分值, 并与相应内参的积分光密度值比较, 得出各蛋白的相对表达量。
2 结果
2.1 ICA对大鼠空间学习记忆功能的影响 给药后第18天,Morris水迷宫检测了大鼠空间学习记忆功能。定位航行实验中,第1天各组间运动距离无统计学意义。第2、3、4天,与假手术相比,模型组运动距离明显增加(P<0.05),与模型组比较,ICA低、高剂量组大鼠的运动距离明显缩短(P<0.01,P<0.05)。空间探索实验中,模型组大鼠在目标象限的停留时间明显低于假手术组 (P<0.05),这表明双侧颈总动脉结扎可使大鼠的空间学习记忆功能减退。而在ICA灌胃23 d后,低、高剂量组大鼠的目标象限停留时间较模型组明显延长(P<0.05),表明ICA可减轻双侧颈总动脉结扎所致大鼠的空间学习记忆功能减退(见表1,表2)。
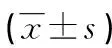

组别n第1天 (m)第2天 (m)第3天 (m)第4天 (m)假手术组1039.5±3.411.9±2.29.2±0.95.7±0.8模型组1045.6±3.420.9±2.9*17.4±3.3*10.8±2.1*ICA低剂量组1037.8±2.610.7±1.1##7.8±1.2#5.0±1.0#ICA高剂量组1235.7±4.212.9±1.7#9.5±1.0#6.2±0.6#
与假手术组比较*P<0.05,与模型组比较 ##P<0.01,#P<0.05。
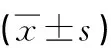
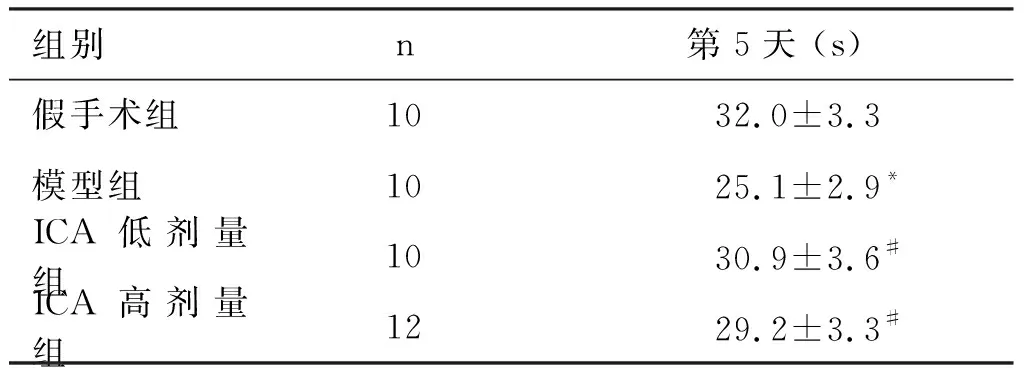
组别n第5天 (s)假手术组1032.0±3.3模型组1025.1±2.9*ICA低剂量组1030.9±3.6#ICA高剂量组 1229.2±3.3#
与假手术组比较*P<0.05,与模型组比较 #P<0.05 。
2.2 ICA对海马组织PPARα和PGC-1α蛋白表达的影响 水迷宫检测结束后,Western blot法检测了大鼠海马PPARα和PGC-1α蛋白表达。结果发现,模型组大鼠海马的PPARα和PGC-1α蛋白表达均较假手术组明显降低(P<0.01,P<0.05);然而,与模型组比较,ICA低、高剂量组大鼠海马的PPARα和PGC-1α蛋白表达均明显上调(分别P<0.01,P<0.05,见图1)。

以假手术组为1,其他组与其进行比较。**P<0.01,*P<0.05 versus sham group, ## P<0.01, # P<0.05 versus BCCAO group (n=3)。图1 ICA对海马组织PPARα和PGC-1α蛋白表达的影响
3 讨论
本研究首先探索了ICA对慢性脑低灌注模型的有效剂量。本课题组前期研究发现,30~120 mg/kgICA对该模型慢性低灌注大鼠的学习记忆具有改善作用[6],因此,本实验探究更低剂量的ICA对该模型是否具有改善作用并进一步探究其作用机制。结果发现,ICA10、40 mg/kg对双侧颈总动脉结扎致脑慢性低灌注大鼠的学习记忆具有改善作用。此外,模型组PPARα和PGC-1α蛋白的表达均下调,而给予ICA10、40 mg/kg能使其表达上调。
双侧颈总动脉结扎诱导的大鼠学习记忆减退是一种合适的脑慢性低灌注模型,可以较好地模仿VD和AD的病理特征,被广泛用于实验研究[8]。本研究发现,双侧颈总动脉结扎可诱导的大鼠学习记忆减退,提示本模型成功。胰岛素抵抗与VD或AD的病理密切相关,高胰岛素血症诱导的胰岛素抵抗可增加VD或AD的发病率[9]。此外,甚至有学者提出AD是3型糖尿病,在胰岛素抵抗中,胰岛素水平异常升高,增加的胰岛素与胰岛素降解酶竞争Aβ,导致Aβ不能有效降解并在脑内沉积,最后导致VD或AD。
本研究检测了PPARs的PPARα的表达。研究发现, ICA能够阻遏脑慢性缺血诱导的PPARα蛋白表达下降,表明ICA对中枢神经系统中的PPARα具有激动作用。PPARs是配体激活转录因子受体,属于核受体家族,其3种亚型(α,β/δ和γ)参与脂质和葡萄糖代谢和调节。虽然PPARs的3种亚型都存在于成人大脑中,但PPARα和PPARγ是研究得较多的异构体[10]。PPARα的激活可诱导不同器官的抗炎和抗氧化作用。在脑缺血模型中,PPARα激动剂非诺贝特和WY-14643预防性给药3d和7d,可产生神经保护作用[11]。本研究结果与既往研究一致,提示PPARα可能是ICA抗慢性脑低灌注所致大鼠学习记忆减退的作用靶点之一。
PGC-1α是能量代谢和脂质稳态的关键调节剂,与糖尿病和肥胖的代谢紊乱有关。PGC-1α的过度表达可诱导大鼠原代培养骨骼肌细胞中PPARα的表达增加,提示PGC-1α可能通过PPARα信号导致胰岛素抵抗[12]。然而,最近研究发现,短暂脑缺血实验模型中,PGC-1α信号通路的激活可以防止迟发性海马CA1区神经元死亡[13]。此外,PPAR激动剂可以通过PGC-1α诱导的线粒体融合裂变动态过程,这个过程可阻止氧化应激对线粒体功能的损害,从而保护海马神经元线粒体功能[14]。本研究发现,ICA能够阻遏慢性脑缺血诱导的PGC-1α和PPARα的表达下降,提示PGC-1α可能通过PPARα信号对脑慢性低灌注大鼠起神经保护作用,从而改善大鼠学习记忆功能。
综上所述,本研究进一步揭示了ICA可改善脑慢性脑低灌注诱导的大鼠空间学习记忆减退,其机制至少与上调PPARα和PGC-1α蛋白的表达有关。因此,ICA有望成为治疗抗慢性脑低灌注相关疾病如AD及VD的药物,值得进一步研发。
[参考文献]
[1] Hanyu H, Sato T, Hirao K, et al.The progression of cognitive deterioration and regional cerebral blood flow patterns in Alzheimer's disease: a longitudinal SPECT study [J]. J Neurol Sci, 2010, 290(1): 96-101.
[2] Kume K, Hanyu H, Sato T, et al.Vascular risk factors are associated with faster decline of Alzheimer disease: a longitudinal SPECT study [J]. J Neurol , 2011, 258(7): 1295-1303.
[3] de la Torre J C. Cerebral hemodynamics and vascular risk factors: setting the stage for Alzheimer's disease [J]. J Alzheimers Dis, 2012, 32(3): 553-567.
[4] Guo J, Li F, Wu Q, et al.Protective effects of icariin on brain dysfunction induced by lipopolysaccharide in rats [J]. Phytomedicine, 2010, 17(12): 950-955.
[5] Zhang H, Liu B, Wu J, et al.Icariin inhibits corticosterone-induced apoptosis in hypothalamic neurons via the PI3-K/Akt signaling pathway [J]. Mol med rep, 2012, 6(5): 967-972.
[6] Xu R X, Wu Q, Luo Y, et al. Protective effects of icariin on cognitive deficits induced by chronic cerebral hypoperfusion in rats [J]. Clin Exp Pharmacol P, 2009, 36(8): 810-815.
[7] Gong Q H, Wang Q, Pan L L, et al.Hydrogen sulfide attenuates lipopolysaccharide-induced cognitive impairment: a pro-inflammatory pathway in rats [J]. Pharmacol Biochem Be, 2010, 96(1): 52-58.
[8] Sarti C, Pantoni L, Bartolini L, et al.Cognitive impairment and chroniccerebral hypoperfusion: what can be learned from experimental models [J]. J Neurol Sci, 2002, 203: 263-266.
[9] Peila R, Rodriguez B L, White L R, et al.Fasting insulin and incident dementia in an elderly population of Japanese-American men [J]. Neurology, 2004, 63(2): 228-233.
[10] Zolezzi J M, Bastias-Candia S, Santos M J, et al. Alzheimer's disease: relevant molecular and physiopathological events affecting amyloid-beta brain balance and the putative role of PPARs [J]. Front Aging Neurosci, 2014, 6: 176.
[11] Inoue H, Jiang X F, Katayama T, et al. Brain protection by resveratrol and fenofibrate against stroke requires peroxisome proliferator-activated receptor alpha in mice [J]. Neurosci Lett, 2003, 352(3): 203-206.
[12] Mortensen O H, Frandsen L,Schjerling P,et al. PGC-1α and PGC-1β have both similar and distinct effects on myofiber switching toward an oxidative phenotype [J]. Am J Physiol Endocrinol Metab,2006,291(4):E807-816.
[13] Chen S D, Lin T K, Yang D I, et al. Protective effects of peroxisome proliferator-activated receptors gamma coactivator-1alpha against neuronal cell death in the hippocampal CA1 subfield after transient global ischemia [J]. J Neurosci Res, 2010, 88(3): 605-613.
[14] Zolezzi J M, Silva-Alvarez C, Ordenes D, et al. Peroxisome proliferator-activated receptor (PPAR) gamma and PPARalpha agonists modulate mitochondrial fusion-fission dynamics: relevance to reactive oxygen species (ROS)-related neurodegenerative disorders? [J]. Piosone, 2013, 8(5): e64019.

