光、温限制后铜绿微囊藻和斜生栅藻的超补偿生长与竞争效应
谢晓玲, 周 蓉, 邓自发
(南通大学生命科学学院, 南通 226007)
光、温限制后铜绿微囊藻和斜生栅藻的超补偿生长与竞争效应
谢晓玲, 周 蓉, 邓自发*
(南通大学生命科学学院, 南通 226007)
研究了铜绿微囊藻(Microcystisaeruginosa)和斜生栅藻(Scenedesmusobliquus)低温和低光照限制后的超补偿效应,以及共培养条件下的竞争效应。结果表明,低温和低光照均显著抑制微藻的生长发育,但低温对铜绿微囊藻的抑制效应更强,而斜生栅藻则对低光胁迫更敏感。经过低光和低温培养后,铜绿微囊藻和斜生栅藻在恢复正常培养时藻细胞密度短期内都表现出超补偿增长效应, 但不同藻类超补偿模式不同,斜生栅藻补偿生长时间不超过1周,而铜绿微囊藻的补偿效应可以持续10天;此外,统计结果表明铜绿微囊藻细胞密度对低温限制解除表现出更显著的补偿生长,斜生栅藻则在低光解除后表现出更强的超补偿效应。微藻叶绿素a指标在光恢复条件下都表现出显著的补偿效应,但温度恢复过程中叶绿素a含量与藻密度增长不同步,低温胁迫对恢复正常培养后微藻叶绿素a的形成产生了一定的负效应;铜绿微囊藻产毒株(912) 在两种恢复模式下脱氢酶活性显著高于对照,产毒株(912)脱氢酶活性的补偿响应明显高于其它两种材料。共培养实验结果表明斜生栅藻同铜绿微囊藻产毒株(912)相比处于竞争劣势,而在同无毒株(469)的共培实验中,尽管连续正常培养情况下两者竞争能力差异不显著,但在恢复培养条件下斜生栅藻竞争能力显著高于后者。因此产毒型铜绿微囊藻低温和低光后的补偿生长效应以及对斜生栅藻的竞争优势可能是蓝藻爆发的内源性机制之一。
铜绿微囊藻(Microcystisaeruginosa);斜生栅藻(Scenedesmusobliquus);超补偿效应;竞争效应;蓝藻爆发
蓝藻爆发是包括海洋在内所有水体最严重的环境问题之一,爆发后果不仅影响生态系统本身的结构和功能,更为重要的是它将严重威胁区域环境质量和水安全,因此有关蓝藻爆发的机制及控制等方面的研究长期以来都是水体生态学关注的热点之一[1- 4]。众所周知,水体富营养化是导致蓝藻爆发的主要原因,然而多项研究指出蓝藻爆发与气候因素存在着密切关系,当营养物质足够维持蓝藻水华的形成时气候因素将是导致蓝藻水华事件的关键[5- 6]。有研究表明温度与光照等气候因子对太湖蓝藻群落种类组成的影响大于营养盐[7],其中温度可能是驱动温带和亚热带湖泊藻类群落更替的主要因子[8]。在全球气候变暖的大背景下蓝藻爆发频繁更受到温度等气候变量短期变化影响[9- 10]。
温度和光照是影响水生微藻的重要环境变量,而低温和低光照是其常常遇到的胁迫因素,不同藻类对这些胁迫具有不同的耐受性[11- 12],并表现出不同生长策略[13]。研究发现一些微藻在遭受低光照等胁迫时生长速度和活力显著降低,但在胁迫解除后藻细胞密度都表现出超补偿生长响应[14- 17]。铜绿微囊藻(Microcystisaeruginosa)是引起蓝藻水华的最重要藻种,尽管已有大量研究证明光照和温度显著影响其种群生长和发育[5,18- 20],但有关低温和低光照胁迫后的补偿生长及其对种群竞争力的影响研究少有报道,而这有可能是蓝藻爆发的重要内源性因素。
本项研究通过比较不同株系铜绿微囊藻以及斜生栅藻(Scenedesmusobliquus)在光温胁迫后的生长过程,探究其是否存在超补偿响应,同时采用共培养实验评估这一过程对其种群竞争力的影响,从而解析蓝藻复苏和爆发机制,并为有效控制水华提供理论依据。
1 材料与方法
1.1 实验材料
本实验所用铜绿微囊藻(Microcystisaeruginosa)产毒株系912和无毒株系469,以及斜生栅藻(Scenedesmusobliquus)均购自中国科学院武汉水生生物研究所淡水藻种库。
1.2 实验方法
1.2.1 藻类的培养
实验选用BG- 11培养基培养[21]。所有培养基和所用器皿均于121℃在高压蒸汽灭菌锅灭菌15min。实验前将铜绿微囊藻和斜生栅藻进行扩大培养。预处理实验设3个组,低光组,低温组和正常对照组;补偿实验设3组:低光组光恢复、低温组温度恢复,正常对照组,同时分为3种藻种独立恢复培养与共培养(竞争实验)两种模式(912+斜生栅藻;469+斜生栅藻), 具体实验条件见表1。光暗比为12 h∶12 h,恒温培养箱静置培养,每天定时人工摇瓶3次。每一实验组合4个重复。
1.2.2 藻细胞密度的测定
自接种之日起每隔72h取样,用血球计数板在显微镜下分别记录铜绿微囊藻和斜生栅藻细胞密度,取样前充分摇动培养瓶使培养液均匀,从而保证取样代表性,每次每瓶镜检3张计数板。前期预处理起始接种密度分别为5.4×105个/mL(912)、5.5×105个/mL(469)和6.3×105个/mL(斜生栅藻);恢复培养与竞争实验起始接种密度分别为4.6×105个/mL(912)、4.7×105个/mL(469)和5.6×105个/mL(斜生栅藻),保证各培养瓶中起始藻密度基本一致。
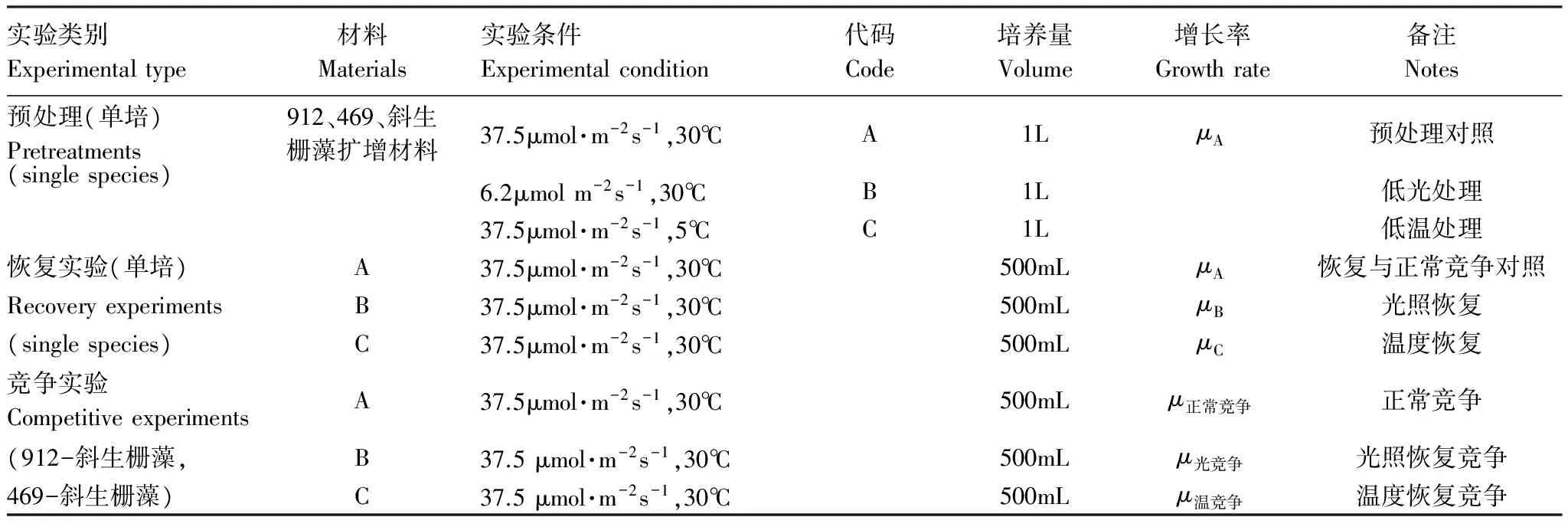
表1 实验设计表
在不同时段统计的藻密度数据基础上,计算不同处理藻细胞比增长率(μ):
μ=ln(xn-xn-1)/(tn-tn-1)
式中,xn为本计数期的细胞密度(个/mL);xn-1为前一计数期的细胞密度(个/mL);tn为对应于xn的培养天数;tn-1为对应于xn-1的培养天数,具体计算以3d为时间周期。
1.2.3 补偿效应和竞争效应的量化分析
根据补偿指数[22]和竞争指数[23]的计算原理,以未经预处理的不同藻种单独正常培养时藻细胞最大比增长率(μA)为基准,分别按照以下公式计算光照和温度恢复培养处理的补偿效应与正常竞争时的竞争效应:
补偿效应光=(μ恢复B-μA)/μA×100%
补偿效应温=(μ恢复C-μA)/μA×100%
竞争效应正常竞争=(μ竞争竞争-μA)/μA×100%
以单独培养的恢复实验时藻细胞最大比增长率(μB和μC)为基准,按照以下公式计算光照和温度恢复时的竞争效应,
竞争效应光恢复=(μ光竞争-μB)/μB×100%
竞争效应温恢复=(μ温竞争-μC)/μC×100%
式中,μA,μB和μC具体含义见表1。
1.2.4 光合色素含量和脱氢酶活性测定
铜绿微囊藻为蓝藻,没有叶绿素b,所以每次取样50mL混合均匀的藻液抽滤并参照文献测定不同培养条件下叶绿素a含量[14], 3次重复; 采用TTC(2,3,5-氯化三苯基四氮唑)-脱氢酶还原法测定藻细胞活性: 取混合均匀藻液50mL离心、弃上清夜, 在三(羟甲基)氨基甲烷盐酸盐(Tris-HCl)缓冲溶液、pH=8.4的反应环境中,加入lmL0.8%的TTC溶液,水浴温度(32±1)℃、发色培养1h,使用双组分萃取剂4mL丙酮和5mL石油醚的混合溶剂进行萃取;同时设置对照;3次重复;用紫外分光光度计(UV- 1200)测定[21]。
1.3 数据处理与统计分析
数据统计分析应用SPSS 18.0软件:在多因素方差分析的基础上,藻细胞密度采用t检验分析不同处理与对照间,以及不同处理间差异显著性,同时应用Mann-Whitney U-test对各密度变化曲线进行差异性检验,并根据差异性的显著程度评估敏感性;以单独正常培养未经预处理的藻种生长数据为对照,计算恢复培养的补偿效应和共培时正常竞争效应,以恢复实验的单独培养数据为对照计算恢复期共培养处理竞争效应,并进行统计分析; 用单因素方差分析(One-way ANOVA)比较不同培养条件下叶绿素a含量与脱氢酶活性,当差异显著时(P<0.05),进一步应用Duncan多重比较检验处理之间的差异性。同时以藻细胞密度为协变量进行协方差分析,从而检验不同培养条件下单个藻细胞相关指标的差异性。绘图应用Origin 8.5。
2 结果与分析
2.1 低光照和低温对不同藻种生长的影响
实验结果表明,同正常培养相比低光照和低温胁迫显著影响铜绿微囊藻和斜生栅藻的正常生长发育。在不同培养条件下铜绿微囊藻两个株系和斜生栅藻表现出类似的生长曲线,12d后密度增加幅度显著降低,逐渐呈水平趋势(图1),期间正常培养条件下的藻密度增加了约25倍,而低光照和低温条件下藻密度仅增加了1倍。同样正常培养体系藻细胞比增长速率显著高于两种逆境处理体系中的。此外,统计分析结果表明铜绿微囊藻和斜生栅藻对这两种胁迫因素的响应也表现出一定的差异:通过对密度变化曲线各时间点藻密度的显著性检验,发现与斜生栅藻相比,铜绿微囊藻在低温条件下表现出更强的抑制效应,而斜生栅藻则对低光更敏感(图1)(Mann-Whitney U-test,P<0.05)。
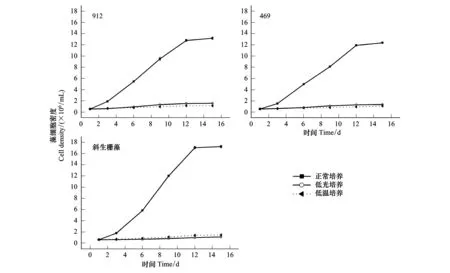
图1 低光照和低温对铜绿微囊藻和斜生栅藻生长的影响(均值±标准误,n=4)Fig.1 The effects of lower illumination and temperature on the growth of M. aeruginosa and S. obliquus (Mean±S.E, n=4)912: 铜绿微囊藻产毒株系912; 469:铜绿微囊藻无毒株系469;
2.2 不同藻株藻细胞密度对光照和温度的补偿效应
从图2可以看出,同正常培养的藻株相比,经过低光和低温培养的铜绿微囊藻和斜生栅藻细胞密度在恢复正常培养条件时都表现出一定的超补偿效应,但不同藻类呈现出不同的超补偿模式。两株铜绿微囊藻在培养的前10d都呈现一定超补偿生长,细胞密度显著高于对照(One-way ANOVA ,P<0.05),但随着培养时间的延长这种补偿生长逐渐消失,第12天时不同处理的藻株基本达到相同的密度;无毒株系469低光和低温解除后较产毒株912的超补偿效应更显著 (图2)(P<0.05)。与铜绿微囊藻相比,斜生栅藻低光和低温解除后正常培养的超补偿效应仅在培养的前7天表现出来,到第8天连续正常培养的藻株密度已经接近光恢复培养材料的藻株,统计结果表明补偿效应持续时间显著短于铜绿微囊藻的(图2)。同样,从图3中可以看出,实验初期恢复培养材料的比增长速率显著高于对照。此外,不同藻类对低光和低温后的超补偿敏感性存在一定的差异性,铜绿微囊藻对低温限制解除表现出更高的敏感性,而斜生栅藻则在低光解除后表现出更强的超补偿效应(P<0.05)。
2.3 不同条件下铜绿微囊藻与斜生栅藻的竞争效应
斜生栅藻分别与产毒(912)和不产毒的铜绿微囊藻(469)共培养实验结果表明,与单独培养相比,共培养体系中无论铜绿微囊藻还是斜生栅藻的藻细胞比增长速率μ和最大密度都显著降低(P<0.05)(图3,图4)。比较3种共培养模式的结果可以看出,经过低光或低温预处理的藻种在恢复正常培养过程中藻细胞密度都较连续正常培养样品的高。从斜生栅藻与两种不同株系的铜绿微囊藻的竞争关系分析,在斜生栅藻与无毒株(469)的共培养体系中藻细胞密度显著高于其同有毒株(912)共培养中的密度,产毒株912产生的微囊藻毒素可能对共培养的斜生栅藻产生了一定的竞争性抑制(图4)。
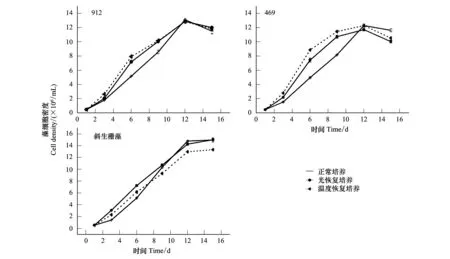
图2 铜绿微囊藻和斜生栅藻光和温度恢复下的补偿生长(均值±标准误,n=4)Fig.2 Overcompensation ofM. aeruginosa and S. obliquus experienced low light and temperature stress (Mean±S.E, n=4)
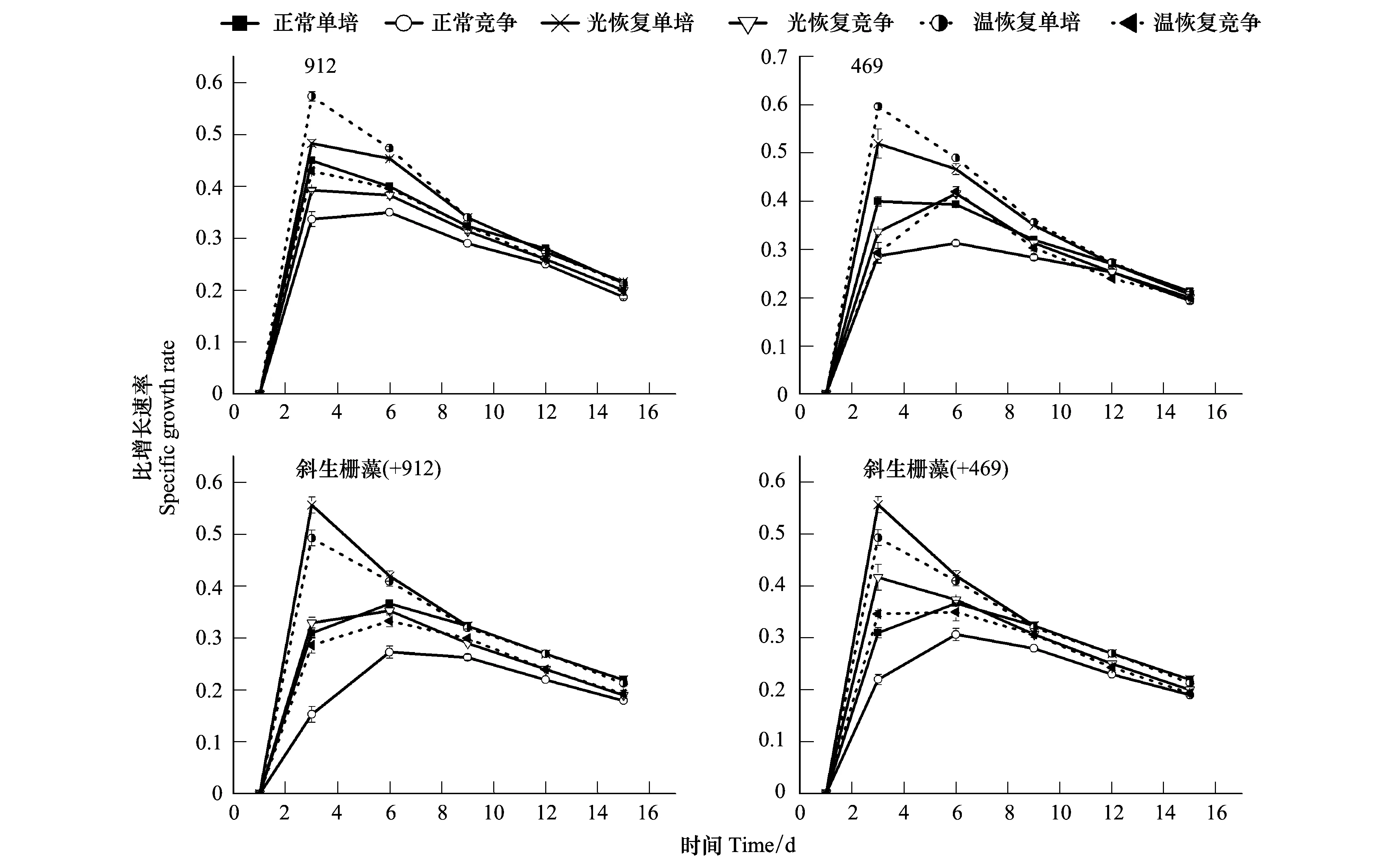
图3 不同条件下铜绿微囊藻与斜生栅藻的藻密度比增长率 (均值±标准误,n=4)Fig.3 Thespecific growth rate of Microcystis aeruginosa and Scenedesmus obliquus under different culture conditions (Mean±S.E, n=4)

图4 不同条件下铜绿微囊藻与斜生栅藻的竞争效应 (均值±标准误,n=4)Fig.4 The competition effects of Microcystis aeruginosa and Scenedesmus obliquus under different culture conditions (Mean±S.E, n=4)
量化分析补偿期内不同藻株的补偿生长结果表明,斜生栅藻在光照恢复的情况下补偿效应显著高于铜绿微囊藻的,而温度恢复时与产毒株912的差异不显著,但显著低于无毒株469的补偿效应(图5);无毒株469在光照和温度恢复正常后的补偿生长能力显著高于产毒株912的。敏感性分析结果表明铜绿微囊藻对温度表现出更高的敏感性(图5),而斜生栅藻对光照强度更敏感(图5)(P<0.05)。
量化分析结果表明,未经胁迫预处理的共培体系中斜生栅藻细胞增殖被竞争抑制的幅度显著高于共培的产毒株912的,而与共培的无毒株469差异不显著。尽管在经过低光或低温胁迫预处理后的共培体系中斜生栅藻的抑制程度降低,但还是显著高于产毒株被抑制率(P<0.05)。与无毒株469相比,两种藻类在连续正常培养情况下竞争能力相当,而在恢复培养的处理中斜生栅藻对469生长和扩增的抑制效应远大于469对斜生栅藻的,即斜生栅藻具有更强的竞争能力(P<0.05)。
2.4 不同培养条件对铜绿微囊藻和斜生栅藻叶绿素a含量的影响
同正常培养相比,限光和低温处理都显著降低了培养体系单位体积中叶绿素a的含量;两种胁迫处理比较限光培养体系显著低于低温处理下的;3种藻株之间差异不显著(图6)。结合不同培养体系中藻密度数据进行协方差分析结果表明,在限光和低温处理下单个藻细胞叶绿素a含量与正常培养条件下的差异不显著(P>0.05)。
在光恢复培养的条件下,实验藻叶绿素a含量都显著高于连续正常培养的和经过低温处理后温度恢复的相应样品,而温度恢复培养的藻株叶绿素a含量显著低于另外两类相应样品的,其中尤以产毒株912叶绿素a含量差异最显著(图6)。光恢复培养的条件下3个藻株叶绿素a含量都表现出一定程度的超补偿效应,而经过低温处理后即使恢复正常温度,叶绿素a含量并未表现出超补偿效应,而藻密度在此情况下表现出较强的超补偿效应(图5),两个指标表现出不同步性,说明低温预处理直接影响了后期正常培养时藻类叶绿素a的合成。
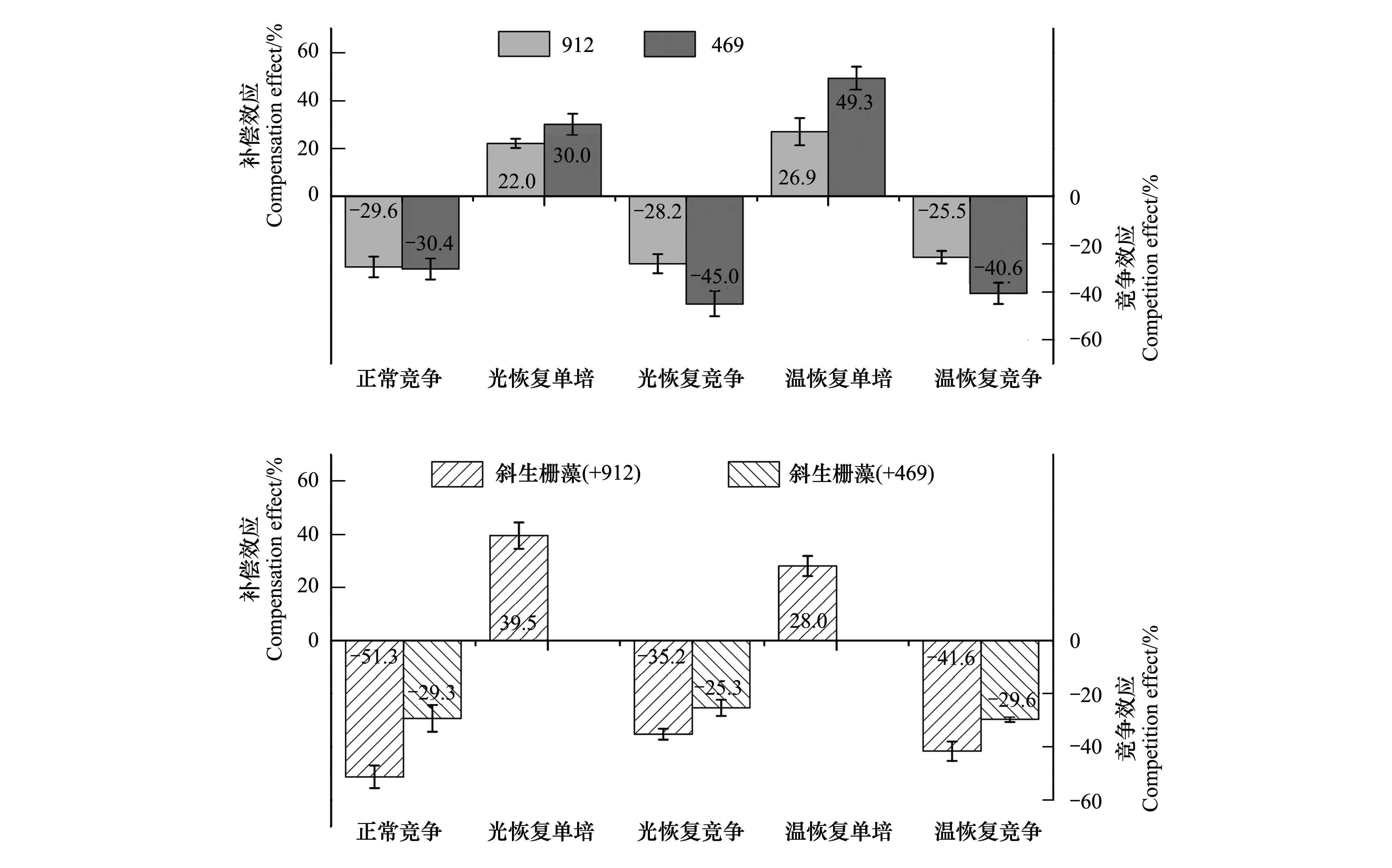
图5 不同培养体系中铜绿微囊藻和斜生栅藻的补偿效应和抑制效应(均值±标准误,n=4)Fig.5 The compensation effects and inhibitory effects of M. aeruginosa and S. obliquus under different culture systems (Mean±S.E, n=4)
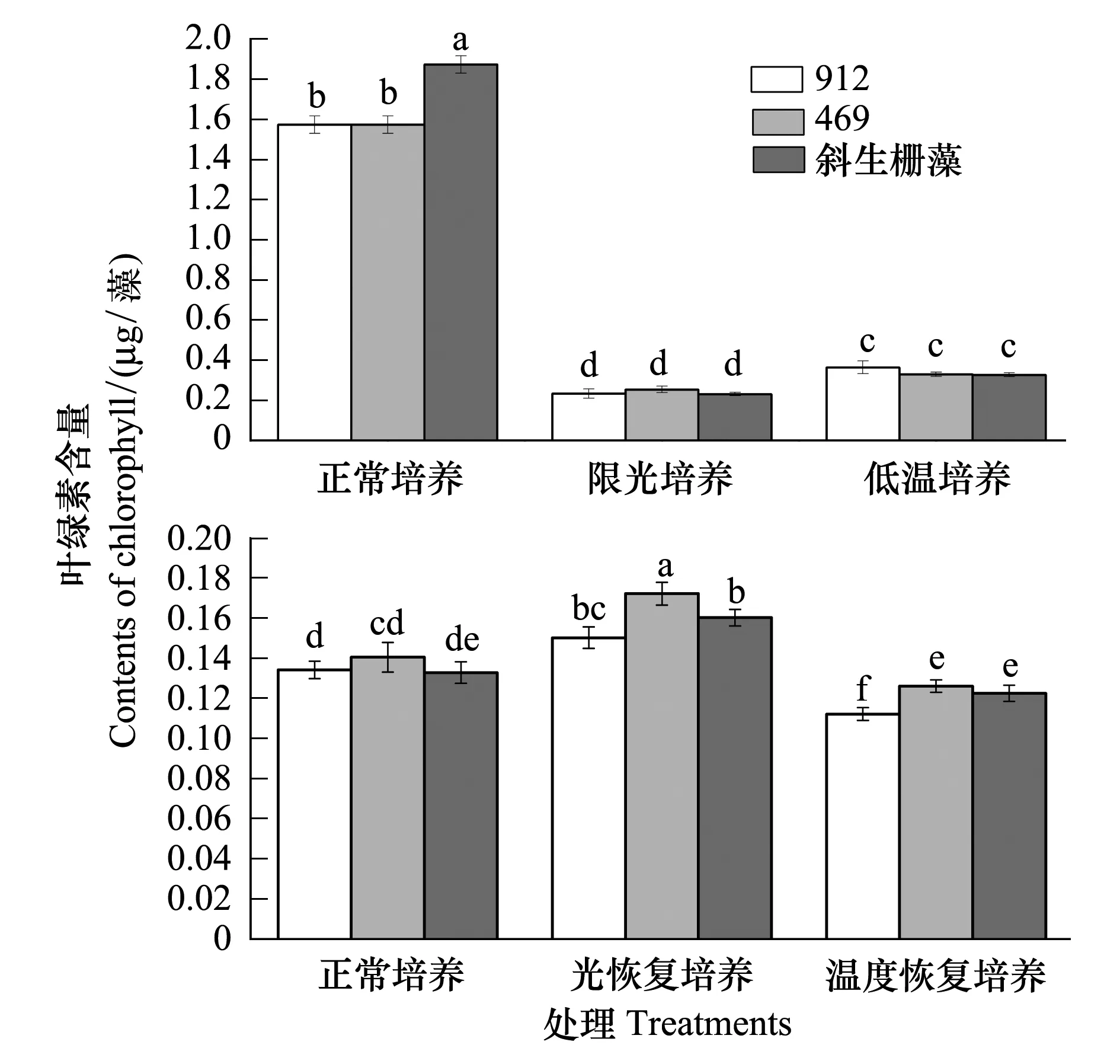
图6 不同培养条件下铜绿微囊藻和斜生栅藻叶绿素含量的差异Fig.6 The differences of content of chlorophyll of M. aeruginosa and S. obliquus under different culture systems平均值±标准误,不同字母表示差异显著, P<0.05, n=4
2.5 不同培养条件对铜绿微囊藻和斜生栅藻脱氢酶活性的影响
低温和限光培养体系中3种藻细胞脱氢酶活性都显著低于正常培养体系中的,而两种胁迫处理间差异不显著;3种藻株之间比较可以看出限光和低温胁迫下铜绿微囊藻产毒株(912)藻细胞脱氢酶活性都显著高于其它两种藻细胞脱氢酶活性(图7)。协方差分析结果表明在限光和低温胁迫条件下单个藻细胞脱氢酶活性显著高于正常培养的(P<0.05)。单个藻细胞脱氢酶活性的提高可能是对限光和低温胁迫的应急响应。
在单独培养体系中,铜绿微囊藻和斜生栅藻脱氢酶活性对不同恢复条件响应模式不完全相同,而且铜绿微囊藻不同株系的响应也存在差异。产毒株912在两种恢复培养模式下脱氢酶活性都有极显著提高(P<0.01),而无毒株469仅在光恢复条件下极显著提高(P<0.01),在温度恢复条件下脱氢酶活性与对照(正常培养)相比差异不大(P>0.05),斜生栅藻脱氢酶对不同处理的响应模式与469相似(图7)。
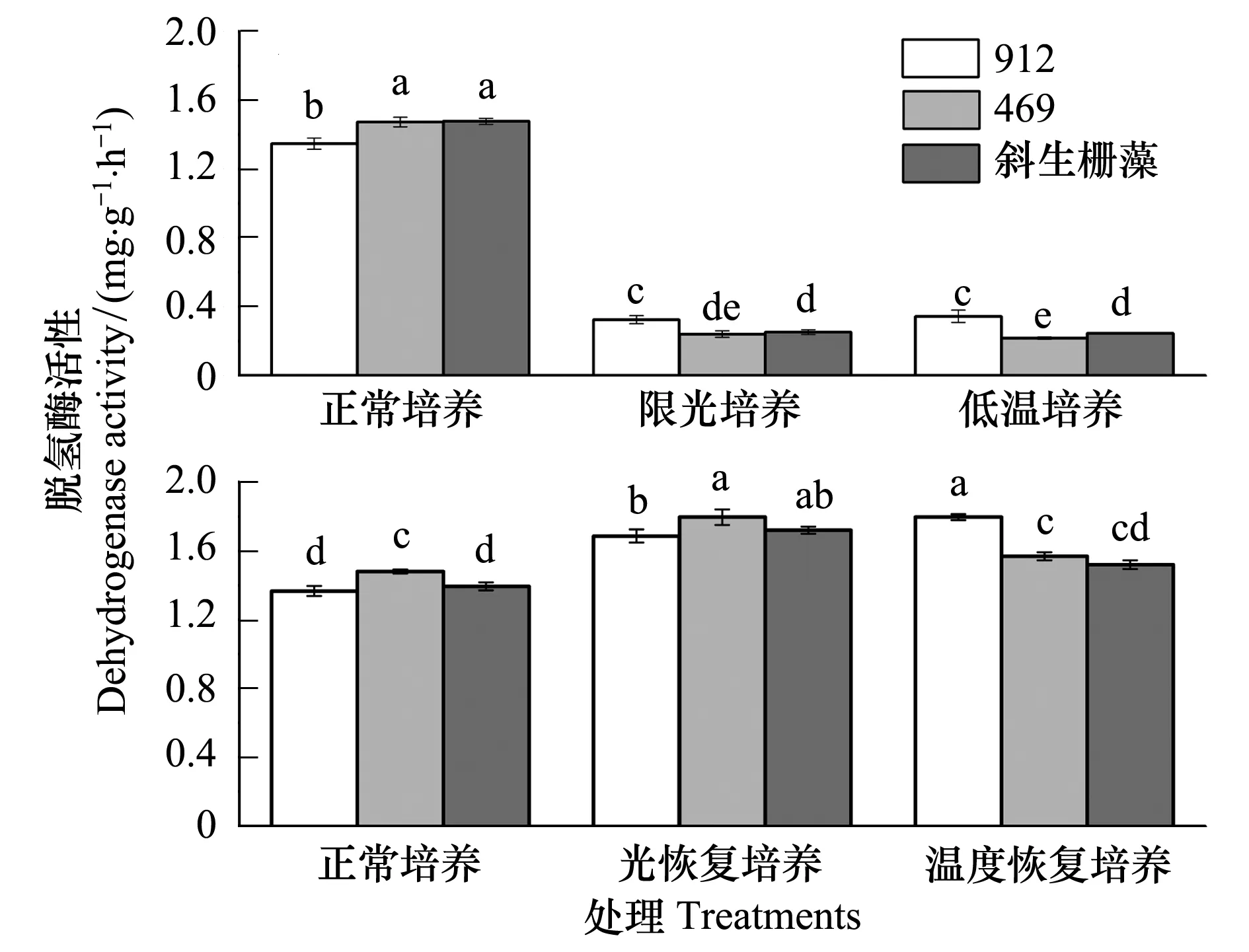
图7 不同培养条件下铜绿微囊藻和斜生栅藻脱氢酶活性的差异 Fig.7 The differences of activity of dehydrogenase of M. aeruginosa and S. obliquus under different culture systems
3 讨论
植物在逆境胁迫下生长速率往往表现出一定程度降低,在胁迫解除之后, 植物将逐渐恢复其生长能力,甚至表现出超过正常生长速率的现象,即超补偿生长。超补偿反应是植物对抗波动环境的一种适应对策,是植物在与环境的长期博弈中形成的抗逆机理的重要组成部分[22]。藻细胞密度是表征浮游植物种群生物量最真实的指标,研究发现蛋白核小球藻(Chlorellapyrenoidosa)、三角褐指藻(Phaeodactylumtricornutum)、绿色巴夫藻(Pavlovaviridis)、四列藻(Tetraselmistetrethele)等在暗处理等胁迫解除后藻细胞密度都表现出超补偿生长现象[14- 17]。本研究表明铜绿微囊藻和斜生栅藻在低温和低光照逆境解除后的恢复生长过程中藻细胞密度短期内都表现出显著的超补偿生长效应。与斜生栅藻相比,铜绿微囊藻补偿性生长虽然启动稍晚,但启动后藻细胞密度快速增加,且持续时间长于斜生栅藻,尤其是低温解除后蓝藻的补偿生长效应更加明显,这将为高温情况下蓝藻优势地位的建立和维持奠定基础,这和谭啸等[24]模拟升温对藻类复苏研究结果基本一致。尽管低温和低光照显著抑制了铜绿微囊藻的生长,但9℃以上铜绿微囊藻和斜生栅藻都可复苏,但前者复苏后的生长速率高于后者,并且随着温度的升高蓝藻的优势更加明显[25]。在全球气候变化的大背景下,温度短期变化的幅度和频率明显增加,这种短期变温刺激将诱发蓝藻超补偿生长,藻类群落组成结构将发生改变,蓝藻数量显著增加,因此在营养足够的情况下蓝藻爆发频率和规模很有可能增加。
种间竞争在植物群落构建和维持中扮演着极其重要的角色,不同植物针对某一种或某些生态因子往往具有不同的竞争能力,而竞争能力强的物种将在群落组成和功能作用上占主导地位。一般情况下生物群落的物种组成处于动态平衡中,但当环境发生变化而导致某一种或某几种生物在种间竞争中占绝对优势时其数量将快速增长,蓝藻爆发就是典型的例证,研究发现春末夏初气温回暖时太湖藻类群落组成发生了显著改变:蓝藻取代了绿藻成为优势种[26- 27]。本实验结果中,与单种培养对照相比,铜绿微囊藻和斜生栅藻共培养时两种藻类的细胞增长速率和最大密度呈现出显著降低趋势,说明两种藻类存在明显的相互竞争。绿藻、硅藻和蓝藻是大多数淡水水体最主要的藻类,当气温较低时绿藻和硅藻更占优势,随着温度的升高蓝藻更具竞争优势[28]。通过比较斜生栅藻分别与产毒株912和无毒株469竞争结果可以看出,同912共培养过程中产生的微囊藻毒素对斜生栅藻可能产生了毒害作用,铜绿微囊藻可通过产生微囊藻毒素增强其竞争能力[29- 33]。因此,微囊藻毒素可能是产毒性微囊藻在群落中优势地位建立和巩固的重要机制之一。
应用叶绿素a含量表征浮游植物初级生产力和水体营养化水平已有很长的历史,尽管有研究表明用叶绿素a含量表征浮游藻类生物量存在一定的问题[33],但到目前为止还没有一个更快速、简便而相对准确的指标来替代它[35- 37]。叶绿素a是浮游植物中最主要的光合色素,占浮游藻类干重的1%—2%,其含量的高低与藻类对光能吸收效率和利用效率都显著相关,其值越大说明光合同化率越高[34]。叶绿素a含量又随藻类种类、温度、光照等因素的变化而异,低温和低光照都直接降低了浮游植物种群叶绿素含量[38]。同对照相比,低光照胁迫解除后3种实验藻叶绿素a含量与细胞密度的增长幅度基本一致,因此低光照胁迫并未影响叶绿素a的生物合成能力,研究表明虽然大多数植物叶绿素合成的通路是光依赖性的,但部分藻类还具有在黑暗条件下合成叶绿素的辅助通路[39]。尽管低温胁迫下单个藻细胞叶绿素a含量没有显著变化,但在低温胁迫解除后的恢复性生长过程中叶绿素含量显著低于相应对照,由此说明低温预处理仍然对藻细胞叶绿素合成能力造成了影响,在恢复培养的过程中藻细胞密度表现出了补偿性生长,叶绿素a的合成能力未能完全恢复,从而表现出叶绿素a增长幅度与细胞密度增加并非同步。这一结果也证明有些情况下叶绿素a含量并不能很好的表征藻细胞密度[34]。
脱氢酶是一类氧化还原酶,参与了生物体氨基酸合成和降解、丙酮酸的氧化、光合作用、戊糖磷酸途径、氧化磷酸化、脂肪的氧化和合成等过程,是生物生命活动过程中极其重要的酶类[21]。由于脱氢酶只有活细胞体才能产生,所以生物体的脱氢酶活性(DHA)是细胞活力的最重要表征指标之一,通过检测藻细胞脱氢酶活性可以体现出藻细胞生命力[21,40- 41]。同对照相比,经过低光照或低温预处理后恢复生长的藻细胞脱氢酶活性都有一定程度的提高,尤其是产毒株912经过低温胁迫解除后的恢复生长过程中脱氢酶活性显著提高。同时3种藻响应模式表现出一定的差异,在低温胁迫解除后铜绿微囊藻无毒株469和斜生栅藻脱氢酶活性都显著低于光恢复培养状态的。结合低温和低光照胁迫解除后3种藻细胞密度的增长可以发现,虽然斜生栅藻和无毒株469藻细胞密度都呈现出较明显的补偿生长,但经过低温后的恢复生长过程藻细胞活性并未达到正常水平,而铜绿微囊藻产毒株不仅藻细胞密度增长迅速,细胞活力也得到恢复或提高,由此可见其抗低温胁迫能力明显高于另外两种藻类。因此铜绿微囊藻产毒株低温和低光照逆境胁迫后的补偿性生长和对其它藻类的竞争优势可能是蓝藻爆发的重要内源性机制。
4 结论
蓝藻生长和水华形成历经休眠、复苏、增殖和爆发四个阶段,在营养保证的前提下温度和光照是促进蓝藻细胞迅速增殖,种群密度急剧增加的关键因素,不同藻类对环境变化的响应以及种间竞争能力的差异是蓝藻爆发的内源机制。本研究中低温和低光照均显著抑制微藻的生长发育,但铜绿微囊藻在低温条件下表现出更强抑制,而斜生栅藻则对低光胁迫更敏感。在光温恢复正常的条件下各种藻细胞密度增长短期内都表现出超补偿效应,但不同藻类超补偿模式不同,斜生栅藻补偿生长时间不超过1周,而铜绿微囊藻的补偿效应可以持续10d;铜绿微囊藻细胞密度对低温限制解除表现出更显著的补偿生长,而斜生栅藻则在低光解除后表现出更强的超补偿效应。竞争实验结果表明铜绿微囊藻产毒株(912)对斜生栅藻具有显著的竞争优势,而无毒株(469)对斜生栅藻则不具有竞争优势,因此微囊藻毒素可能是产毒型微囊藻在群落中优势地位建立和巩固的重要机制之一。温度恢复条件下藻类叶绿素a含量并未表现出与藻密度增长同步,低温胁迫可能对微藻叶绿素a的形成产生了一定的负效应。脱氢酶是表征藻类细胞活力的重要指标,产毒株(912)脱氢酶活性的补偿响应显著高于无毒株(469)和斜生栅藻的。因此产毒型铜绿微囊藻低温和低光后的补偿生长效应以及对斜生栅藻的之一竞争优势可能是蓝藻爆发的重要内源性机制。
致谢:感谢美国北卡大学教堂山分校(University of North Carolina at Chapel Hill)生物系Peter S. White教授润色英文摘要;南通大学孙政玺、于珍、赵莉莉、汪情等同学参与部分实验工作,特此致谢。
[1] Kong F X, Gao G. Hypothesis on cyanobacteria bloom-forming mechanism in large shallow eutrophic lakes. Acta Ecologica Sinica, 2005, 925(3): 589- 595.
[2] Kong F X, Ma R H, Gao J F, Wu X D. The theory and practice of prevention, forecast and warning on cyanobacteria bloom in Lake Taihu. Journal of Lake Science, 2009, 21(3): 314- 328.
[3] Paerl H W, Otten T G. Harmful Cyanobacterial Blooms: Causes, Consequences, and Controls. Microb Ecology, 2013, 65: 995- 1010.
[4] Wang C Y, Yu Y, Sun Y K, Li H L,Kong F X, Zhang M, Shi X L, Yang Z. The discussion of the early forecasting of cyanobacteria bloom in the Lake Taihu based on ELCOM-CAEDYM model. China Environmental Science, 2013, 33(3): 491- 502.
[5] Paul V J. Global warming and cyanobacterial harmful algal blooms. Advances in Experimental Medicine and Biology, 2008, 619: 239- 257.
[6] Zhang M,Duan H, Shi X, Yu Y, Kong F X. Contributions of meteorology to the phenology of cyanobacterial blooms: implications for future climate change. Water Research, 2012, 46(2): 442- 452.
[7] Gu T T, Kong F X, Tan X, Yu Y. Investigation on spatio-temporal pattern of cyanobacterial community structure by T-RFLP during overwinter and recruitment period in Taihu Lake. Acta Ecologica Sinica, 2011, 31(1): 21- 30.
[8] Grover J P, Chrzanowski T H. Seasonal dynamics of phytoplankton in two warm temperate reservoir: association of taxonomic composition with temperature. Journal of Plankton Research, 2005, 27(10): 1- 7.
[9] Huber V, Wagner C, Gerten D, Adrian R. To bloom or not to bloom: contrasting responses of cyanobacteria to recent heat waves explained by critical thresholds of abiotic drivers. Oecologia, 2012, 169(1): 245- 256.
[10] Paerl H W, Otten T G. Harmful cyanobacterial blooms: causes, consequences, and controls. Microb Ecology, 2013, 65(4): 995- 1010.
[11] Eilertsen H C, Degerlund M. Phytoplankton and light during the northern high-latitude winter. Journal of Plankton Research, 2010, 32(6): 899- 912.
[12] Clegg M R, Gaedke U, Boehrer B, Spijkerman E. Complementary ecophysiological strategies combine to facilitate survival in the hostile conditions of a deep chlorophyll maximum. Oecologia, 2012, 169(3): 609- 622.
[13] Laabir M, Jauzein C, Genovesi B, Massere E, Grzebyk D, Cecchi P, Vaquer A,Perrin Y, Collos Y. Influence of temperature, salinity and irradiance on the growth and cell yield of the harmful red tide dinoflagellateAlexandriumcatenellacolonizing Mediterranean waters. Journal of Plankton Research, 2011, 33(10): 1550- 1563.
[14] Duan S S, Guo Y F, Liu Z Q,Li A F, Xu N, Zhang Y N, Chen H. Overcompensatory growth of Tetraselmistetretheleunder the stress of nutrients deficiency. Acta Ecologica Sinica, 2003, 23(7) : 1297- 1304.
[15] Zhang Z P, Duan S S, Liu Z Q,Li A F, Xu N. Overcompensation response ofNannochloropsisoculataunder the darkness stress. Journal of Jinan University (Natural Science) , 2005, 26(3): 412- 416.
[16] Liu X J, Duan S S, Li A F. The effect of overcompensatory growth inPavlovaviridisafter UV-B stress treatments. Acta Ecologica Sinica , 2006, 26(6): 1763- 1771.
[17] Cai Z P, Duan S S, Wei W. Darkness and UV radiation provoked compensatory growth in marine phytoplanktonPhaeodactylumtricornutum(Bacillariophyceae). Aquaculture Research, 2009, 40(13): 1559- 1562.
[18] Chen X C, Sun Y C, Zeng X W, Li C J, Kong H N. The inhibition of low light intensity on the growth ofMicrocystisaeruginosain raw water. China Environmental Science, 2007, 27(3): 352- 355.
[19] Wu R, Cui L F, Lou S, Shi Y. The influence of temperature and illumination on theMicrocystisproduction. Environmental Science & Technology, 2010, 33(6): 33- 36.
[20] Zeng J, Wang W X.Temperature and irradiance influences on cadmium and zinc uptake and toxicity in a freshwater cyanobacterium,Microcystisaeruginosa. Journal of Hazardous Materials, 2011, 190: 922- 929.
[21] Xie J, Hu W R, Pei H Y. Detection of amount and activity of living algae in fresh water by dehydrogenase activity (DHA). Environ Monit Assess, 2008, 146: 473- 478.
[22] Tommy L, Tuomi J, Nilsson P. Evidence for an evolutionary history of overcompensation in the grassland biennialGentianellacampestris(Gentianaceae). American Naturalist, 1997, 149, 6: 1147- 1155.
[23] Weigelt A, Jolliffe P. Indices of plant competition. Journal of ecology, 2003, 91: 707- 720.
[24] Tan X, Kong F X, Yu Y, Shi X L. Effects of enhanced temperature on algae recruitment and phytoplankton community succession. China Environmental Science, 2009, 29(6): 578- 582.
[25] Tang J, Song L R, Sun S S, Wei H H, Wan N. Recruitment ability ofMicrocystisaeruginosaunder low light-low temperature combination. Enviromental Science (Chinese), 2010, 31(12): 2933- 2937.
[26] Hu X Z, Jin X C, Chu Z S, Ma Z Y, Yi L W. Light competition betweenMicrocystisaeruginosaandScendesmusquadricaudafrom Taihu lack and the dominance process simulation in microcosm. Journal of Agro-Environment Science, 2005, 24(3): 538- 543.
[27] Xing P, Kong F X, Cao H S, Zhang M. Relationship between bacterioplankton and phytoplankton community dynamics during late spring and early summer in lake Taihu. Acta Ecologica Sinica, 2007, 27(5): 1696- 1702.
[28] Zhang Z B, Shi X L, Liu G J, Yang X Y, Wang Y N, Liu X J. The relationship between planktonic algae changes and the water quality of the West Lake, Hangzhou, China. Acta Ecologica Sinica, 2009,29(6): 2980- 2987.
[29] Deblois C P, Juneau P. Comparison of Resistance to Light Stress in Toxic and Non-Toxic Strains ofMicrocystisaeruginosa(Cyanophyta). Journal of Phycology, 2012, 48(4): 1002- 1011.
[30] El-Shehawy R, Gorokhova E, Fernandez-Pinas F, del Campo F F. Global warming and hepatotoxin production by cyanobacteria: What can we learn from experiments?. Water Research, 2012, 46: 1420- 1429.
[31] Li D M, Kong F X, Shi X L, Ye L L,Yu Y, Yang Z. Quantification of microcystin-producing and non-microcystin producingMicrocystispopulations during the 2009 and 2010 blooms in Lake Taihu using quantitative real-time PCR. Journal of Environmental Sciences, 2012, 24(2) 284- 290.
[32] Li Y X , Li D H. Competition between toxicMicrocystisaeruginosaand nontoxicMicrocystiswesenbergiiwith Anabaena PCC7120. Journal of Applied Phycology, 2012, 24: 69- 78.
[33] Harel M, Weiss G, Lieman-Hurwitz J, Lebendiker M,Temper V, Block C,Sukenik A, Zohary T, Braun S, Carmeli S, Kaplan A. Interactions betweenScenedesmusandMicrocystismay be used to clarify the role of secondary metabolites. Environmental Microbiology Reports, 2013, 5(1): 97- 104.
[34] Kruskopf M, Flynn K J. Chlorophyll content and fluorescence responses cannot be used to gauge reliably phytoplankton biomass, nutrient status or growth rate. New Phytologist, 2006, 169: 525- 536.
[35] Huot Y, Babin M, Bruy`ant F. Does chlorophyll a provide the best index of phytoplankton biomass for primary productivity studies? Biogeosciences Discuss, 2007, 4: 707- 745.
[36] Todd V R, Mark B D, Lowell E G. Chlorophyll-a as a criterion for establishing nutrient standards in the streams and rivers of Illinois. Journal of Environmental Quality, 2008, 37: 437- 447.
[37] Boyer J N, Kelble C R, Ortner P B, Rudnick D T. Phytoplankton bloom status: Chlorophyll a biomass as an indicator of water quality condition in the southern estuaries of Florida, USA. Ecological Indicators, 2009, 9: 56- 67.
[38] Shaaban A M, Mansour H A, Saber A A. Relationships between total chlorophyll and phytoplankton individuals of Rosetta branch of River Nile, Egypt. International Research Journal of Biochemistry and Bioinformatics, 2011, 1(10) : 257- 265.
[39] Wu Q Y, Vermaas W F J. Light-dependent chlorophyll a biosynthesis upon chlL deletion in wild-type and photosystem I-less strains of the cyanobacteriumSynechocystissp. PCC 6803. Plant Molecular Biology, 1995, 29: 933- 945.
[40] Liang W Y, Wang K, Ruan Q Y, Wang J L. Viability determ ination ofMicrocystisaeruginosaby TTC-dehydrogen as eassay. Acta Scientiae Circumstantiae, 2008, 28 (9): 1745- 1750.
[41] Hoch M P, Dillon K S, Coffin R B, Cifuentes L A. Sensitivity of bacterioplankton nitrogen metabolism to eutrophication in sub-tropical coastal waters of Key West, Florida. Marine Pollution Bulletin, 2008, 56: 913- 926.
参考文献:
[1] 孔繁翔, 高光. 大型浅水富营养化湖泊中蓝藻水华形成机理的思考. 生态学报, 2005, 25(3): 589- 595.
[2] 孔繁翔, 马荣华, 高俊峰, 吴晓东. 太湖蓝藻水华的预防、预测和预警的理论与实践. 湖泊科学, 2009, 21(3): 314- 328.
[4] 王长友, 于洋, 孙运坤, 李洪利, 孔繁翔, 张民, 史小丽, 阳振. 基于ELCOM- CAEDYM模型的太湖蓝藻水华早期预测探讨. 中国环境科学 2013, 33(3): 491- 502.
[7] 顾婷婷, 孔繁翔, 谭啸,于洋. 越冬和复苏时期太湖水体蓝藻群落结构的时空变化. 生态学报, 2011, 31(1): 21- 30.
[14] 段舜山, 郭羽丰, 刘振乾, 李爱芬, 徐宁, 张亚楠, 陈洁. 四列藻在营养限制胁迫下的超补偿生长研究. 生态学报, 2003, 27(7): 1297- 1304.
[15] 张珍萍, 段舜山, 刘振乾, 李爱芬, 徐宁. 眼点拟微绿球藻在黑暗胁迫下的超补偿生长响应. 暨南大学学报(自然科学与医学版), 2005, 26(3): 412- 416.
[16] 刘晓娟,段舜山,李爱芬. 绿色巴夫藻在UV- B胁迫后的生长补偿效应.生态学报, 2006, 26(6): 1763- 1771.
[18] 陈雪初, 孙扬才, 曾晓文, 李春杰, 孔海南. 低光照度对源水中铜绿微囊藻增殖的抑制作用. 中国环境科学, 2007, 27(3): 352- 355.
[19] 吴溶, 崔莉凤, 卢珊, 时寅. 温度光照对铜绿微囊藻生长及藻毒素释放的影响. 环境科学与技术, 2010, 33(6): 33- 36.
[22] 王海洋,杜国祯,任金吉. 种群密度和施肥对垂穗披碱草刈割后补偿作用的影响. 植物生态学报,2003, 27(4): 477- 483.
[24] 谭啸, 孔繁翔, 于洋, 史小丽,张民. 升温过程对藻类复苏和群落演替的影响.中国环境科学,2009, 29(6):578- 582.
[25] 汤俊, 宋立荣, 孙松松, 魏海慧, 万能. 低光低温联合作用对铜绿微囊藻复苏能力的影响. 环境科学, 2010, 31(12): 2933- 2937.
[26] 胡小贞, 金相灿, 储昭升, 马祖友, 易文利. 太湖铜绿微囊藻与四尾栅藻的光竞争及模拟优势过程初探. 农业环境科学学报, 2005, 24(3): 538- 543.
[27] 邢鹏, 孔繁翔, 曹焕生, 张民. 太湖浮游细菌与春末浮游藻类群落结构演替的相关分析. 生态学报, 2007, 27(5): 1696- 1702.
[28] 张志兵,施心路, 刘桂杰, 杨仙玉,王娅宁, 刘晓江. 杭州西湖浮游藻类变化规律与水质的关系. 生态学报,2009,29(6): 2980- 2987.
[40] 梁文艳, 王珂, 阮清鸳, 王金丽. TTC- 脱氢酶还原法测定铜绿微囊藻活性. 环境科学学报, 2008, 28 (9): 1745- 1750.
Overcompensation and competitive effects ofMicrocystisaeruginosaandScenedesmusobliquusafter low temperature and light stresses
XIE Xiaoling, ZHOU Rong, DENG Zifa*
SchoolofLifeScience,NantongUniversity,Nantong226007,China
Changes of temperature and light significantly influence the growth and activity of phytoplankton. To explore the effects of these two variables on the cyanobacterial blooms, we analyzed the growth ofMicrocystisaeruginosaandScenedesmusobliquus, as well as the competition between the two species, under conditions of low temperature and low light, and under conditions of release from these two stress factors. The results showed that low temperature and low light significantly inhibited the growth of microalgae. Low temperature led to a stronger inhibitory effect onM.aeruginosathan low light did; however, the growth inhibition ofS.obliquuswas more sensitive to low light than to low temperature. After release from low temperature or limiting light, all of the experimental taxa exhibited the overcompensation growth within a limited time and this response varied by species. TwoM.aeruginosastrains showed a greater response to increased temperature than increased light. However, overcompensation ofS.obliquuswas greater in response to increased light than increased temperature. When the species were grown together, results showed that under all culture conditions, the toxicMicrocystisstrains (912) had a competitive advantage overS.obliquus. Although there was no significant difference between the competitive ability of the nontoxicMicrocystisstrain (469) andS.obliquusunder the normal, the former (469) showed a competitive disvantage toS.obliquusunder conditions of release from low light and low temperature. Chlorophyll-a content of all experimental algae overcompensated when released from light limitation. In the temperature experiments, the increase of chlorophyll-a content and algal density were asynchronism for all species, and cryogenic pre-treatment had a negative after-effect on microalgae chlorophyll-a content under release from low temperature. The response of dehydrogenase activity of algae when released from low temperature or low light stress varied with algae species, and the compensating increase of dehydrogenase activity of toxic strains (912) was significantly higher than that of the other two taxa. The results suggested that higher the compensatory growth of toxicMicrocystisas well as its competitive advantage overS.obliquuswhile released from low temperature and light stresses, might be the important mechanisms that result in blue-green algae bloom.
Microcystisaeruginosa;Scenedesmusobliquus; overcompensation; competitive effect; Cyanobacterial bloom
国家重点研究发展计划(2008CB418201); 江苏省高校“青蓝工程-中青年学术带头人”项目;南通大学“创新人才”项目
2013- 06- 13;
2013- 10- 28
10.5846/stxb201306131698
*通讯作者Corresponding author.E-mail: dengzifa@126.com
谢晓玲, 周蓉, 邓自发.光、温限制后铜绿微囊藻和斜生栅藻的超补偿生长与竞争效应.生态学报,2014,34(5):1224- 1234.
Xie X L, Zhou R, Deng Z F.Overcompensation and competitive effects ofMicrocystisaeruginosaandScenedesmusobliquusafter low temperature and light stresses.Acta Ecologica Sinica,2014,34(5):1224- 1234.

