鱼皮胶原蛋白海绵组织相容性的体内实验研究
方 成 汪海波 梅智强 肖显杰 刘 立 王加谋 王忠稳
1(武汉轻工大学移植工程实验室,武汉 430023)2(武汉轻工大学化学与环境工程学院,武汉 430023)
鱼皮胶原蛋白海绵组织相容性的体内实验研究
方 成1*汪海波2梅智强1肖显杰1刘 立1王加谋1王忠稳2
1(武汉轻工大学移植工程实验室,武汉 430023)2(武汉轻工大学化学与环境工程学院,武汉 430023)
为评价鱼皮胶原蛋白海绵作为植入型生物材料的组织相容性,对草鱼皮胶原海绵的体内细胞附着性、免疫原性、致炎性、稳定性与形变进行了实验研究,并与猪皮胶原海绵相比较。鱼皮酸溶性胶原蛋白(FA)、鱼皮酶溶性胶原蛋白(FP)和猪皮酶溶性胶原蛋白(PP)海绵均为细纤维组成疏松多孔显微结构。2 mm× 2 mm × 8 mm杆状胶原海绵植入SD大鼠后肢(每组n=6)长收肌1周,3种材料内部均有大量有核细胞入驻。比较炎性细胞浸润面积,FP组((7.93 ± 0.77)mm2)与PP组((7.49 ± 1.03)mm2)没有显著差异,FA组((9.81 ± 1.42)mm2)与其他两组具有显著性差异。FP组材料截面变形但边缘清晰,疏松纤维结构完整。FA组材料边缘模糊,内部见散在断裂纤维。PP组材料边缘已失去,未见纤维结构。昆明小鼠(每组n=5)接受胶原蛋白溶液注射后检测血清特异性IgG水平,酶联免疫吸光度值FA组(0.602 ± 0.036)、FP组(0.518 ± 0.019)、PP组(0.390 ± 0.085),仅FA组与PP组间有显著性差异。以上结果显示三种材料均适于细胞附着,FP的免疫原性及致炎性接近于PP,FP海绵体内稳定性好于FA海绵与PP海绵。实验结果表明3种检测材料中鱼皮酶溶性胶原海绵(FP)具有组织相容性优势。
草鱼;猪;皮肤;胶原;组织相容性
引言
胶原蛋白是生物组织中的一种主要结构蛋白,对器官形成及功能表达具有重要作用。以胶原蛋白材料构建细胞外基质支架(scaffolds)用于医学组织工程和损伤组织再生,是天然胶原的前沿应用领域之一。组织再生过程包括组织诱导、组织传导、组织塑型的共同作用[1-2]。理想的组织再生需实现坏死组织清除及原位实质母细胞的聚集与分化;细胞高效增殖和分布,减少纤维化;实质细胞及基质更替重构以适应功能。人工生物材料可以具有增强诱导及减少重构的作用,但其核心作用是利于细胞增殖和分布,需要具备生物相容的综合性能,包涵组织相容、血液相容和毒性等方面要求[3]。
哺乳动物Ⅰ型胶原蛋白材料因综合性能优良而被广泛利用[4]。但对脊椎动物与人类共患传染病的忧虑难以消除,如牛海绵状脑病、猪流感、禽流感等[5]。从2009年农业部同卫生部颁布的《人畜共患传染病名录》中,可以发现从鱼类来源的共患传染病甚少。鱼加工副产物(鱼皮和鱼鳞)中可提取Ⅰ型胶原蛋白[6-8]。对南亚野鲮(Rohu)鱼鳞胶原蛋白材料的实验报道其具有较低的免疫原性,不抑制体外细胞株增殖[8]。中国渔业的资源较丰富,可为鱼源胶原的开发供给充足的原料,具备开发安全、经济的胶原材料的潜力。但国内富有鱼种胶原蛋白应用于生物医学材料领域的研究有待系统开展,特别是相关材料的体内生物相容性有待验证。本研究以草鱼皮提取纯化的胶原蛋白海绵材料为对象,进行了草鱼皮胶原海绵细胞附着性、免疫原性、致炎性、稳定性与形变的体内实验,并与猪皮胶原海绵材料相比较,以评价草鱼皮胶原海绵作为生物医学材料的组织相容性。
1 材料和方法
1.1胶原蛋白提取及胶原海绵制备
在低于15℃条件下剥离新鲜草鱼鱼皮(fishskin)或猪皮(pigskin),去除肌肉及皮下脂肪,充分洗涤后切割为3 mm× 3 mm小片。4℃条件下将片状原料以0.1 mol/L NaOH溶液浸泡24 h脱杂蛋白。去离子水充分洗涤后,用10% 正丁醇溶液浸泡24 h脱脂。去离子水充分洗涤、沥干后,片状原料用0.5 mol/L乙酸溶液摇浴24 h,分离上清液得到酸溶胶原蛋白(Acid-soluble collagen, ASC)粗提液。沉淀物用含2%胃蛋白酶的0.5 mol/L乙酸溶液摇浴24 h,分离上清液得到酶溶胶原蛋白(pepsin-soluble collagen,PSC)粗提液。分别向ASC和 PSC粗提液中添加NaCl至0.9 mol/L,盐析24 h后过滤。所获胶原蛋白沉淀用0.5 mol/L乙酸溶液复溶,顺次与0.1 mol/L的乙酸溶液及蒸馏水透析后冷冻干燥,得到胶原蛋白冻干产品[7](由于猪皮酸溶性胶原蛋白得率极低,因此未开展后续研究)。该产品经SDS-PAGE凝胶电泳、红外光谱和差示量热扫描分析[9],证实所含胶原蛋白为具有完整三螺旋结构的Ⅰ型胶原。用0.5 mol/L乙酸配置浓度为10 mg/mL的胶原蛋白溶液,均一注入玻璃平皿中,负压脱气处理后,于- 45℃条件下48 h冻干,分别制备得到鱼皮酸溶性胶原蛋白(fishskin ASC, FA)、鱼皮酶溶性胶原蛋白(fishskin PSC, FP)和猪皮酶溶性胶原蛋白(figskin PSC, PP)海绵,4℃密封保存。
1.2胶原海绵体外显微观测
冻干成型的胶原蛋白海绵材料4%甲醛溶液固定,石蜡包埋,切片后HE染色光学显微镜观测。胶原海绵4 mm× 4 mm × 2 mm真空喷金,扫描电镜(S-3000N, Hitachi公司)观察样品结构。
1.3实验动物
雄性封闭群SD大鼠,12~15周龄,体质量220~250 g。雄性封闭群昆明小鼠,8~9周龄,体质量35~40 g。由湖北省实验动物中心提供(许可证号SCXK鄂2008-0005),20~24℃/12 h光照条件下标准鼠粮饲养。实验过程遵循中华人民共和国科技部《关于善待实验动物的指导性意见》。
1.4胶原材料植入物的准备
胶原海绵以70%乙醇浸泡1 h消毒。以10倍体积无菌生理盐水浸泡10 min × 3次置换乙醇,无菌冻干备用。植入时切割为2 mm×2 mm×8 mm杆状物使用。
1.5植入实验方法及动物分组
SD大鼠腹腔注射戊巴比妥钠(35 mg/kg)溶液麻醉,遵循无菌操作[10]。仰卧位后肢上段内侧皮肤作 1cm纵行切口,牵开皮肤及股薄肌,暴露长收肌。肌筋膜作3mm切口,沿肌长轴钝性分离肌腹形成8 mm长潜在肌袋。将杆状胶原插入包裹,3-0尼龙线缝合筋膜,1-0尼龙线缝合皮肤。
实验动物设空白对照、FA、FP、PP材料植入4组,空白对照组不植入材料。每组3只大鼠,每只大鼠双侧后肢手术,每组样本n=6。1周后处死大鼠即刻取双侧后肢内收肌群以4%甲醛溶液固定。
1.6植入物及周围组织光学显微镜观测
内收肌群标本以石蜡包埋,以长收肌筋膜缝线定位,长轴横截切片。HE染色后光学显微镜观测植入物及周围组织反应。显微摄影后使用Photoshop (6.01) 图像分析软件测量炎性细胞浸润面积。以工具Measure确定标尺对应单维像素数(行与列等效),计算单位面积对应二维像素数(Pixels/mm2)。以工具Lasso划定待测闭合区域,工具Histogram测量划定区域总像素数,换算区域面积。
1.7动物免疫程序及分组
4℃条件下,胶原蛋白乙酸溶液(2 mg/mL)对生理盐水透析至平衡后以孔径0.45 μm硝酸纤维素膜过滤除菌。20只昆明小鼠分为生理盐水、FA、FP、PP溶液注射组,每组5只。第1、8、15 d腹腔注射1mL指定溶液,第22 d收获血清。
1.8血清特异性IgG抗体检测
以酶联免疫吸附试验(ELISA)检测各溶液引起小鼠特异性IgG抗体水平,分别以FA、FP、PP溶液(10 μg/mL)4℃包埋酶标板12h。洗板并以3 %牛血清白蛋白溶液封闭后,加入经对应胶原蛋白免疫过的大鼠血清样本(1/25),以生理盐水注射小鼠血清作为对照,每血清样本设3复孔,37℃孵育2 h。洗板后加入HRP标记山羊抗小鼠IgG抗体(Santa Cruze公司)检测,最终加入底物TMB(碧云天公司)显色20min,用iMARK酶标仪(Bio-Rad公司)读取415 nm吸光度。
1.9统计方法
统计分析使用Prism (4.00) 软件。样本均数及其随机误差用(均数±标准误)描述。多组样本间比较使用单因素方差分析(ANOVA),辅以指定两组间t检验。所有统计分析使用双侧比较,P<0.05则差异具有显著性。
2 结果
2.1胶原海绵的显微结构
鱼皮或猪皮胶原海绵材料截面HE染色具有相似特征,均为细纤维组成疏松网状结构(见图1(a))。扫描电镜观测鱼皮胶原海绵(见图1(b)和(c))多薄壁、类椭圆形孔隙,长轴一般100 μm以上,短轴50 μm以上,壁厚度小于10 μm。猪皮胶原海绵(见图1(d))孔隙较鱼皮胶原海绵小,形状不规则,壁结构较鱼皮胶原海绵致密。
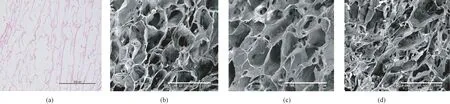
图1 胶原海绵正常显微结构。(a) FP,HE染色;(b) FA,扫描电镜;(c) FP,扫描电镜;(d) PP,扫描电镜Fig.1 Normal microscopic structures of collagen spongs. (a) FP, HE-stained histological section; (b) FA, SEM; (c) FP, SEM; (d) PP, SEM
2.2胶原材料体内组织学检测

图2 胶原海绵植入大鼠长收肌1周后植入部位切片HE染色(→指示材料边缘, 指示炎性细胞浸润边缘;炎性细胞浸润面积FA组与FP、PP组具有显著性差异)。(a) 空白;(b) FA;(c) FP;(d) PPFig.2 HE-stained histological sections of sites which the sponges were implanted in adductor longus muscles at 1 week after implantation (→ to indicate the border of material, to indicate the border of inflammatory area; the inflammatory area of group FA was significantly greater than group FP‘s and PP’s). (a) Blank; (b) FA; (c) FP; (d) PP
植入实验长收肌切片空白对照组(见图2(a))仅见局部肌纤维分离缝隙,未见炎性细胞浸润。FP组(见图2(c))材料边缘完整,材料内碱性染色细胞浸润,即为炎症反应细胞。通常包括中性粒细胞、成纤维细胞、淋巴细胞及巨噬细胞等。FA组(见图2(b))材料边缘模糊,大量炎性细胞成团分布。PP组(见图2(d))材料纤维结构已失去,仅见炎性细胞局部浸润。测量炎性细胞浸润面积(见图3),FP组((7.93 ± 0.77)mm2)与PP组((7.49 ± 1.03)mm2)没有显著差异,FA组((9.81 ± 1.42)mm2)与其他两组具有显著性差异(P< 0.05),提示FA致炎性较强,FP、PP致炎性较弱。
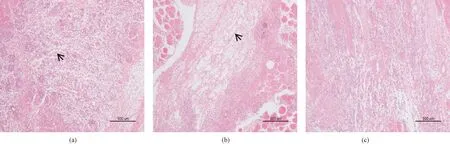
图4 植入大鼠长收肌1周后胶原海绵显微结构HE染色(→指示材料纤维)。(a) FA(散在断裂纤维);(b) FP(纤维结构完整);(c) PP(未见纤维)Fig.4 HE-stained microscopic structure of collagen sponges in adductor longus muscles at 1 week after implantation (→ to indicate the fiber of material). (a) FA (sporadic disrupted fibers); (b) FP (complete fibrous networks); (c) PP (none fiber)
2.3体内胶原材料结构变化
3组材料均为杆状物植入,截面初始为2 mm× 2 mm方形,体内一周形变明显。FP组(见图4(b))材料截面变形但边缘清晰,内部可见疏松纤维网格结构。FA组(见图4(a))材料边缘模糊,形状不规则,内部见散在断裂纤维。PP组(见图4(c))材料边缘已失去,未见纤维结构。可以判断1周体内降解速度:PP海绵 > FA海绵 > FP海绵。

图3 胶原海绵植入大鼠长收肌1周后植入部位炎性细胞浸润面积(*P < 0.05)。Fig.3 The cross-sectional inflammatory area of collagen sponges at 1-week implantation (*P < 0.05).
2.4胶原蛋白血清特异性IgG抗体水平
胶原蛋白免疫小鼠后检测各组血清特异性IgG抗体水平,以生理盐水注射小鼠血清作为阴性对照,FA胶原蛋白免疫小鼠血清总IgG抗体作为强阳性质控孔。检测数据分析(见图5),FA、FP、PP免疫后引起各自血清特异性IgG抗体水平显著增强(P< 0.05)。实验组间血清特异性IgG抗体水平:FA组(0.602±0.036)> FP组(0.518±0.019)> PP组(0.390±0.085)。统计分析FA与FP组、FP与PP组间无显著性差异,而FA与PP组间具有显著性差异。可以判断3组中PP对小鼠免疫原性最弱,而FA免疫原性最强,FP的免疫原性介于二者之间。

图5 胶原蛋白免疫小鼠的血清特异性IgG抗体水平(Total为FA胶原蛋白免疫小鼠血清总IgG抗体,*P < 0.05)。Fig.5 Assessment of the specific IgG antibodies in sera of mice immunized with collagen solution (Total as the total IgG in serum of mice immunized with FA, *P < 0.05).
3 讨论
局部组织损伤的再生修复过程一般经历炎症期、增殖期、塑型期。组织诱导、组织传导、组织塑型等是决定修复结局的重要因素。组织塑型在前二者基础上实现成分和结构对功能的适应,而组织诱导、组织传导对再生组织的成分与结构起着决定性作用[11-12]。当恢复损伤组织的正常成分与结构比较困难时,组织工程可以改善原位实质母细胞的聚集与分化,提高细胞增殖和分布的效率。胶原蛋白材料在软骨[13]、腱[14]、脂肪、皮肤、牙周膜、角膜等组织工程[15]以及药物缓释载体、创面敷料、体外细胞扩增覆层等[16]生物医学领域均有所利用。作为组织工程使用的支架,其主要功能是提高细胞增殖分布和分化的效率[17],需具有合理的细胞吸附性、免疫原性、致炎性、稳定性与形变等组织相容性[18]。
本研究制备了FA、FP和PP等3种胶原蛋白材料。它们均为多孔隙海绵样三维结构,孔隙宽度均足以容纳细胞入驻,多孔纤维结构有利于细胞粘附[19- 20]。鱼皮胶原孔隙较猪皮胶原略大,壁结构较疏松。作为哺乳动物胶原蛋白替代来源,鱼胶原蛋白材料孔隙性能优良,植入实验材料内部有大量有核细胞入驻。
3种胶原蛋白海绵植入生存大鼠肌肉内,一周后取材料及周围组织切片观测,材料内部及周围可见炎性细胞浸润。而空白对照组仅见局部肌纤维分离缝隙,未见细胞浸润。比较炎性细胞浸润面积,提示FA组局部炎性反应最强。而FP与PP组局部炎性反应较弱,两组间没有显著差异。
为评价3种胶原蛋白的免疫原性,小鼠接受胶原蛋白溶液注射后检测血清特异性IgG水平。结果显示均引起各自血清特异性IgG抗体水平的显著上升。组间血清特异性IgG抗体水平FA组最高,PP组最低,仅此两组间具有显著性差异。可以判断3组中PP对小鼠免疫原性最弱,而FA免疫原性最强,FP的免疫原性介于二者之间。
血清抗体与局部细胞免疫,PP的体内反应水平均为最低,而FA均为最高。FP的免疫原性接近于PP,明显优于FA。
观察材料在体内的形变和降解程度,FP组材料边缘清晰,截面变为菱形,疏松网格结构完整。FA组材料边缘模糊,形状不规则,可见散在断裂纤维。PP组材料边缘已失去,未见胶原蛋白纤维结构。一周时间材料在体内形变明显,提示材料力学强度有待增强。在植入早期材料稳固性对维持细胞增殖的空间分布具有重要的导向作用,对提高修复效率、缩短修复时间具有较大意义。在植入后期,随着实质细胞及基质的更替重构以更好适应功能,材料需可降解以利于组织再生。不同组织的再生修复对材料稳定与降解的时间有不同需要,但一周时间对各种组织修复而言明显不足[21]。PP与FA海绵在体内一周基本丧失空间结构,对维持细胞增殖的空间分布不利。而FP海绵在体内一周仍维持完整的疏松孔隙结构,具有更高的实用性。
鱼皮胶原孔隙较猪皮胶原略大,壁结构较疏松,这与鱼胶原蛋白的变性温度比猪胶原蛋白低相关,各种鱼类来源胶原蛋白的变性温度都低于37℃[22]。目前胶原植入实验多使用70%乙醇消毒胶原材料[23],乙醇对蛋白质具有一定变性交联作用。胶原蛋白经人工交联后可以增加力学强度,显著推迟材料的降解时间[24- 25]。本研究所用胶原材料仍有交联改性的必要,以适应不同组织再生对材料稳定与形变性能的需要。
4 结论
综合细胞吸附性、免疫原性、致炎性、稳定性与形变性能,可以发现3种材料均适于细胞附着,FP免疫原性及致炎性接近于PP,FP海绵体内稳定性好于FA海绵及PP海绵。实验结果表明3种检测材料中鱼皮酶溶性胶原海绵(FP)具有组织相容性优势。
[1] Marx RE. Bone and bone graft healing [J]. Oral and Maxillofacial Surgery Clinics of North America, 2007,19(4): 455-466.
[2] Childs SG. Stimulators of bone healing. Biologic and biomechanical [J]. Orthopaedic Nursing, 2003,22(6): 421-428.
[3] Williams DF. On the mechanisms of biocompatibility [J]. Biomaterials, 2008,29(20): 2941-2953.
[4] Glowacki J, Mizuno S. Collagen scaffolds for tissue engineering [J]. Biopolymers, 2008,89(5): 338-344.
[5] Williams DF. On the nature of biomaterials [J]. Biomaterials, 2009,30(30): 5897-5909.
[6] Singh P, Benjakul S, Maqsood S,etal. Isolation and characterization of collagen extracted from the skin of striped catsh (Pangasianodon hypophthalmus) [J]. Food Chemistry, 2011,124(1): 97-105.
[7] 汪海波, 梁艳萍, 汪海婴, 等. 草鱼鱼鳞胶原蛋白的提取及其部分生物学性能 [J]. 水产学报, 2012,36(4): 553-561.
[8] Pati F, Datta P, Adhikari B,etal. Collagen scaffolds derived from fresh water fish origin and their biocompatibility. J Biomed Mater Res Part A, 2012,100A(4): 1068-1079.
[9] 汪海波, 汪海婴, 梁艳萍, 等. 草鱼鱼鳞胶原蛋白的凝胶性能研究 [J]. 功能材料, 2012,43(4): 433-437.
[10] 方成, 刘立, 胡汉宁, 等. 大鼠双侧供肾左侧原位肾移植模型的建立及肾功能监测 [J]. 中国组织工程研究与临床康复, 2010,14(53): 9933-9936.
[11] Bodine PV, Billiard J, Moran RA,etal. The Wnt antagonist secreted frizzled-related protein-1 controls osteoblast and osteocyte apoptosis [J]. Journal of Cellular Biochemistry, 2005,96(6): 1212-1230.
[12] Gautschi OP, Frey SP, Zellweger R. Bone morphogenetic proteins in clinical applications [J]. ANZ Journal of Surgery, 2007,77(8): 626-631.
[13] Kawaguchi Y, Kondo E, Kitamura N,etal.Invivoeffects of isolated implantation of salmon-derived crosslinked atelocollagen sponge into an osteochondral defect [J]. J Mater Sci Mater Med, 2011,22(2): 397-404.
[14] Kishore V, Uquillas JA, Dubikovsky A,etal.Invivoresponse to electrochemically aligned collagen bioscaffolds [J]. J Biomed Mater Res Part B, 2012,100B(2): 400-408.
[15] Matsumoto Y, Ikeda K, Yamaya Y,etal. The usefulness of the collagen and elastin sponge derived from salmon as an artificial dermis and scaffold for tissue engineering [J]. Biomed Res, 2011,32(1): 29-36.
[16] 刘新华, 但年华, 李正军, 等. 胶原基复合医用海绵的研究进展 [J]. 西部皮革, 2012,35(8): 13-18.
[17] Roden RD Jr. Principles of bone grafting [J]. Oral and Maxillofacial Surgery Clinics of North America, 2010,22(3): 295-300.
[18] 李瑞, 王青山. 生物材料生物相容性的评价方法和发展趋势 [J]. 中国组织工程研究与临床康复, 2011,15(29): 5471-5474.
[19] Yang Shoufeng, Leong K-F, Du Zhaohui,etal. The design of scaffolds for use in tissue engineering. Part I. Traditional factors [J]. Tissue Engineering, 2001,7(6): 679-689.
[20] Woolfson DN, Ryadnov MG. Peptide-based fibrous biomaterials: Some things old, new and borrowed [J]. Current Opinion in Chemical Biology, 2006,10(6): 559-567.
[21] Blanco NM, Edwards J, Zamboni WA. Dermal substitute (Integra) for open nasal wounds [J]. Plastic and Reconstructive Surgery, 2004,113(7): 2224-2225.
[22] Ikoma T, Kobayashi H, Tanaka J,etal. Physical properties of type I collagen extracted from fish scales of Pagrus major and Oreochromis Niloticas [J]. International Journal of Biological Macromolecules, 2003,32(3-5): 199-204.
[23] Kishore V, Bullock W, Sun Xuanhao,etal. Tenogenic differentiation of human MSCs induced by the topography of electrochemically aligned collagen threads [J]. Biomaterials, 2012,33(7): 2137-2144.
[24] Olde Damink LHH, Dijkstra PJ, Van Luyn MJA,etal. Crosslinking of dermal sheep collagen using hexamethylene diisocyanate [J]. Journal of Materials Science: Materials in Medicine, 1995,6(7): 429-434.
[25] Lee JM, Edwards HHL, Pereira CA,etal. Crosslinking of tissue-derived biomaterials in 1-ethyl-3-(3-dimethylam-inopropyl)-carbodiimide (EDC) [J]. Journal of Materials Science: Materials in Medicine, 1996,7(9): 531-541.
EvaluatingtheHistocompatibilityofFishskinCollagenSpongesasBiomaterialinvivo
FANG Cheng1*WANG Hai-Bo2MEI Zhi-Qiang1XIAO Xian-Jie1LIU Li1WANG Jia-Mou1WANG Zhong-Wen2
1(LaboratoryofTransplantEngineering,WuhanPolytechnicalUniversity,Wuhan430023,China)2(CollegeofChemicalandEnvironmentalEngineering,WuhanPolytechnicalUniversity,Wuhan430023,China)
This study investigated the cellular permeability, immunogenicity, inflammatory inductivity, biodegradation and deformation of grass carp skin collagen spongeinvivoto evaluate the histocompatibility and compared with pigskin collagen sponge. Fishskin acid-soluble collagen (FA), fishskin pepsin-soluble collagen (FP) and pigskin pepsin-soluble collagen (PP) sponges were prepared by self-assembly and had highly open porous structure with microfibrous. The collage sponges with 2×2×8 mm rod shape were implanted in the adductor longus muscles (n=6 each group) of SD rats. After 1 week, three kinds of materials were penetrated by nucleated cells. There was not significant difference of the inflammatory areas between group FP (7.93±0.77 mm2) and PP (7.49±1.03 mm2), but the area of group FA (9.81±1.42 mm2) was significantly greater. The cross sections of FP pallets were deformed but the borders were clear and the fibrous networks were complete. The fibrous networks of FA pallets were disrupted and the PP pallets’ were disappeared. Assessing the amount of specific IgG antibodies in sera of KM mice (n=5 each group) immunized with collagen solution by ELISA, the OD values of group FA, FP, and PP were (0.602±0.036), (0.518±0.019) and (0.390 ± 0.085). There was only significant difference of the amount of specific IgG between group FA and PP. These results indicated that the three kinds of materials are suitable for cellular immigration. The immune and inflammatory responses to FP sponge are similar to PP sponge. The biological stability of FP sponge is superior to that of FA and PP sponges. Experimental results suggest that fishskin pepsin-soluble collagen sponge has histocompatible advantages among the three kinds of materials.
Ctenopharyngodonidellus; pig; skin; collagen; histocompatibility
10.3969/j.issn.0258-8021. 2014. 01.011
2013-10-10,录用日期:2013-12-09
国家自然科学基金(21076166);湖北省高等学校优秀中青年科技创新团队计划项目( T201208);武汉市科技局应用基础研究项目(2013020501010177)
R318.08
A
0258-8021(2014) 02-0212-06
*通信作者。E-mail: fang_cheng@foxmail.com

