中药川贝对哮喘模型小鼠VEGF和HIF-1α表达的影响
李厚忠,任公平,张羽飞
(1.牡丹江医学院,黑龙江 牡丹江 157011;2.牡丹江医学院红旗医院,黑龙江 牡丹江 157011;3.牡丹江医学院医药研究中心,黑龙江 牡丹江 157011)
哮喘患者肺组织经常伴有新生血管的生成,来自哮喘患者活组织检查发现不论血管的数量还是粗细都有所增加,这些改变可引起气道阻塞或(和)气道高反应性,从而加重哮喘[1]。目前,治疗哮喘的一般方法是应用糖皮质激素、白三烯受体拮抗药等[2],由于不良反应严重,患者很难接受,寻找安全有效的中药就显得更加重要。中药川贝治疗哮喘安全可靠,可作为首选。
既往研究表明,血管内皮细胞生长因子(VEGF)在血管生成过程中起核心作用[3]。最新研究发现,VEGF调节血管生成是通过缺氧诱导因子-1α(HIF-1α)发挥作用的[4],HIF-1α 可以调节基因表达响应氧气浓度的变化。本研究建立哮喘小鼠模型,通过检测气道炎症、血管百分比以及血管生成与VEGF和HIF-1α的关系,探讨中药川贝治疗哮喘的分子机制。
1 材料与方法
1.1 实验动物
雌性BALB/C小鼠30只,6~8周龄,由哈尔滨医科大学动物实验中心提供,实验动物合格证号:P00102008。
1.2 试药
中药川贝粉的制备:选取整齐、粉性足者。由于川贝忌水洗,因此采用洁净的纱布擦拭药材表面去除药材表面的灰尘。净选后的川贝通过灭菌消毒窗消毒15min后直接转至粉碎车间,Fz-400型粉碎机组加工成100目细粉,收得的细粉装入洁净的容器中。全部加工完后的细粉用洁净的塑料袋分装成1kg/袋备用。
1.3 模型建立
健康清洁级BALB/C小鼠腹腔内注射10%卵蛋白+10%氢氧化铝混合液1ml作为首次致敏,第15天将小鼠依次置于超声雾化器中,用1%卵蛋白生理盐水喷雾激发小鼠哮喘发作,隔日1次,每次20min,共激发28天。以小鼠出现口唇发绀、腹肌痉挛、呼吸加快、点头呼吸或站立不稳等表现表示成功激发。将成功制备的哮喘模型小鼠(20只)随机分为2组(每组10只)。分别为模型组和中药川贝组,另设PBS组(10只,以生理盐水代替卵蛋白进行腹腔注射及雾化吸入给药)。分组后每天灌胃给药,模型组和PBS组给予等量生理盐水,中药川贝组给予川贝粉9.0g/kg,每日1次,连续28天。最后1次给药2h后,三组小鼠用1%巴比妥钠麻醉,取出肺组织保存,用于组织学检测。
1.4 免疫组化法检测VEGF和HIF-1α表达、计算血管百分比
肺组织石蜡切片、脱蜡、脱水、浸泡于3%H2O2中15min灭活内源性过氧化物酶。置于煮沸柠檬酸钠中修复抗原,暴露抗原表位并且用3%小牛血清蛋白阻断。切片与血管性血友病因子(vWF)初级抗体孵育。VEGF和HIF-1α分别4℃过夜,随后与二氨基联苯胺孵育。用均匀结合在内皮细胞表面的vWF抗体标记血管,所有的后续步骤均在ZSGB-BIO Autostainer进行。随机选定1个HPF(200×)视野,像场的总面积除以vWF阳性面积既得血管百分比,免疫组化染色支气管上皮细胞用于计算VEGF与HIF-1α表达。
1.5 Western blotting检测VEGF与HIF-1α表达
在蛋白酶抑制剂的存在下肺组织匀浆,以获得肺蛋白提取物,用于Western blotting分析,使用bca-100蛋白定量分析试剂盒确定浓度。每组蛋白质等量(30μG)固定SDS聚丙烯酰胺凝胶,然后转移到硝酸纤维素膜,膜在三异丙基乙磺酰缓冲盐水吐温20(25 mM Tris pH 7.5,150 mM NaCl,和 0.1%Tween 20)中用5%的脱脂奶粉封闭1h,与原发性抗VEGF抗体或抗-HIF-1抗体4℃过夜孵育,然后与二抗杂交(Dako,1∶2000),增强化学发光显示特异性结合,以βactin为内参,X射线扫描,计算机辅助双向光密度计分析光密度,计算VEGF和HIF-1α表达的相对比例。
1.6 组织学分析
肺组织用4%多聚甲醛固定、石蜡包埋、切片、苏木精和伊红染色、数字显微镜扫描。根据组织学评分系统对支气管周围炎症进行评分:1)支气管周围无炎细胞;2)可见少量炎细胞;3)大量炎细胞,但是没有完全浸润支气管;4)1层炎细胞完全浸润支气管;5)2层炎细胞完全浸润支气管;6)3层或者更多炎细胞完全浸润支气管。用所有肺组织的支气管除以有炎症的支气管计算平均支气管炎症指数。
1.7 统计学处理
2 结果
2.1 中药川贝降低血管生成
OVA致敏后,血管生成(见图1)。模型组血管百分比明显升高,与PBS组比较,差异具有统计学意义(P<0.01)。给予中药川贝干预后,血管百分比明显降低,与模型组比较,差异具有统计学意义(P<0.01)(见表1)。
2.2 中药川贝降低VEGF表达
模型组支气管上皮细胞,肺泡上皮细胞和内皮细胞VEGF表达明显升高,中药川贝干预后,VEGF表达接近PBS组(见图2,表1)。Western blotting结果显示,模型组VEGF表达明显升高,与PBS组比较,差异具有统计学意义(P<0.01);中药川贝干预后,VEGF表达降低,与PBS组比较,差异无统计学意义(P>0.05)(见图3,表1)。
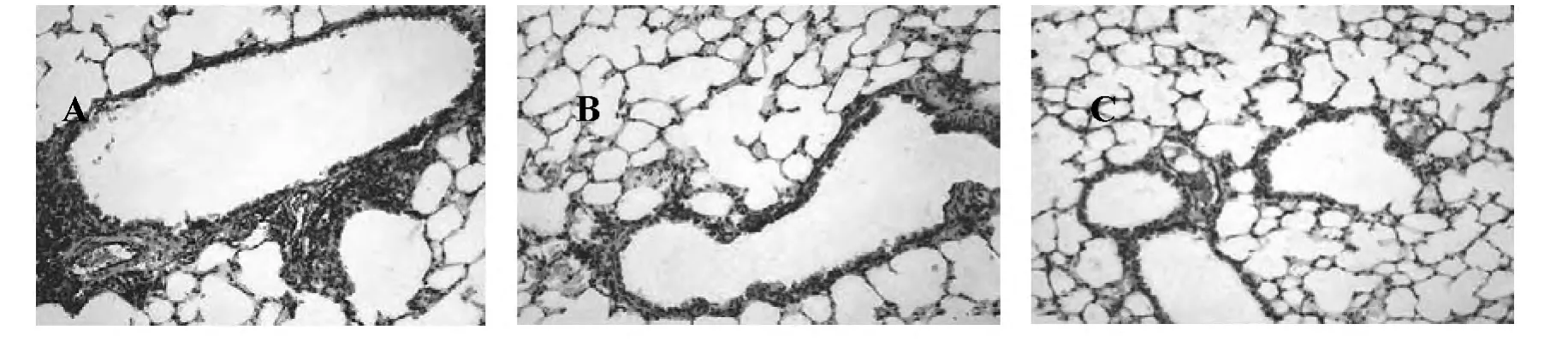
图1 小鼠肺组织vWF阳性血管面积(200×)
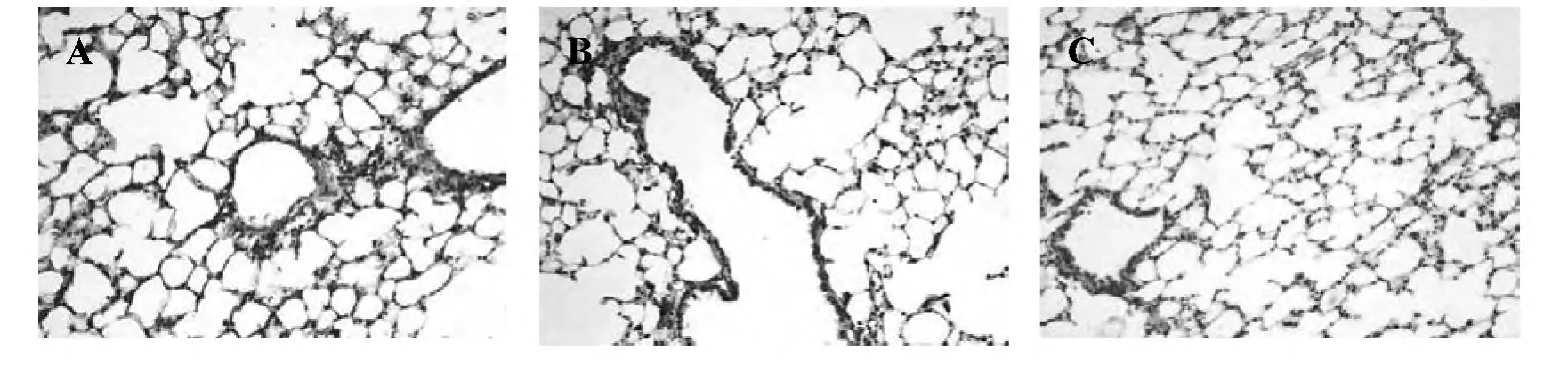
图2 小鼠肺组织VEGF表达(200×)
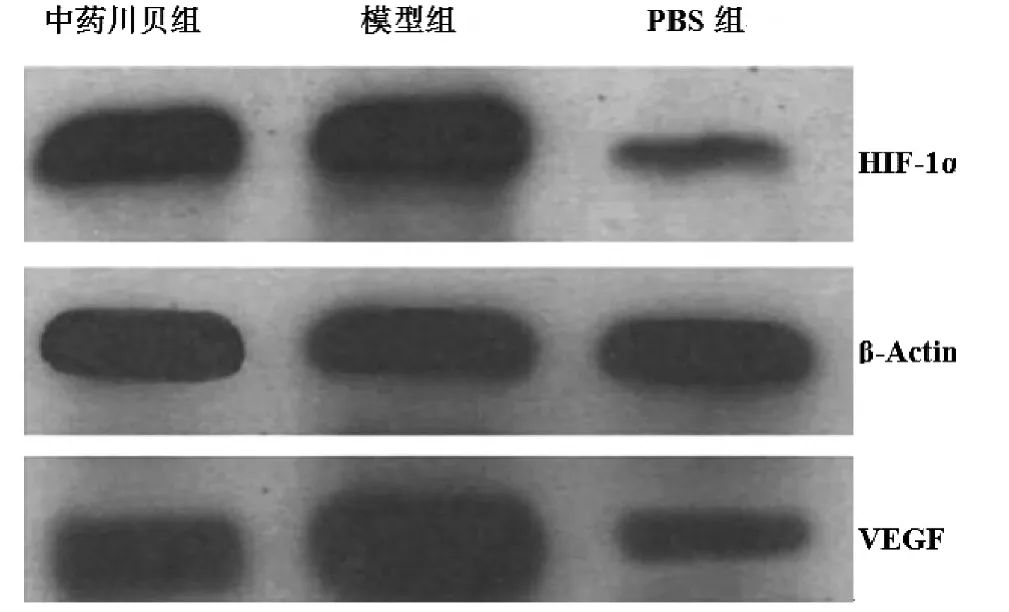
图3 Western blotting结果
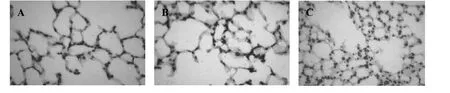
图4 小鼠肺组织HIF-1α表达(400×)
表1 中药川贝对哮喘模型小鼠血管生成的影响(n=10,s)
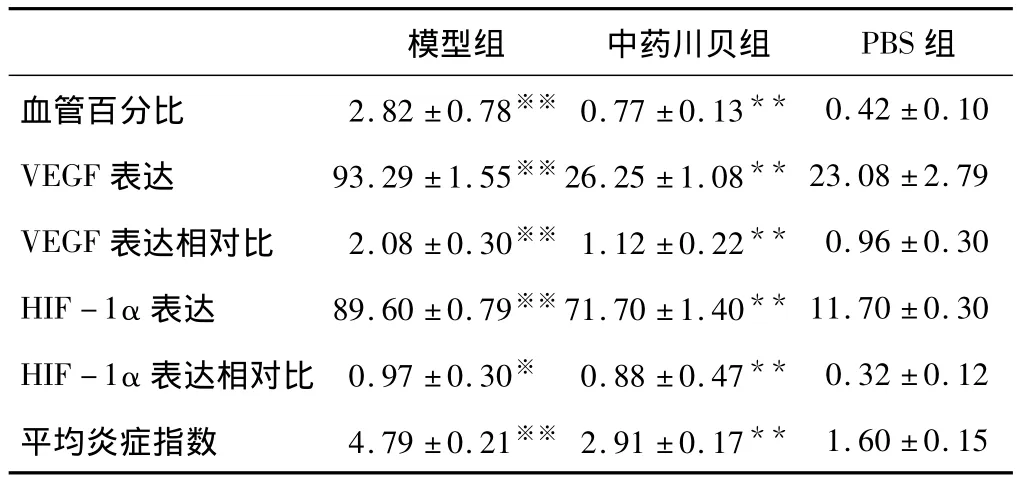
表1 中药川贝对哮喘模型小鼠血管生成的影响(n=10,s)
注:与 PBS组比较,**P <0.01;与模型组比较,※※P <0.01,※P <0.05。
模型组 中药川贝组 PBS组血管百分比 2.82 ±0.78※※ 0.77 ±0.13**1.60 ±0.15 0.42 ±0.10 VEGF 表达 93.29 ±1.55※※26.25 ±1.08** 23.08 ±2.79 VEGF 表达相对比 2.08 ±0.30※※ 1.12 ±0.22** 0.96 ±0.30 HIF -1α 表达 89.60 ±0.79※※71.70 ±1.40** 11.70 ±0.30 HIF -1α 表达相对比 0.97 ±0.30※ 0.88 ±0.47** 0.32 ±0.12平均炎症指数 4.79 ±0.21※※ 2.91 ±0.17**
2.3 中药川贝降低HIF-1α表达
为进一步阐明中药川贝抗血管生成机制,本实验还检测了肺组织HIF-1α表达水平。PBS组仅可见少量HIF-1α阳性细胞,而模型组肺泡上皮细胞核HIF-1α高表达(见图3,图4)。Western blotting检测HIF-1α相对比,模型组HIF-1α表达上调,与PBS组比较,差异具有统计学意义(P<0.01);中药川贝组HIF-1α表达下调,与模型组比较,差异具有统计学意义(P <0.05)(见表1)。
2.4 血管百分比与VEGF和HIF-1α表达相关性
Western blotting结果显示(见图3),血管百分比与 VEGF(r=0.693,P <0.01)和 HIF -1α(r=0.785,P<0.01)表达呈正相关,因此VEGF和HIF-1α表达呈正相关(r=0.641,P <0.05)。
2.5 中药川贝改善过敏性气道炎症
组织学分析显示,模型组呈典型哮喘病理特征(见图5A)。许多炎细胞浸润支气管周围,支气管上皮增厚,与PBS组比较炎症指标明显增强,差异具有统计学意义(P<0.01)(见表1)。给予中药川贝干预后,气道炎症明显改善,炎细胞减少,支气管上皮增厚范围缩小(见图5B),与模型组比较,差异具有统计学意义(P <0.01)(见表1)。

图5 小鼠肺组织组织病理学切片(200×)
3 讨论
为阐明中药川贝抗血管形成机制,本实验检测了平均炎细胞指数和血管百分比。哮喘模型小鼠肺组织可见大量炎细胞浸润支气管周围,同时支气管上皮细胞损伤,炎症是哮喘加重的一个重要因素[5]。炎症效应细胞(肥大细胞,嗜碱性粒细胞,巨噬细胞等)是血管形成的主要诱因,这与哮喘患者血管生成增多相一致[6-9],哮喘模型小鼠血管百分比明显增加。本研究发现,中药川贝不仅可以改善气道炎症,而且可以减少血管生成,结果证实中药川贝具有抗血管生成作用。
本研究证实了VEGF和HIF-1α表达的关系。VEGF的激活受HIF-1α调控,哮喘发作时HIF-1α表达增加,从而使VEGF表达上调,最终引起血管生成增加,这与文献结果相一致。
在哮喘模型小鼠上还发现支气管上皮细胞,肺泡内皮细胞和血管内皮细胞VEGF表达增加,此结果明确了VEGF表达和血管百分比之间的关系。众所周知,在血管生成过程中,VEGF起核心作用[10]。中药川贝降低VEGF表达,抑制内皮细胞增殖和血管生成,最终降低血管百分比,VEGF表达降低可能是中药川贝抗血管生成的机制之一。
综上所述,中药川贝可以减轻气道炎症,降低VEGF和HIF-1α表达,从而抑制哮喘模型小鼠肺组织血管生成,本研究证实中药川贝具有较好的治疗哮喘的作用。
[1]Detoraki A,Granata F,Staibano S,et al.Angiogenesis and lymphangiogenesis in bronchial asthma[J].Allergy,2010,65:946 -958.
[2]Radwan ZM,Yamamah GA,Shaaban HH,et al.Effect of different monotherapies on serum nitric oxide and pulmonary functions in children with mild persistent asthma[J].Arch Med Sci,2010,6:919 -925.
[3]Baluk P,Lee CG,Link H,et al.Regulated angiogenesis and vascular regression in mice overexpressing vascular endothelial growth factor in airways[J].Am J Pathol,2004,165:1071 -1085.
[4]Lee SY,Kwon S,Kim KH,et al.Expression of vascular endothelial growth factor and hypoxia-inducible factor in the airway of asthmatic patients[J].Ann Allergy Asthma Immunol,2006,97:794 -799.
[5]Fukushima C,Matsuse H,Fukahori S,et al.Aspergillus fumigatus synergis tically enhances mite-induced allergic airway inflammation[J].Med Sci Monit,2010,16:197 -202.
[6]Hoshino M,Aoike N,Takahashi M,et al.Increased immunoreactivity of stromal cell- derived factor-1 and angiogenesis in asthma[J].Eur Respir J,2003,21:804 -809.
[7]Salvato G.Quantitative and morphological analysis of the vascular bed in bronchial biopsy specimens from asthmatic and non-asthmatic subjects[J].Thorax,2001,56:902 -906.
[8]Tanaka H,Yamada G,Saikai T,et al.Increased airway vascularity in newly diagnosed asthma using a high-magnification bronchovideoscope[J].Am J Respir Crit Care Med,2003,168:1495 -1499.
[9]李厚忠,齐敏,张羽飞.中药川贝对哮喘大鼠NO、TNF-α、MDA浓度和SOD活力及支气管平滑肌炎症反应的影响[J].中医药学报,2013,41(4):64 -67.
[10]Yuksel H,Kose C,Yilmaz O,et al.Increased expression of tissue vascular endothelial growth factor and foetal liver kinase-1 receptor in seasonal allergic rhinitis and relevance to asthma component[J].Clin Exp Allergy,2007,37:1183 -1188.

