异种去抗原松质骨成骨效能的实验研究*
张 晔, 刘湘宁, 李婷薇, 赖仁发
(暨南大学附属第一医院口腔科,广东 广州 510632)
颌骨在解剖形态和功能上有其特殊性,不但支撑着整个颌面部的美观外形,而且支持着咀嚼功能。然而由外伤、肿瘤等造成颌骨缺损却频繁发生,严重损害了患者的面部美观和咀嚼功能,对患者的生理和心理健康造成了严重创伤。同时对颌骨缺损美观和功能的修复一直也是口腔医生所面临的难题之一。因此对颌骨缺损理想修复的研究一直是口腔界的热点课题,骨组织工程应运而生。一种理想的骨修复材料应该具有良好的骨诱导性和骨传导性,能促进新骨的形成和生长,在新骨完成了结构和功能重建后,植入物可以被完全爬行替代[1-2]。而对于颌骨修复来说,修复材料不仅需要有良好的诱导性和传导性,还需要能够根据骨缺损的形态进行塑形。有大量的实验研究表明骨形成蛋白2 (bone morphogenetic protein 2, BMP-2)能够诱导骨再生[3-4]。而异种松质骨不仅能够根据颌骨缺损的形态进行加工塑形,而且拥有天然骨的多孔结构。彭磊等[5]的实验表明松质骨能为其它细胞、细胞因子的复合及新骨长入提供良好的环境,这一特性解决了化学合成人工骨空隙率和空隙交通孔径太小的难题。目前在临床上所使用的最为广泛的异种骨产品主要为牛骨来源(以Bio-oss为代表)。其具备良好的骨传导性,但缺乏骨诱导性,修复骨组织时间长达半年以上,且在修复大面积骨缺损时无法塑形。而且部分患者由于对朊病毒传播疾病如牛海绵状脑病(疯牛病)的恐惧而难以接受移植牛骨来源的骨产品,所以现阶段猪牛羊犬等的异种骨产品的开发利用已成为欧美国家生物材料研究的重点。本研究将重组人骨形成蛋白(recombinant human BMP-2, rhBMP-2)与去抗原松质骨复合,植入兔下颌骨缺损处,探讨其在修复骨缺损中的作用。
材 料 和 方 法
1 动物及材料
28只6月龄新西兰大白兔均为普通级,采用标准兔饲料喂养,体重均约为2.5~3.0 kg,雌雄不限,健康,无系统性疾病。
异种去抗原松质骨由广东冠昊科技股份有限公司提供。松质骨取自健康家猪髂骨。rhBMP-2由暨南大学生物工程研究所提供。
2 主要方法
2.1动物实验 将28只兔按照完全随机分组分为3组:异种去抗原松质骨/rhBMP-2组(A组)、异种去抗原松质骨组(B组),每组12只;空白对照组(C组)4只。根据兔体重将3%戊巴比妥钠按0.03 g/kg的注射量全麻。沿下颌骨下缘上5 mm处,由颏孔至下颌升支处,平行于下颌骨下缘做一2 cm长切口,暴露术区骨面。于术区下颌骨颏孔至下颌升支处做一15 mm×6 mm的全层缺损。根据分组分别于缺损区植入复合rhBMP-2的异种去抗原松质骨、异种去抗原松质骨及不植入任何骨替代品。植入的异种去抗原松质骨规格为15 mm×6 mm×6 mm,缝合。术后连续3 d,每天2次肌注庆大霉素针4×104U,预防感染。
2.2X线检查 将各标本按照组别编号分别拍摄X线片,观察组间、组内不同时间骨缺损的愈合状况。骨愈合X线片采用Lane-Sandhu法评分标准评分(表1),并比较各组间各时点骨愈合的情况。

表1 Lane-Sandhu法X线摄片评分标准
2.3双能X线吸收法 (dual-energy X-ray absorp-tiometry, DXA)检测骨密度 使用GE公司的 Lunar Prodigy骨密度仪分别检测各组下颌骨术区的骨矿物质密度,比较成骨的质量和成骨速度。
2.4组织病理切片HE染色观察 用齿科电钻(生理盐水局部冲洗降温)于原植入材料与自体骨交界处外5 mm范围内截取骨标本,经脱钙处理后从矢状面制成5 μm切片。切片HE染色后,观察植入物与周围骨组织的结合、新生骨的生成和改建、去抗原异种松质骨的降解吸收、新生骨在材料中的爬行替代过程及其它相关情况。
2.5新生骨定量分析 取各标本的切片,在50倍光镜视野下观察新骨形成情况,取各切片5个部分图像,4个角和缺损中部图像,并将图像采集收入Leica Qwin图像分析软件中,测量新生骨组织占测量框架的面积百分比,取平均值。
3 统计学处理
使用SPSS 13.0软件分析,数据用均数±标准差(mean±SD)表示,组间均数比较采用单因素方差分析(One-way ANOVA)。以Levene法进行方差齐性检验,方差齐者以Bonferroni法进行两两比较。以P<0.05为差异有统计学意义。
结 果
1 标本的大体观察
术后第12周,取右侧下颌骨标本,未见移植物有脱落、移位、排出等。A组可见植入材料全部由骨痂覆盖;B组可见植入材料颊舌侧完全由骨痂覆盖; C组可见缺损处未愈合,见图1。

Figure 1. General observation in the 12th week. A: antigen-extracted xenogeneic cancellous bone/rhBMP-2 group; B: antigen-extracted xenogeneic cancellous bone group; C: blank control group.
2 X线检查结果及影像学评分
术后第12周,A组植入材料与自体骨边界完全消失,植入的异种去抗原松质骨原骨小梁结构消失,材料已完全降解,已形成与正常自体骨结构相似,密度相近的骨组织;B组材料边缘与自体骨部分融合,植入的异种去抗原松质骨骨小梁部分可见,接近正常自体骨组织;C组可见缺损中间仍有约10 mm×6 mm大小的低密度影,缺损边缘呈云雾状,见图2。
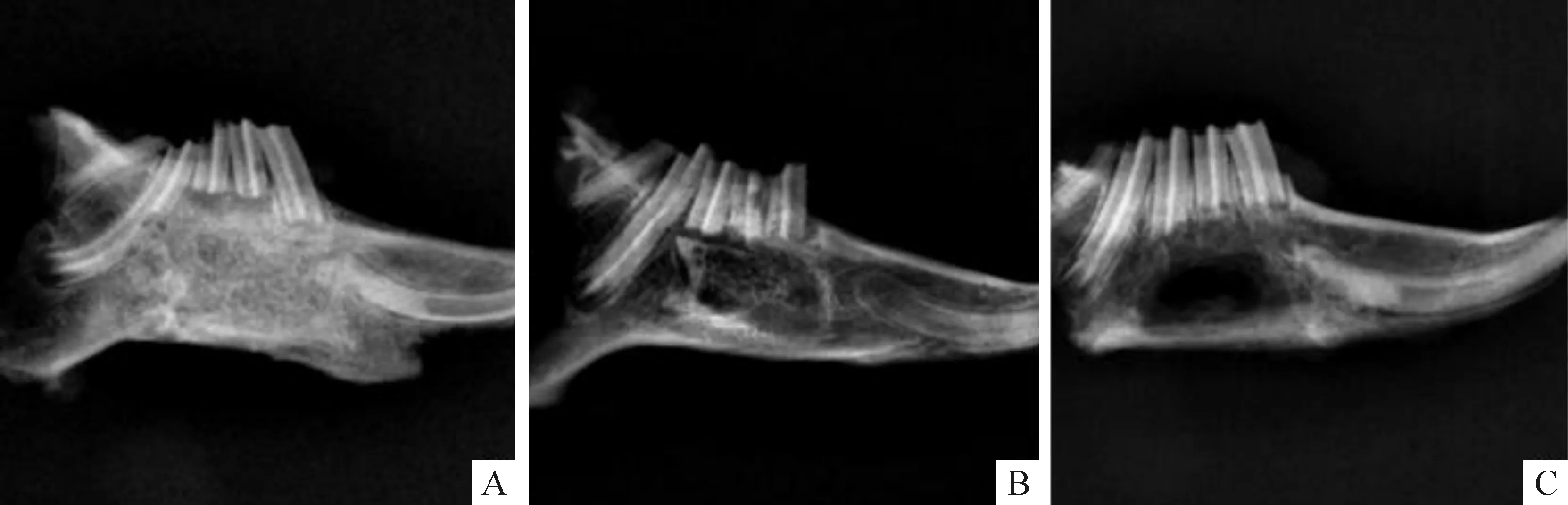
Figure 2. X-ray test in the 12th week.A: antigen-extracted xenogeneic cancellous bone/rhBMP-2 group; B: antigen-extracted xenogeneic cancellous bone group; C: blank control group.
A组与B组各时点影像学评分比较, 8周及12周时差异有统计学意义;A组与C组12周时差异有统计学意义;B组与C组12周时差异有统计学意义,见表2。

表2 影像学评分
3 骨密度测量结果
A组与B组各时点骨密度值比较,12周时差异有统计学意义,B组比A组骨密度要低;A组与C组12周时差异有统计学意义;B组与C组12周时差异有统计学意义(P<0.05),见表3。
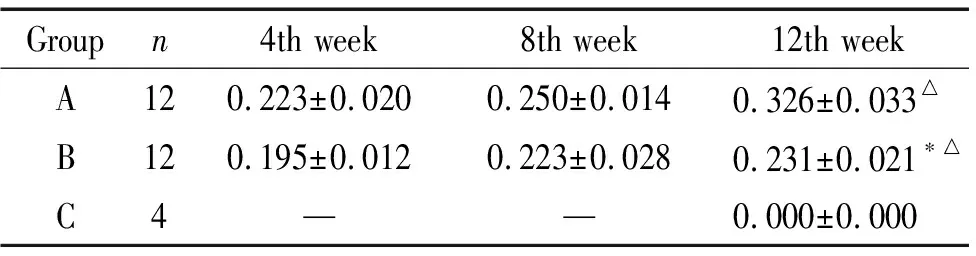
表3 骨密度值
4 组织学观察
术后第4周,A组植入材料骨小梁部分降解,大量片状新生骨形成并向植入骨区爬行,新生骨周可见大量的成骨细胞。B组植入材料边缘可见纤维组织、毛细血管增生;可见少量新骨生成,呈不连续条索状,向植入骨区爬行;新骨周可见成骨细胞围绕,见图3。术后第8周:A组植入材料骨小梁大量降解,大量新生骨形成,片状,向植入骨区爬行,新生骨周仍可见大量的成骨细胞。B组植入材料骨小梁部分降解,较多新生骨形成,条索状,不连续,向植入骨区爬行;新生骨周可见大量的成骨细胞,见图4。术后第12周:A组植入材料骨小梁大部分降解,大量新生骨形成,片状,可见大量成熟的骨小梁,新生骨周仍可见大量的成骨细胞。B组植入材料骨小梁部分降解较多新生骨形成,条索状,不连续,向植入骨区爬行,可见部分成熟的骨小梁;新生骨周可见大量的成骨细胞。C组:可见缺损区未愈合,缺损处边缘主要由肉芽组织充填,见图5。
5 新生骨面积百分比
A组与B组新生骨面积百分比各时点比较,4周组、8周组及12周组各时点2组的新生骨面积百分比差别有统计学意义;A组与C组新生骨面积百分比比较,12周时2组的新生骨面积百分比差别有统计学意义(P<0.05);B组与C组新生骨面积百分比比较,12周时2组的新生骨面积百分比差别有统计学意义(P<0.05),见表4。

Figure 3. Hematoxylin and eosin staining in the 4th week(×100).A: antigen-extracted xenogeneic cancellous bone/rhBMP-2 group; B: antigen-extracted xenogeneic cancellous bone group.

Figure 4. Hematoxylin and eosin staining in the 8th week (×100).A: antigen-extracted xenogeneic cancellous bone/rhBMP-2 group; B: antigen-extracted xenogeneic cancellous bone group.
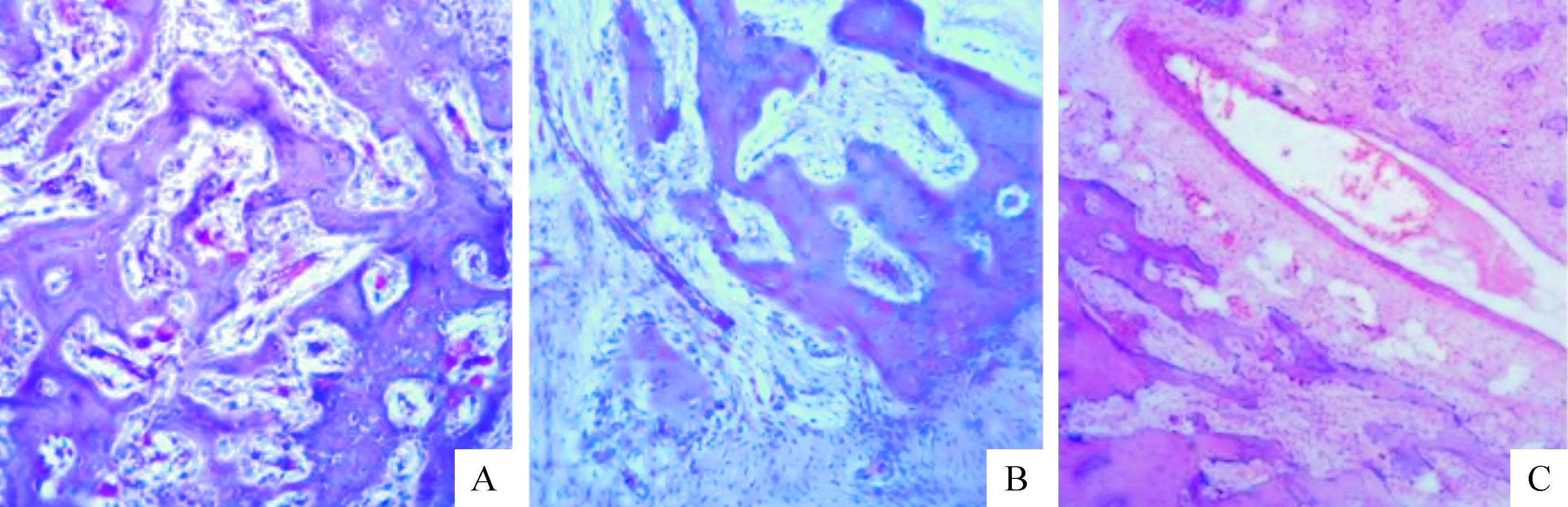
Figure 5. Hematoxylin and eosin staining in the 12th week. A: antigen-extracted xenogeneic cancellous bone/rhBMP-2 group (×100); B: antigen-extracted xenogeneic cancellous bone group (×100); C: blank control group(×50).

表4 新生骨面积百分比
讨 论
临床工作中,患者由肿瘤、外伤、先天畸形等所引起的口腔颌面部的大面积骨骼缺损,由于颌面部解剖结构的特殊性,大大增加了临床骨缺损修复的难度。在临床工作和基础研究中,发展了针对大面积骨缺损修复的多元化治疗策略,即将医学、生物学、化学、材料学及工程学等多学科联合应用于骨组织工程,培育有成骨活性的组织,挖掘机体自身储存的修复潜力,修复及重建颌骨缺损区的结构,维持及改善其功能[6]。组织工程骨的出现使得大面积骨缺损的修复具备了更多的可能性。在本实验中,动物的下颌骨缺损选择15 mm×6 mm。12周后,空白对照组无法完全愈合,表明兔无法在短期内自行修复缺损。
骨组织工程有3个关键要素,分别为种子细胞、支架材料、生长因子[7]。本实验采用的去抗原异种骨+rhBMP-2是其建造原理之一:支架材料+生长因子。
骨组织工程的核心在于构建细胞或生长因子生物支架材料复合体。有研究表明骨形成所需的最小孔径至少为100 μm,理想的适合骨生长的孔径为300~500 μm[8]。本实验所采用的异种骨为猪的松质骨(髂骨),经过相关的去抗原处理后保留了原有的骨骼组织结构。雷荣昌等[9]对猪松质骨(髂骨)支架结构的研究中发现猪松质骨支架孔径为(387.54±21.60) μm,孔隙率为78.26%±2.01%;最大抗压强度和抗压力分别为25 MPa和12 N。这说明松质骨保留了天然骨组织良好的孔隙率和孔隙交通,为生长因子的吸附以及成骨细胞的生长、分化提供良好的支架。实验中,X线片和HE染色均显示异种去抗原松质骨组的植入材料骨组织逐渐降解吸收而被新骨替代,但HE染色显示植入骨中间区域无明显新骨形成, 说明骨替代从两侧向中间进行。所以本实验所使用异种去抗原松质骨具有良好的骨传导性并且能够被降解吸收,无骨诱导性。
生长因子是组织工程骨的另一关键要素。BMP是已知的骨生长因子中对骨的形成作用最强的生长因子,对骨组织的形成、骨组织的生长、骨组织的钙化矿化及骨损伤修复均有促进作用[10]。Matsumoto等[11]的研究表明BMP-2可发挥起骨诱导作用,修复大面积的骨缺损。大量的实验研究也表明BMP具有良好的骨诱导性[12-13]。本实验应用的rhBMP-2是由暨南大学生物工程研究所利用基因工程技术在大肠杆菌中表达并经纯化复性的产物,活性检测实验显示,它具有良好的骨诱导活性[14]。实验中,从X线片可发现,异种去抗原松质骨/rhBMP-2组比异种去抗原松质骨组更快完成了骨替代,同时在HE病理切片中也证实了这一点。经统计分析,12周时异种去抗原松质骨组和异种去抗原松质骨/rhBMP-2组之间的成骨效能存在显著差异,异种去抗原松质骨/rhBMP-2组具备更好的成骨效能。这与rhBMP-2的骨诱导作用密切相关。随着时间的增长, HE染色镜下见各时点均存在新骨生成,及大量的新生血管、成骨细胞,表明rhBMP-2能持续发挥诱导成骨作用。总之,rhBMP-2能够吸附在异种去抗原松质骨支架中发挥稳定的骨诱导作用。
综上所述,异种去抗原松质骨能够作为骨传导支架,能很好地吸附rhBMP-2,是rhBMP-2良好的载体;异种去抗原松质骨/rhBMP-2复合材料能起到持续成骨的作用,加速了骨缺损修复速度,是一种较好的组织工程骨修复材料。
[参 考 文 献]
[1] Finkemeier CG. Bone-grafting and bone-graft substitutes[J]. J Bone Joint Surg Am, 2002, 84(3):454-464.
[2] Toms AD, Barker RL, Jones RS, et al. Impaction bone-grafting in revision joint replacement surgery [J]. J Bone Joint Surg Am, 2004,86(9):2050-2060.
[3] Issa JP, Nascimento C, Iyomasa MM, et al. Bone healing process in critical-sized defects by rhBMP-2 using poloxamer gel and collagen sponge as carriers[J].Micron,2008,39(1):17-24.
[4] Steinhardt Y, Aslan H, Regev E, et al. Maxillofacial-derived stem cells regenerate critical mandibular bone defect[J]. Tissue Eng Part A, 2008,14(11):1763-1773.
[5] 彭 磊, 胡蕴玉, 薛恩兴, 等.成骨细胞复合去抗原异种松质骨再造骨组织的实验研究[J].温州医学院学报,2006,36(1):16-19.
[6] Drosse I,Volkmer E,Capanna R,et al. Tissue engineering for bone defect healing: an update on a multi-component approach [J]. Injury,2008,39(Suppl 2):S9-S20.
[7] 杨维东, 毛天球.口腔颌面骨替代材料与骨组织工程[J].实用口腔医学杂志,1999,15(6):469-471.
[8] Kuhne JH, Bartl R, Frisch B, et al. Bone formation in coralline hydroxyapatite. Effects of pore size studied in rabbits[J]. Acta Orthop Scand, 1994,65(3):246-252.
[9] 雷荣昌,翦新春.松质骨支架的制备及结构特征观察 [J].生物医学工程与临床,2006,10(3):128-130.
[10] Yu LM, Wang ZL. Advances of bone morphogenetic protein 2 induced ectopic bone formation in skeletal muscle [J]. J Oral Maxillofac Surg,2008, 18(4):300-303.
[11] Matsumoto G, Omi Y, Kubota E, et al. Enhanced regeneration of critical bone defects using a biodegradable gelatin sponge and beta-tricalcium phosphate with bone morphogenetic protein-2[J]. J Biomater Appl, 2009,24(4):327-342.
[12] Shin JH, Kim KH, Kim SH, et al.Exvivobone morphogenetic protein-2 gene delivery using gingival fibroblasts promotes bone regeneration in rats[J]. J Clin Periodontol, 2010,37(3):305-311.
[13] Ben-David D, Srouji S, Shapira-Schweitzer K, et al. Low dose BMP-2 treatment for bone repair using a PEGylated fibrinogen hydrogel matrix[J]. Biomaterials, 2013, 34(12):2902-2910.
[14] Sun F, Wang J, Sun J, et al. Expression, purification and refolding of recombinant human bone morphogenetic protein-2 inEscherichiacoli[J].Chin J Pathophysiol(中国病理生理杂志), 2005,21 (8):1480-1485.

