二氧化碳在银电极上发生电还原反应时的电极失活原因
王晓春,杨冬伟,李露,王琴,施锦
(昆明理工大学冶金与能源工程学院,云南 昆明650093)
由于工业的快速发展,空气中CO2的浓度不断升高,导致“温室效应”和一系列严重的自然灾害。为了缓解全球变暖的趋势,人们尝试采取多种措施以减少CO2排放。冶金行业是CO2排放大户[1],据世界资源研究所(WRI)估算,到2010年我国钢铁产能达到6.3亿吨,CO2排放量超过11亿吨,约占全国碳排放总量的14%[2-6]。随着中国钢铁产能的进一步提高,CO2排放量将进一步增加,钢铁产业面临巨大的碳减排压力。
将CO2转化为有用化学品,减少化石燃料使用量,是实现CO2减排的重要技术途径[7-9]。目前,针对CO2资源化利用,国内已有许多研究[10-15],主 要 方 法 有 高 温 高 压 催 化 氢 化 法[16]、生物转化法、光电化学催化法和电化学催化还原法[17]等,其中CO2电还原方法由于能在常温常压下获得较好的转化率,通过改变电位能够控制反应速度及产物分布等优点,在工业化领域具有很好的应用前景[18]。
近年来,“甲醇经济”受到了广泛的关注和讨论,诺贝尔化学奖获得者George.A.Olah提出“甲醇经济”的目的,是想籍由“CO2-CH3OHCO2”循环,解决未来一系列重要的能源环境问题,当然,实现碳循环所需的能源必须来自于可再生能源。将CO2直接氢化还原为CH3OH是一种研究得比较深入的CO2转CH3OH技术,这种方法早在1927年就被提出,在历经80多年研究之后,目前还未彻底实现大规模工业化应用,原因在于:①CO2转CH3OH的化学平衡转化率低,理论转化率不足40%;②CO2氢化还原制CH3OH过程中有水生成,水对反应过程有危害;③催化剂活性低,易中毒失活;④合成气净化成本高;⑤反应过程中有1/3的H2被转化为水浪费掉等[19-20]。因此,到目前为止,几乎所有的甲醇工业均采用合成气(CO+H2)为原料,通过CO氢化还原的方法合成CH3OH,合成气主要来源于化石燃料。2009年,George.A.Olah进一步提出(图1):以可再生电能(风电、光电、潮汐能发电等)为电解电能,用电化学催化还原的方法将CO2、H2O转化为CO、H2,然后再将CO氢化还原为CH3OH,这种方法是一种可行的CO2转CH3OH技术。Charles、Christopher和Niall等[21-31]也 在 权 威 期刊上发表文章,认为图1所示的研究思路具有重要的应用前景,其突出的优点在于合成甲醇所需的合成气无需来源于化石燃料,而是来自于人工合成,是可持续发展的。
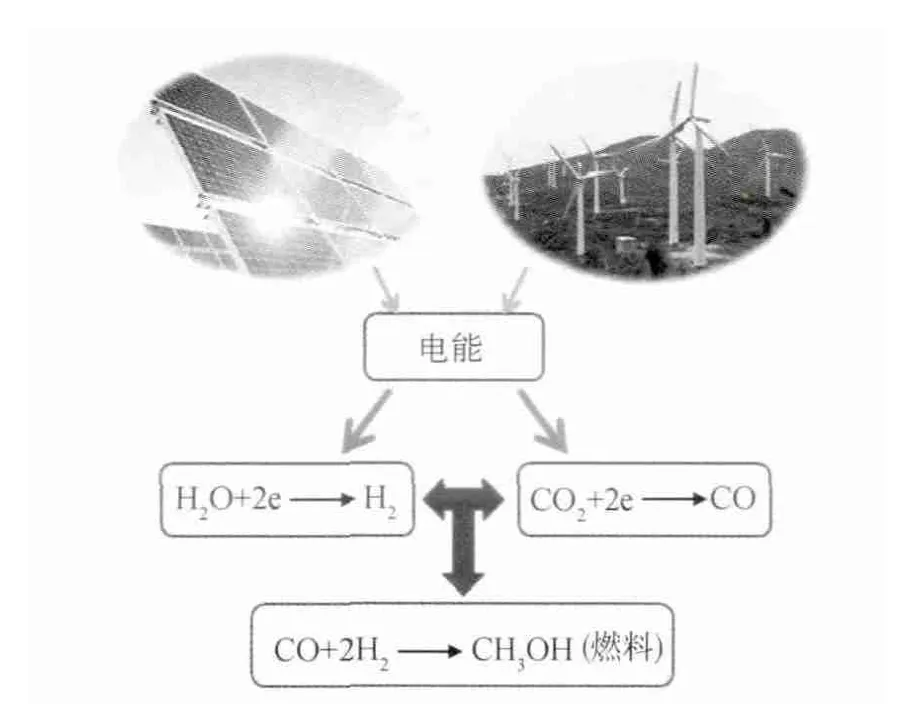
图1 以CO2、H2O和可再生能源为基本要素合成液态甲醇燃料的技术路线
将CO2电还原为CO,是图1所示技术路线的核心关键之所在。根据文献报道[32-36],在KHCO3水溶液中,CO2可以在银电极上发生电还原反应,生成CO,但对CO2在电还原反应动力学过程的研究不够深入,尤其是在CO2长周期电解过程中,电极表面可能会有有毒物质生成,导致电极中毒失活,并使电流效率和电流密度迅速降低,本文将针对这些问题开展研究工作,为进一步探索提高效率和电流密度提供理论依据和技术借鉴。
1 实验方法
1.1 试剂及装置
碳酸氢钾,分析纯,国药集团化学试剂有限公司;二氧化碳,纯度≥99.999%,昆明梅塞尔气体产品有限公司;氢气,纯度≥99.999%,昆明梅塞尔气体产品有限公司;离子交换膜,Nafion 117,购于杜邦公司,气相色谱柱,5A分子筛,购于兰州化学物理研究所;电解液用二次蒸馏水配制。
采用FEI-quanta 200型扫描电子显微镜(荷兰FEI公司)观察Ag电极表面形貌,CHI 760C型电化学工作站(上海辰华仪器厂)测定了Ag电极的电化学参数,气相色谱仪(GC-4000A,北京东西电子)分析阴极气相反应产物的成分,PHI 5500型X射 线 电 子 光 谱 仪(THERMO FISHERSCIENTIFIC公司)进行表面分析。
1.2 电化学实验
实验装置为H型电解池(图2),用离子交换膜将电解池分隔为阴极室和阳极室,阴极室电解液采用0.1mol/L KHCO3水溶液,阳极室电解液采用0.1mol/L H2SO4水溶液,以纯度为99.9%的Ag片(1cm×1cm)为工作电极,纯度99.9%的石墨电极为辅助电极,饱和甘汞电极(SCE)为参比电极。实验前,Ag电极表面先用0.1μm的氧化铝粉末打磨至光亮,然后用超声波清洗,丙酮除油,最后用大量二次水冲洗。电化学测试前,阴极电解液中先通入N230min以除去溶解氧,再通入CO230min,使阴极电解液中的CO2浓度达到饱和,测试过程中,持续不断地通入CO2,流量控制在30mL/min。线性扫描测试的扫描范围为0~-2.0V,扫描速度为50mV/s。恒电位电解的测试电位为-2.0V。电化学阻抗的测试电位为-1.9V,振幅10mV,频率范围105~10-1Hz。气相色谱仪色谱柱采用5A分子筛,氢气作为载气,载气流速为25mL/min,热导温度为110℃,柱箱温度为130℃,汽化室温度为130℃。
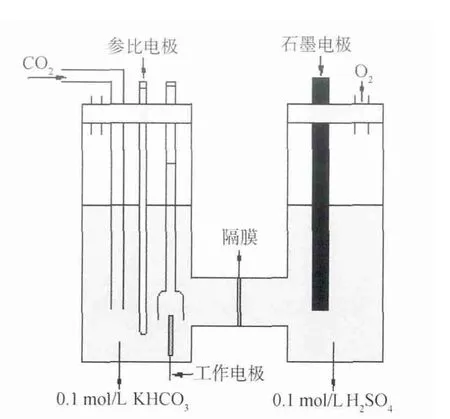
图2 电化学反应装置示意图
2 实验结果及讨论
2.1 电流效率计算
图3为CO2在Ag电极上发生电还原反应时的CO气相色谱图;图4为CO2在Ag电极发生电还原反应生成CO时电流效率随时间的变化曲线。可以看出,在电还原反应的初期,阴极气体产物CO生成量较多,CO的电流效率较高,但随着反应的进行,阴极生成的CO减少,电流效率降低,40民后,电流效率几乎降低为零,并且发现在阴极表面生成了一层有害物质,导致电极中毒失活,严重影响CO2电还原反应。
2.2 扫描电镜
图5(a)为Ag电极在实验前的表面微观形貌,可见电极表面光滑、均匀,无点坑。图5(b)为Ag电极在CO2电还原反应进行了2h后的表面微观形貌,可以看到,电极表面确实生成了一层明显的棕黑色物质,且斑点大小不一。
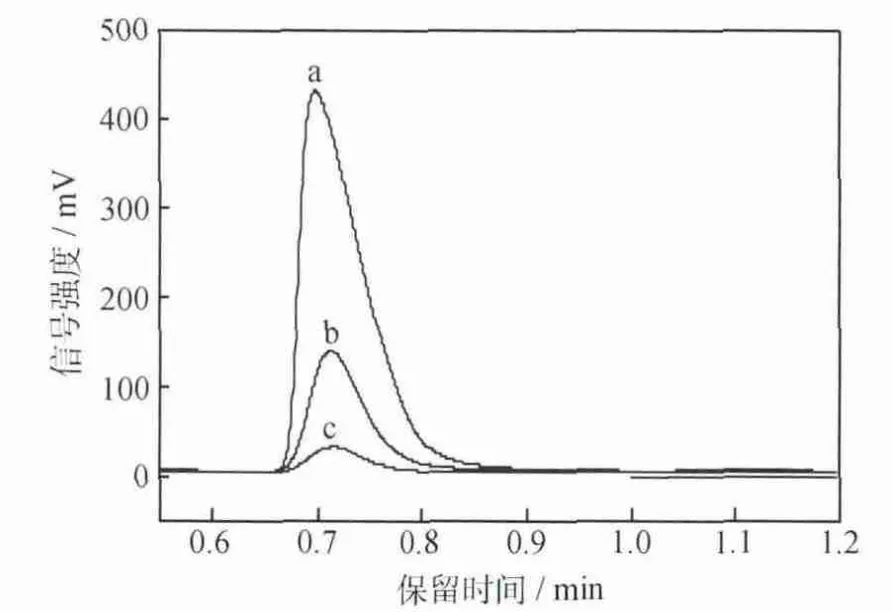
图3 CO2在Ag电极上发生电还原反应时不同时间的CO气相色谱图
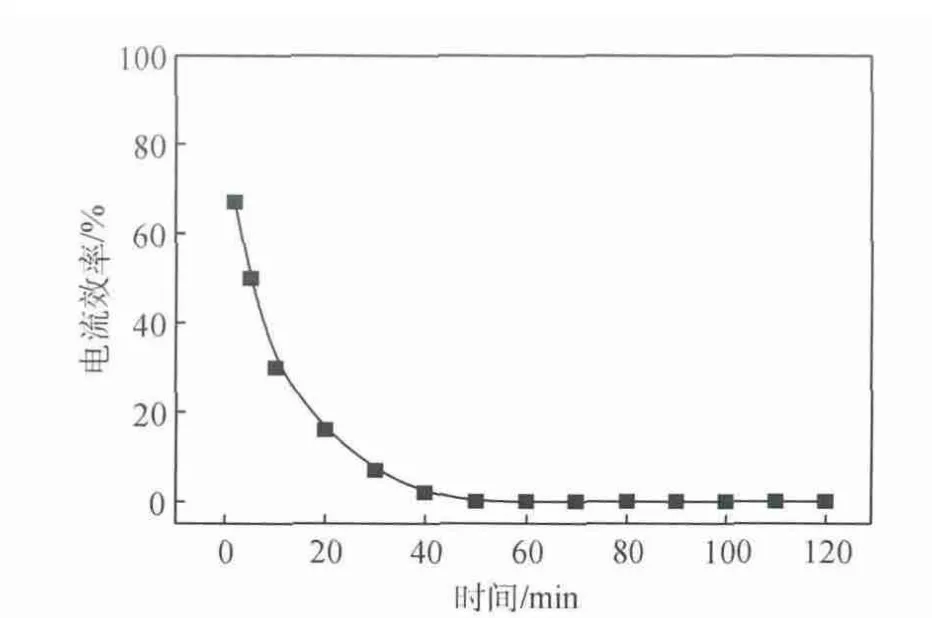
图4 CO2在Ag电极上发生电还原反应生成CO时电流效率随时间的变化曲线

图5 Ag电极在实验前和实验后的SEM图
2.3 极化曲线与恒电位电解曲线
图6为CO2在Ag电极上发生电还原反应不同时间的线性扫描伏安曲线,可以看出,在电还原反应的初期电流密度较大,电解进行20min后,电流密度迅速降低。图7为CO2在Ag电极上发生电还原反应的恒电位电解曲线,可以看出,随着电还原反应的不断进行,电流密度逐渐减小,与图6测试的结果一致。说明阴极表面生成的有害物质,严重影响CO2电还原反应。

图6 CO2在Ag电极上发生电还原反应不同时间的线性扫描伏安曲线

图7 CO2在Ag电极上发生电还原反应的恒电位电解曲线
2.4 塔菲尔曲线
图8为CO2在Ag电极上发生电还原反应时不同时间的Tafel曲线,测得a、b的平衡电位分别为-1.403V、-1.156V,交换电流密度i0分别为1.936×10-4A/m2、2.769×10-4A/cm2。可以看出,电解进行20min后,反应平衡电位负移,交换电流密度减小,电化学反应的过电位变大,电极活性降低。
根据电荷转移电阻公式[37]Rct=RT/nFi0,电解进行20min后,电荷转移电阻增大,增大了反应所需势垒,使CO2电还原反应变得困难。说明Ag电极表面生成的有害物质,对CO2电还原反应造成了严重影响。
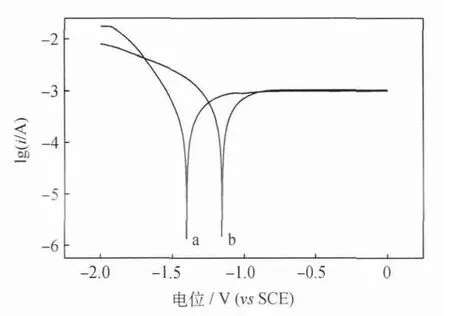
图8 CO2在Ag电极上发生电还原反应不同时间的Tafel曲线
2.5 电化学阻抗谱
采用前文所述的实验方法,对0.1mol/L KHCO3水溶液中Ag电极的电化学阻抗谱进行了测试。图9为CO2在电解液中电还原反应不同时间的Ag电极测得的Nyquist图和Bode图。从图9中可以直观地发现,电还原反应进行2h后Ag电极低频区对应弧线半径明显大于电还原反应刚进行时,且Bode相角也相对较高。

图9 Ag电极在0.1mol/L KHCO3电解液中的电化学阻抗谱图
对电解液中的电极按照图10所示的等效电路进行拟合,所得的结果如表1所示。图10中,Rs表示溶液电阻,Rr表示反应电阻,Cd表示电极表面双电层电容。各有关元件的拟合值列于表1中。
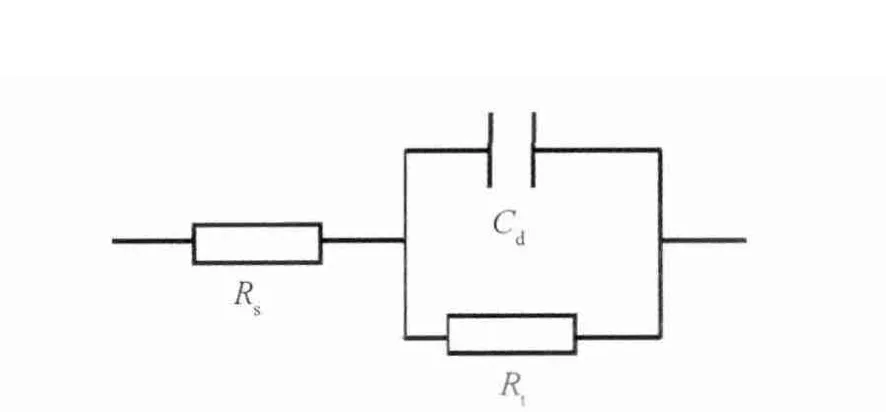
图10 Ag电极在0.1mol/L KHCO3电解液中的等效电路图
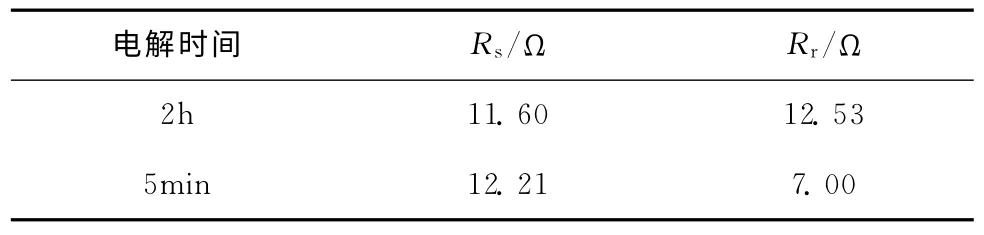
表1 电解液中等效电路元件拟合结果
由表1可以看出,Ag电极上CO2电还原反应进行2h后的反应电阻比反应刚进行时的大,说明反应进行2h后,CO2在Ag电极上进行电还原反应变得更加缓慢困难,即Ag电极的活性降低。
2.6 XPS分析
XPS能谱能反映出各元素不同化合价态和同种价态原子的不同结合环境的差异,从中可得到电极表面有害物质的有关化学组成信息。
图11为CO2电还原反应进行2h后Ag电极表面的XPS全扫描谱图,可以看出,电极表面附着有Zn、C等物质。图12为CO2电还原反应进行2h后Ag电极表面C1s的XPS谱。为了更详细地研究表面元素的价态,对表面的C1s的XPS谱进行了分峰拟合,所得的结果如图13和表2所示。
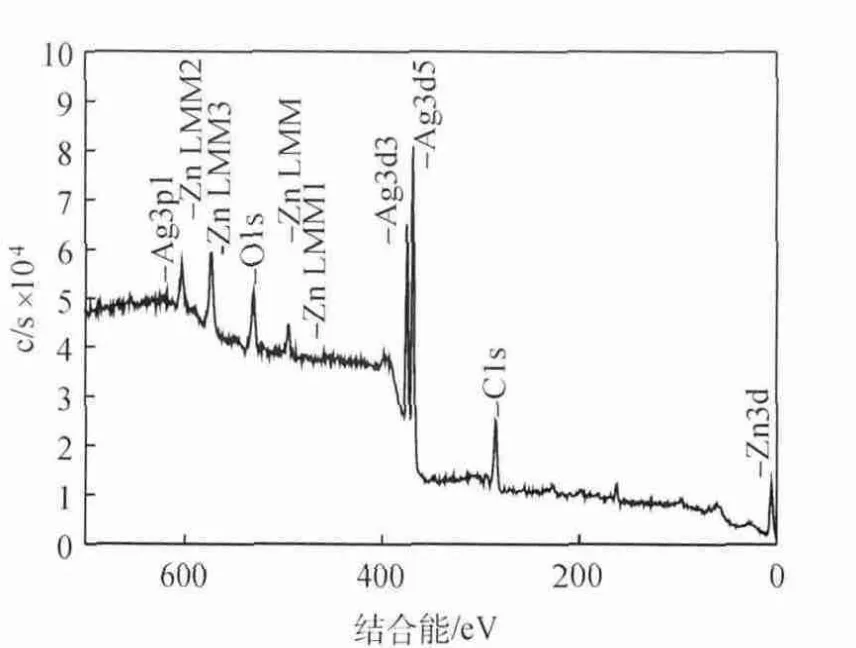
图11 CO2电还原反应进行2h后Ag电极表面的XPS全扫描谱

图12 CO2电还原反应进行2h后Ag电极表面C1s精细谱
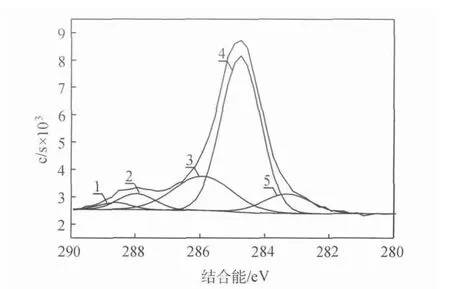
图13 Ag电极表面C1s的XPS谱及其分峰拟合曲线
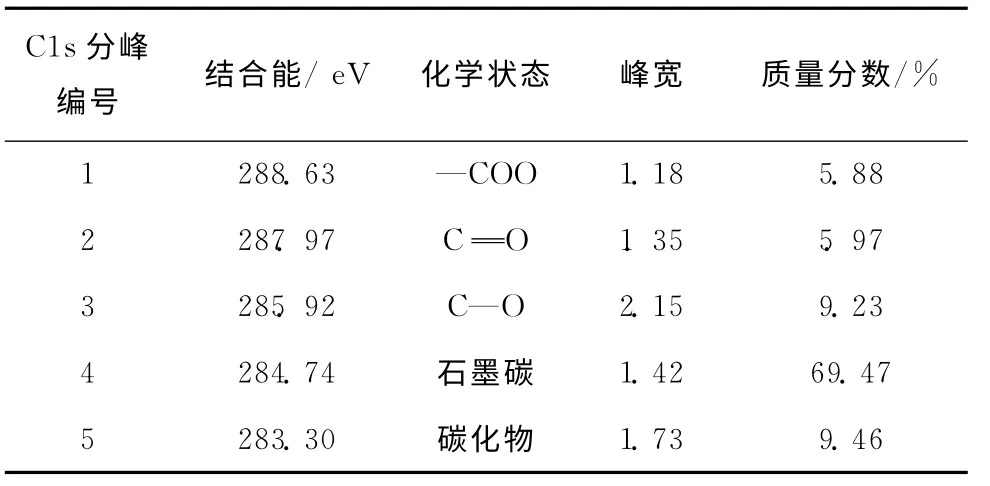
表2 C1sXPS谱的分峰拟合结果
由图13可知,电极表面C1s精细谱不对称,存在一个很强的主峰和一个较弱的肩峰。由表2可知[38-39],位于288.63eV处 的 峰对应为—COO键,位 于287.97eV处 的 峰 对 应 为 =C O键,位 于285.92eV处 的 峰 对 应 为C—O键。在 位 于284.74eV的峰对应为石墨碳,该峰位特别明显,占碳元素总量的69.47%,说明石墨碳为CO2电还原反应进行2h后Ag电极表面有害物质的主要成分,来自于CO2电还原过程中,生成的中间物质,附着在电极表面上。且试剂中含有的微量金属,被带入到电解液中,与图11全谱图结果相一致。在CO2电还原过程中,电解液中金属离子在阴极被还原,并附着在电极表面上[35]。由于Zn2+等金属离子对一氧化碳的形成没有电催化活性,因此,附着在电极表面的任何重金属都将影响银电极的催化活性,进一步阻碍CO2电还原反应进行。位于283.30eV的峰对应为碳化物,可能是电解液中的金属离子与中间物质形成了碳化锌等碳化物,吸附在电极表面上,导致电极中毒失活。
3 结 论
CO2在KHCO3水溶液中进行电还原反应过程中,银电极表面生成了一层有害物质,导致了电极中毒失活。CO2电还原反应进行一段时间后,生成CO的电流效率和电流密度迅速降低,平衡电位负移,交换电流密度变小,电荷转移电阻增大,CO2电还原反应无法连续高效地进行,说明附着在银电极表面的有害物质对银电极催化活性的影响很大。X射线光电子能谱(XPS)测试结果表明,附着在阴极表面的有害物质主要成分为石墨碳,由于配制电解液时,分析纯KHCO3试剂时中含有微量锌离子,被带入到电解液中,并在阴极上被还原为有害附着物沉积在阴极表面,对阴极材料电催化活性的影响很大。
[1] 国家统计局工业交通统计司.中国工业经济统计年鉴2007[M].北京:中国统计出版社,2007.
[2] World Resources Institute.Climate analysis indicators tool(CAIT)version 2.0[R].Washington,D C,2005.
[3] 杨晓东,张玲.钢铁工业温室气体排放与减排[J].钢铁,2003,38(7):65-69.
[4] 王克,王灿,吕学都,等.基于LEAP的中国钢铁行业CO2减排潜力分析[J].清华大学学报:自然科学版,2006,46(12):1982-1986.
[5] 张春霞,胡长庆,严定鎏,等.温室气体和钢铁工业减排措施[J].中国冶金,2007,17(1):7-12.
[6] 蔡九菊,王建军,张琦,等.钢铁企业物质流、能量流及其对CO2排放的影响[J].环境科学研究,2008,21(1):196-200.
[7] Kaneco S,Katsumata H,Suzuki T,et al.Electrochemical reduction of carbon dioxide to ethylene at a copper electrode in methanol using potassium hydroxide and rubidium hydroxide supporting electrolytes[J].ElectrochimActa,2006,51:3316.
[8] Yano J,Morita T,Shimano K,et al.Selective ethylene formation by pulse-mode electrochemical reduction of carbon dioxide using copper and copper-oxide electrodes[J].JournalofSolidStateElectrochemistry,2007(11):554.
[9] 陶映初,吴少晖,张曦.CO2电还原研究进展[J].化学通报,2001,64(5):272-277.
[10] 李现勇.CO2减排及封存利用技术概况及发展[J].电力设备,2008,9(5):7-10.
[11] 王晓刚,李立清,唐琳,等.CO2资源化利用的现状及前景[J].化工环保,2006,26(3):198-203.
[12] 黄黎明,陈赓良.二氧化碳的回收利用与捕集储存[J].石油与天然气化工,2006,35(5):354-358.
[13] 沙高原,刘颖吴,殷瑞钰,等.钢铁工业节能与CO2排放现状及对策分析[J].冶金能源,2008,27(1):3-5,18.
[14] 陈进,兰治淮.工业废气CO2的回收利用[J].化工科技市场,2006,29(11):28-31.
[15] 吴昊.应对二氧化碳浓度上升问题的研究:CO2的捕获、储存与利用[J].中国安全科学学报,2008,18(8):5-11.
[16] 王琳,姜玄珍.对ZrO2作为CO2氢化反应催化剂载体的研究[J].高校化学工程学报,1990,4(3):284-289.
[17] 张敏,陈立班,李卓美.CO2催化转化研究新进展[J].天然气化工,2001,26(1):45-49.
[18] 徐用军,陈福明,朱明阳.二氧化碳还原技术的研究进展[J].化工进展,1995,14(3):22-27.
[19] Kung H H.[J].Catal.Rev.Sci.,Eng.,1980,22(2):235-259.
[20] 储伟,吴玉塘,罗仕忠.低温甲醇液相合成催化剂及工艺的研究进展[J].化学进展,2001,13(2):128-134.
[21] Gabriele C,Elsje A Q,Siglinda P.Catalysis for CO2conversion:A key technology for rapid introduction of renewable energy in the value chain of chemical industries[J].EnergyEnviron.Sci.,2013(6):1711.
[22] Jin Shi,Feng Shi,Ning Song.A novel electrolysis cell for CO2reduction to CO in ionic liquid/organic solvent electrolyte[J].JournalofPowerSources,2014,159:50-53.
[23] Niall M,Nick F,Antoine B.An overview of CO2capture technologies[J].EnergyEnviron.Sci.,2010,3:1645-1669.
[24] Charles D,Paul L R,John B K.Design of an electrochemical cell making syngas(CO+H2)from CO2and H2O reduction at room temperature[J].J.Electrochem.Soc.,2008,155(1):B42-B49.
[25] George A O,Alain G.Chemical recycling of carbon dioxide to methanol and dimethyl ether:From greenhouse gas to renewable,environmentally carbon neutral fuels and synthetic hydrocarbons[J].J.Org.Chem.,2009,74:487-498.
[26] Gregory B S,Torsten R,Burkhard R.Energy storage by the electrochemical reduction of CO2to CO at a porous Au film[J].JournalofElectroanalyticalChemistry,2002,526:125-133.
[27] Brian A R,Michael R T,et al.Ionic liquid-mediated selective conversion of CO2to CO at low overpotentials[J].Science,334,643(2011).
[28] Brian A R,Wei Zhu,Gaurav K.Water enhancement of CO2conversion on silver in 1-ethyl-3-methylimidazolium tetrafluoroborate[J].JournalofTheElectrochemical Society,2013,160(2):H138-H141.
[29] Devin T W,Paul J A.Prospects of CO2utilizationviadirect heterogeneous electrochemical reduction[J].J.Phys.Chem.Lett.,2010,1(24):3451-3458.
[30] Christopher G,Sune D E,Mogens M.Sustainable hydrocarbon fuels by recycling CO2and H2O with renewable or nuclear energy[J].RenewableandSustainableEnergy Reviews,2011,15:1-23.
[31] George A.Olah.Methanol is produced nearly exclusively from synthesis gas(CO+H2)[J].Angew.Chem.Int.Ed.,2005,44:2636-2639.
[32] Mostafa Hossain A G M,Nagaoka T,Ogura K.Palladium and cobalt complexes of substituted quinoline,bipyridine and phenanthroline as catalysts for electrochemical reduction of carbon dioxide[J].Electrochim.Acta,1996,41:2773-2780.
[33] Wasmus S,Cattaneo E,Vielstich W.Reduction of carbon dioxide to methane and ethane:An on-line MS study with rotating electrodes[J].Electrochim.Acta,1990,35:771-775.
[34] Kyriacou G Z,Anagnostopoulos A K.Influence of CO2partial pressure and the supporting electrolyte cation on the product distribution in CO2electroreduction[J].J.Electroanal.Chem.,1992,322:233-246.
[35] Hori Y,Konishi H,Futamura T,et al.“Deactivation of copper electrode”in electrochemical reduction of CO2[J].Electrochim.Acta,2005,50:5354-5369.
[36] Smith B D,Irish D E,Kedzierzawsk P,et al.A Surface enhanced roman scattering study of the intermediate and poisoning species formed during the electrochemical reduction of CO2on copper[J].J.Electrochem.Soc.,1997,144:4288-4296.
[37] 巴德.电化学方法原理和应用[M].邵元华,朱果逸,译.第2版.北京:化学工业出版社,2012:71-72.
[38] Moulder J F,Stickle W F,et al.Handbook of X-ray Photoelectron Spectroscopy[M].Physical Electronics Inc.,1995.
[39] Wagner C D.Handbook of X-ray Photoelectron Spectroscopy[M].New York:Perkin-Elmer,1979.

