冻融对内蒙古温带贝加尔针茅草甸草原N2O通量的影响
秦赛赛,翟秋敏,杜 睿,梁宗敏,杜鹏瑞,路则栋,李梓铭,3(.中国科学院大学资源与环境学院,北京 00049;.河南大学环境与规划学院,河南 开封 475000;3.北京市气象局,北京 00089)
冻融对内蒙古温带贝加尔针茅草甸草原N2O通量的影响
秦赛赛1,2,翟秋敏2,杜 睿1*,梁宗敏1,杜鹏瑞1,路则栋1,李梓铭1,3(1.中国科学院大学资源与环境学院,北京 100049;2.河南大学环境与规划学院,河南 开封 475000;3.北京市气象局,北京 100089)
本研究以内蒙古呼伦贝尔草甸草原为研究对象,通过室内模拟实验与野外观测实验相结合,分析不同土层、放牧与封育、长期与短期冻融、不同冻融频率与冻融温差强度对草地土壤N2O产生与排放的影响.结果表明:冻融期间,从地表到下层15cm土壤N2O的产生速率随深度的增加而逐渐减少,N2O的产生主要来源于0~9cm的表层土壤;冻融期间温差相同的情况下,冻融次数越多,N2O的产生速率越小;N2O的产生速率随着温差的变小而减少;冻融期间封育样地的N2O排放量大于放牧样地,且封育样地的N2O排放量占全年排放总量的25.09%,大于放牧样地(12.38%),但从观测年排放总量看,放牧却促进了草地N2O源的功能;草地春融期间的N2O排放量是整个冻融期N2O排放量的最大贡献者.
冻融;温带贝加尔针茅草甸草原;N2O通量
N2O、CO2等作为主要的温室气体在地球的辐射平衡中扮演着重要角色[1].截至2013年5月,地球大气层中的 CO2浓度已超过 400ppm,是导致全球变暖的主要原因.N2O在百年尺度上的增温潜势是CO2的300倍,在大气中的停留时间也更长,约为112年[2],N2O容易通过光化学反应与臭氧层中的 O3发生反应,引起臭氧层破坏,增大了地球表面的紫外辐射,使人类的生存环境受到威胁.
土壤是 N2O的主要来源[3],大气中每年有近60%~80%的N2O来源于土壤[4].土壤冻融交替是由于昼夜和季节的热量变化导致土壤在一定深度的土层所发生的反复冻结-解冻的过程,在中高纬度和高海拔地区的低温生态系统土壤中比较常见[5].冻融能破坏土壤团聚体的结构、改变土壤水分的形态和水热传导速率、引起土壤养分的流失和肥力退化、造成微生物种群和数量的变化、导致痕量气体如 N2O、CO2的排放量增加等[5-8].
研究表明,土壤冻融交替过程中 N2O、CO2排放通量增大的情况在不同的生态系统中普遍存在,如:高寒草甸[9]、北方针叶林[10]、农田[11]、苔原、泥炭地[12]等.冻融期土壤N2O的排放量可占到全年排放总量的 80%以上[13].在全球变暖的背景下,高纬度和高海拔地区将会经历更加广泛、强度更大的冻融循环[14].日益复杂的冻融循环对温室气体排放的作用将会增强,从而增加了全球温室气体排放估算的不确定性.目前我国对冻融期间温室气体排放的研究主要集中于青藏高原区和东北黑土区,对温带草甸草原土壤的研究尚未有相关报道.地处内蒙古东北部的呼伦贝尔草甸草原是我国北方温带草原的主体类型之一,也是目前保存完好的草甸草原,面积达141.90万hm2,对其冻融期间温室气体排放的研究有重大意义.已有研究多以室内控制实验为主,缺乏野外实际观测结果的验证,本文通过室内冻融模拟实验结合野外田间观测实验,探讨我国温带草甸草原不同人类活动和草场管理措施下不同深度的表层土壤N2O的产生速率与排放通量对于冻融交替周期的长短、频率、温差强度等的响应.
1 研究地区与研究方法
1.1 研究地区概况
呼伦贝尔草原(47°05'~53°20'N,115°31'~126°04'E)位于内蒙古东北部,属于温带半干旱大陆性气候,冬季漫长寒冷,春季降水少、多大风,蒸发量大,夏季温凉而短促,秋季降温快,霜冻早.年降水量250~400mm,多集中在7、8月份,降水量变率大,分布不均匀,年际变化大,年均温-3~0
℃,土壤类型主要为黑钙土或暗栗钙土,主要植被类型是以贝加尔针茅、羊草、线叶菊等为优势群落的草甸草原[15].呼伦贝尔草原通常每年10月上旬即进入冬季直至次年3、4月份甚至5月初,5~6月为春季,7~8月为夏季,8月中旬至 9月为秋季.而3月、4月以及9月中旬~10月上旬多数日期的日最高气温大于 0℃而日最低气温小于0℃,草地表层土壤经历冻融过程,为冻融期.本研究选取中国农业科学院呼伦贝尔草原生态系统国家野外科学观测站附近的谢尔塔拉十一队贝加尔针茅草甸草原观测样地(中心坐标: 49°21'10"N,120°6'9"E)围栏内、外的草地作为实验观测点,该样地于 2006年底围栏封育,围封前该区是当地牧民自由放牧区,主要放牧家畜为奶牛,围封后栏外仍然是自由放牧区.草地植被类型主要是贝加尔针茅+日荫菅+羊草.伴生种及常见种有裂叶蒿、细叶白头翁、多裂叶荆芥、囊花鸢尾、扁蓿豆、长柱沙参、细叶葱[15].表1为贝加尔针茅草甸草原封育、放牧样地的土壤参数.
1.2 实验设计
1.2.1 室内冻融实验设计、采样及数据计算为尽量减少土壤空间异质性差异,于2013年5月中旬分别在贝加尔针茅封育、放牧样地采样箱附近分别选取 25cm×25cm 的样方,采集深度为20cm的表层原状土柱运回实验室,然后用切片刀,从表层量取到深度15cm处,以3cm为土层高度,从土柱底部分切 5个土层,共分为 0~3cm、3~6cm、6~9cm、9~12cm、12~15cm 五个土层,然后用自制的直径 5cm的不锈钢柱状环刀分别切割成直径5cm、高3cm的原状土柱,每个土层保留3个重复,围栏内外共计30个土柱,随即称重,土柱平均重量为75.22g.
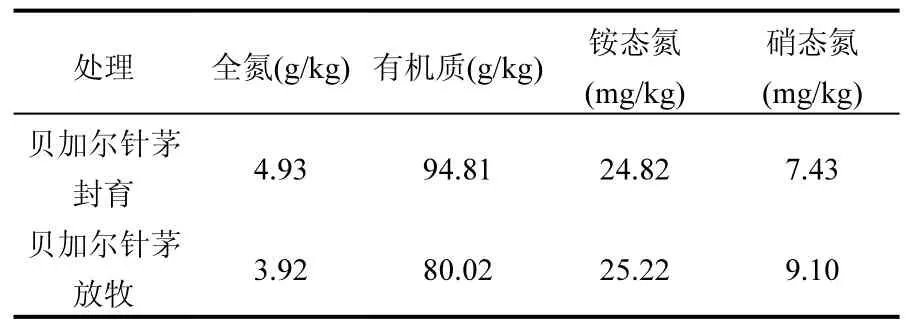
表1 贝加尔针茅草甸草原土壤参数[15]Table 1 Soil parameters of Stipa baicalensis meadow[15]
分别将土柱放入带有三通阀密封盖的玻璃培养瓶(平均体积为 360mL)进行模拟培养,用注射器将实验站自来水(当地地下水)沿瓶壁缓慢加入,保持水面淹过土柱顶部.随后将玻璃瓶置于调控好温度的培养箱内进行培养实验.根据设置在该样地的土壤温度探测仪对 2011年 8月至2012年5月的土壤20cm处的连续观测记录显示,在整个冬季(10月至次年5月),最低温度未低于-15℃而最高温度未高于 10℃,另外结合已有的实验研究的温度设置,此处冻融点的温度分别设置 为:-15℃ → 5 ℃→ -10 ℃→ 5 ℃→ -5℃ →5℃ →-5 ℃→ 10℃,共4对冻结与融化的温度节点,依次进行循环培养.
实验土柱分别在每个温度下连续培养7d,气体采样时间为培养后的第2h、8h、12h、24h、3d、7d.为了及时测定样品、保证测量数据的准确性,所有土柱在24h内加盖密闭培养,当24h样品采集结束随即进行开盖培养,培养过程中使土柱始终保持水淹状态,在培养第3d、7d的采样时间前10h开始加盖密闭培养,到预定时间进行采样.每次气体样品采集结束后,保证在24h内测试完毕, N2O、CO2气体浓度的测定采用气相色谱法[16].分析仪器采用美国安捷伦公司生产的7890Ⅱ型号气相色谱仪,进样系统由中国科学院大气物理研究所大气分中心设计改造(专利号: ZL92100938.0, ZL96249356.2),仪器内装离子火焰检测器(FID)和电子捕获检测器(ECD),FID用于检测CO2浓度,工作温度250℃,载气为高纯 N2,ECD用于检测 N2O 浓度,工作温度330℃,载气为高纯 N2.
模拟实验土壤N2O、CO2产生速率采用以下公式计算[17]:

式中:ρ为气体密度;△m和△c分别为△t时间内培养瓶内气体质量和混合比浓度变化;v为培养瓶内有效空间体积(360mL);M为土壤重量.
1.2.2 野外温室气体观测 从2011年8月开始至 2013年 10月进行呼伦贝尔草原生态系统CO2、N2O通量的常规观测.观测方法为静态箱-气相色谱法,采样箱(暗箱)的截面边长与高度根据研究区域植被的实际情况而定.样品的采集利用三通阀和医用注射器(60mL)在每个处理下设置3~4个平行重复采样.所采集的气体样品均在24h内送回实验室完成温室气体(N2O、CO2)浓度的分析测定.
采样频率根据植物的生长状况而定,生长季初期为一周一次;进入生长旺季,采样频率逐步加密至一周2次,进入冬季逐渐由每旬一次至每月一次,次年春季由非生长季进入生长季,逐步增大采样频率.采样时间同样根据植物的生长状况和气候条件而有所不同,通常罩箱时间的变化为 32~80min,从罩箱初时到罩箱结束共采集5次气体样品,采样间隔的变化为 8~20min.将测试气体浓度通过非线性模型验证后计算N2O的排放通量.
草地 N2O排放通量的计算详见文献[18].本文选用2012年5月~2013年5月贝加尔针茅封育、放牧样地的N2O通量数据研究冻融期间N2O的排放情况.
1.2.3 数据统计与分析 本文主要模拟研究冻融对土壤N2O产生速率以及排放通量的影响,由于土壤N2O的产生主要由土壤微生物的硝化与反硝化作用产生,因此本研究也同时分析了 CO2产生速率以研究冻融期间土壤呼吸速率的变化情况,从而进一步地验证冻融对土壤N2O产生与排放的影响规律.本研究的数据统计分析主要采用可重复单因变量双因素方差分析(LSD方法).数据分析在 SPSS 20.0 软件中完成;图表在Origin 8.0中完成.
2 结果与分析
2.1 不同土层和冻融时间对土壤N2O产生速率的影响
对于土层和时间的双因素方差分析结果表明,0~3cm、3~6cm土层与其余 3个土层之间的N2O产生速率存在显著差异,下部 3个土层的N2O通量差异较少.由5个土层各自在整个冻融循环期间栏内、栏外N2O产生速率的均值可知,5个土层从上到下N2O产生速率逐渐减少,5个土层 N2O的产生速率占总产生量的比例分别为27%、22%、21%、15%、15%(表2),这可能与呼伦贝尔草地土壤微生物碳、氮含量和土壤微生物数量均以表层最高,且随着土层深度增加而降低
[19]有关.有研究发现冻结期间观测到的N2O排放主要源于顶部5cm冻结土壤[20],蒙古高原的冻融日循环主要发生在表层 0~5cm[7].由此可以推断,冻融循环主要发生在表层土壤,观测到的N2O 排放高峰主要来自表层土壤.

表2 5个土层冻融期间N2O产生速率的平均值和占总产生量的百分比Table 2 The mean N2O production rates of 5layers during soil freezing-thawing and their contribution to the total production
方差分析结果表明,2h与其他培养时间长度N2O产生速率均存在显著差异.结合整个冻融过程中栏内、外土壤在各培养时间点的N2O、CO2产生速率的均值(图1)可以看出冻结、融化2h后的N2O、CO2产生速率值均为冻、融期间的最高值,而冻结2h后的N2O、CO2产生速率又大于进入融化2h后的.冻结或融化后大量微生物和根系死亡,死亡生物细胞内物质的释放为残余微生物提供了丰富的营养底物,而且刺激了存活微生物的活性,导致 N2O 排放高峰值的短暂出现.Muller[21]的研究表明:微生物作用是造成土壤冻融过程中N2O高排放量的主要原因,而CO2与N2O的变动趋势一致,证明了土壤微生物的反硝化作用是N2O产生的主要原因.而冰膜的存在阻碍了冻结在土壤团聚体中的N2O的释放,这也是N2O 产生高峰值的重要原因[11,21].经过冻结或融化 2h后 N2O产生速率的高峰值后,培养至 8h时,N2O的产生速率迅速降低,CO2产生速率的同步降低表明土壤中微生物的呼吸作用极为微弱,可能是由于冻结或融化造成了大量的微生物活性降低,前期峰值的产生所导致的土壤养分的过度消耗,也可能是导致其后N2O的产生速率减小的原因.8h~7d冻融期间,N2O产生速率的变化趋势与CO2的变化一致,证明微生物活性的变化影响着N2O的产生速率.
融化期间各土层和采样时间点N2O产生速率的显著差异比冻结期间大,即融化更能引起N2O排放的差异.融化期间土壤的总矿化作用高,N2O的排放达到高峰值[21].融化比冻结更能刺激微生物的活性,融化期间封冻在土壤团聚体内的N2O释放是不均衡的,因而导致了各土层和时间点更多的 N2O通量差异.因此土壤融化期间N2O产生速率的波动性更大.
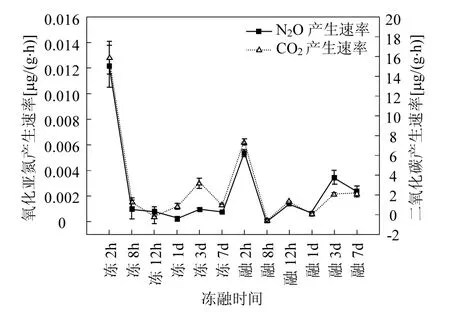
图1 整个冻融过程中土壤N2O、CO2产生速率的均值Fig.1 Mean N2O & CO2production rates from the soil during the whole process of freezing-thawing
2.2 冻融循环对不同草场管理措施(放牧与封育)下草原土壤N2O产生速率的影响
将每个温度下 0~12h内的培养设为短期冻结或短期融化,12h~7d设为长期冻结或长期融化,分别模拟深秋初冬时的昼夜温差较大所引起的冻融交替以及初春时节因气候条件不稳所产生的相对长时间的冻融交替过程.图2为栏内封育、栏外放牧4次长期与短期冻融期间N2O产生量.可以发现4次冻融循环中封育土壤的N2O产生量大于放牧土壤,结合表1贝加尔针茅草原的土壤参数,栏内封育土壤的全氮、有机质含量均高于栏外放牧土壤.由此可知冻融期间N2O的排放量与土壤自身的 C、N含量密切相关,土壤有机质是土壤呼吸的主要碳源[22].对锡林河流域草原CO2、N2O的排放与土壤有机碳、全 N含量、C/N值相关性研究发现,CO2、N2O 排放通量与有机碳含量、C/N值呈正相关[23].已有研究表明,一次和多次冻融下科尔沁沙地沙质草地、樟子松疏林草地和农田的土壤呼吸速率与未发生冻融作用时三者的大小排序一致,说明土地利用方式对冻融环境下的土壤呼吸有显著影响[23].上文的方差分析结果也表明,栏外冻融期间各时间点、各土层之间N2O排放通量的显著差异比栏内更多.栏外放牧活动导致了牲畜排泄物的输入,有利于土壤微生物反硝化作用的发生,促进了N2O的产生速率,但是牲畜的践踏也改变了土壤结构,使土壤表层紧实度增加,阻碍了气体向外排放,因而观测到放牧草原土壤N2O排放较低的现象[17].因此放牧改变了栏外土壤各土层之间物理性质、化学性质和微生物活性自上而下的渐变性,各土层之间的差异增大,由此造成了冻融循环期间 N2O排放通量的一系列显著性差异.
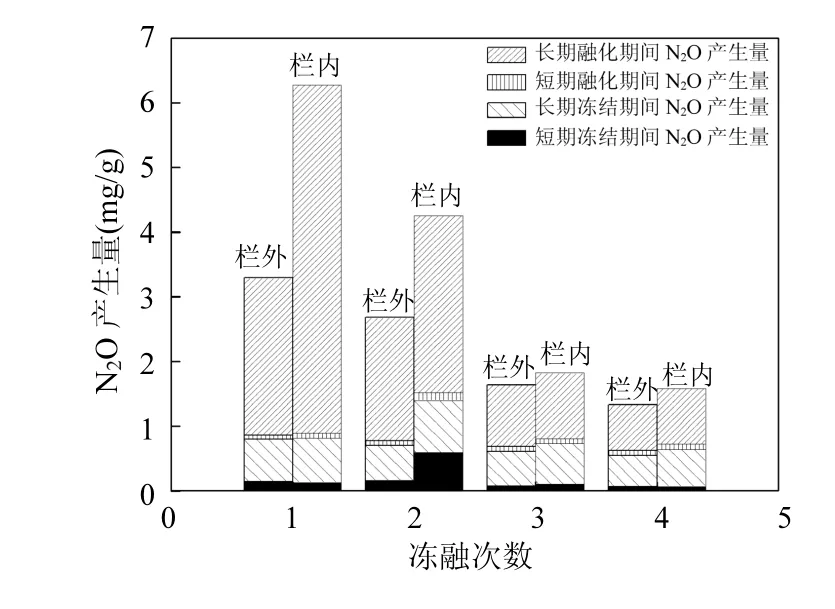
图2 栏内外4次冻融期间土壤N2O的产生量Fig.2 N2O Production inside and outside the fence during different cycles of freezing-thawing
图2也表明:不论管理措施的影响,栏内外的土壤在长期的冻结与融化过程中都保持着产生 N2O的能力.由于本研究的模拟培养更多地考虑当地气候条件下冰雪覆盖、融化后所产生的水淹状况,未考虑风蚀与蒸发对土壤水分含量的影响.在此情况下土壤微生物主要以反硝化作用产生N2O,而且这种作用效率在不同温差的循环冻结过程中变化并不明显,证实了在冬季长期的冻结过程中,土壤微生物的反硝化作用所产生的N2O因冰雪阻碍而有可能储存于土壤的空隙之中,为日后N2O的适时排放峰值的产生奠定了物质基础.
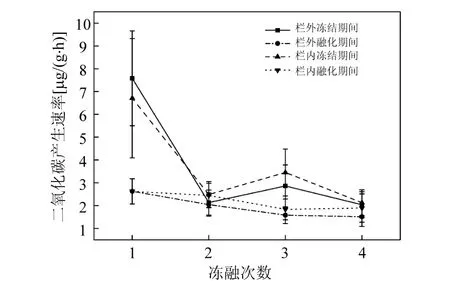
图3 栏内外4次冻结与融化期间CO2产生速率的均值Fig.3 Mean CO2production rates inside and outside the fence during 4times freezing-thawing cycles
随着冻融循环次数的增加,N2O的产生速率呈下降趋势.这与其他研究一致,土壤N2O排放量的增量随着冻融次数的增加而减小[25-26];培养自德国和瑞典采样点的土块融化后第一个星期N2O的排放速率增加了100倍,在接下来两个连续的冻融循环后有下降[11].图3为栏内外4次冻结与融化期间CO2产生速率的均值,可知随着冻融循环次数的增多,土壤呼吸速率呈逐渐降低的趋势,这也进一步表明相关土壤微生物生物活性的降低.随着冻融循环的进行土壤中的有机质含量减少,微生物数量减少,微生物对冻融环境产生了适应性[27],微生物活性降低,N2O的排放量减少.本研究中4次冻融循环的温差分别为20、15、10、15℃,研究结果显示温差越大,N2O产生速率越大,可以推测N2O的产生速率随冻融次数减少的原因也可能与温差不断减小有关.
对于围栏内外冻融期间N2O产生量来说,每个冻融循环中:长期融化>长期冻结>短期冻结>短期融化(图2).而贝加尔针茅草地土壤长期、短期冻结与融化N2O产生速率的平均值为:短期冻结[0.0041μg/(g⋅h)]>短期融化[0.0020μg/(g⋅h)]>长期融化[0.0019μg/(g⋅h)]>长期冻结[0.0006μg/(g⋅h)].短期冻融期间 N2O产生速率的均值高,长期冻融期间N2O排放总量大.以短期的冻融变化模拟秋季的昼夜冻融交替过程,而长期冻融试验则模拟季节性的冻融过程,也即昼夜冻融过程会导致N2O产生速率的高峰值,季节性春融期间则存在N2O排放总量较大的现象.对内蒙古温带草原陆地生态系统的日变化观测表明,温度是影响N2O通量日变化的关键因素,夜间温度变化导致的 N2O排放量占到日排放总量的 46%以上[18].由上文对不同冻融时间长度的分析结果可知,冻结和融化2h后N2O的产生速率分别为冻、融期间的最高值,温度变化引起的土壤冻融能在短时间内引发N2O的排放高峰.有研究估算每年春季融化期间有占年排放量6%~21%的N2O从农业用地的表层土壤排放[28].对德国棕色森林土壤的研究发现春季土壤融化所释放的N2O约占全年总释放量的30%[29].因此冬春与秋冬季节转化时的冻融现象对于土壤N2O的排放通量的影响值得进一步的关注与研究.
2.3 不同的温差在冻融循环过程中对N2O产生速率的影响
由图4在相同和不同的温差培养条件下栏内外测试的5个土层N2O产生速率的均值(所列出的温差先后是按照冻融循环温度设置的次序),可知融冻、冻融期间相同温差下,N2O的产生速率随着培养次数的增加而减弱;冻融期间不同温差下N2O的产生速率随着温差的减小而减弱.相同温差下,冻融后期 N2O的产生速率小于冻融初期,是因为土壤C、N等有机物质和微生物的数量随着冻融循环进行而减少,在冻融循环的后期,土壤中可供微生物分解利用的营养底物含量下降,微生物的呼吸作用减弱.对北方阔叶林糖枫和黄桦树林下土壤的的培养实验表明强冻(-13℃)刺激土壤N2O的产生、提高土壤的矿化速率,而弱冻(-3℃)的影响效果很小,这是因为微生物具有溶质积累的能力,能降低凝固点,从而能够抵抗弱冻[10].对挪威云杉林土壤在 3种冻结温度条件下(-3℃,-8℃和-13℃)的冻融循环模拟结果表明,经过-13℃强冻处理的土壤在冻融循环过程中排放的N2O显著高于-3℃和-8℃处理[30].本文观测到培养期间的温差越大,N2O产生速率越大,可能是因为强烈的冻结导致更多的微生物死亡,释放出更丰富的营养物质供残余微生物利用,增强了微生物的厌氧呼吸作用,在融化期间 N2O的排放量也会更大,但是从高到低不同的温差培养条件下,土壤中的有机质和微生物等的数量也逐渐减少.
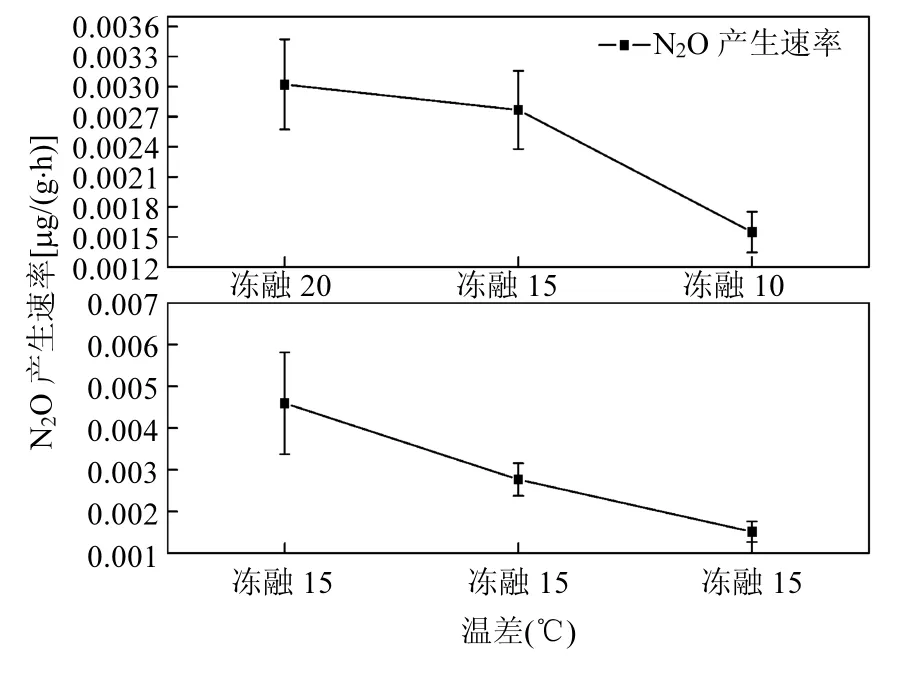
图4 温差对土壤N2O产生速率均值的影响Fig.4 Effect of temperature differences on mean N2O production rates from the soil
2.4 田间观测实验中冻融对土壤N2O排放通量的影响
自2011年8月开始一直坚持开展野外实验,由于当地气候寒冷,冬季漫长,深冬季节大雪封路无法开展田间原位观测,因此冬季野外最后的观测能坚持到12月中下旬,最冷的深冬季节的N2O通量值无法获取.本研究中计算的年排放总量,是基于观测期已有的田间观测数据用时间加权法进行计算,以观测期间的累积排放总量获得实际观测期间的平均排放通量,然后将计算所得的平均排放通量外推计算年排放总量.通常年份中3~4月和9月中旬~10月为春融、秋冻时期,2013年的气候特征与往年不同,整个3月份,最高气温几乎均未到 0℃,土壤不存在融化的条件,因此我们自2013年4月开始进行春融期间的加密实验观测.分别将2012年10月和2013年4月作为秋冬、冬春冻融时期,考察冻融环境下N2O的排放情况.2012年10月份的采样频率较少,在10月4日、10月11日、10月23日共采样3次;2013年4月份的采样频率为一周两次,共采样8次.秋冻、春融期间的采样频率相差较大,可能会对观测结果产生一定影响.本文以2012年5月~2013年 5月作为一个完整实验观测年,计算贝加尔针茅草甸草原,在不同人类活动影响下土壤N2O排放通量对冻融交替现象的实际响应.
2012年5 月~2013年5月冻融期间的排放量、年排放量及冻融期间占年排放的百分比见表3.可知2012年5月至2013年5月贝加尔针茅放牧样地的 N2O年排放量大于封育样地;封育样地冻融期间(春季冻融+秋季冻融)的 N2O排放量及占全年的比例(25.09%)均大于放牧样地(12.38%);春季冻融期间放牧、封育样地的N2O排放量均大于秋季,呼伦贝尔草原春季天气多变,土壤冻融频繁,秋季降温快、霜冻早,春季土壤经历冻融的时间大于秋季,故 N2O排放量大于秋季.

表3 2012~2013年贝加尔针茅草地N2O冻融期间及年排放量及所占比例Table 3 Freezing-thawing and annual N2O emission from Stipa baicalensis meadow steppe in 2012~2013and their contribution to the total emissions
杜睿等[17]2001年对内蒙古典型草原土壤的培养实验表明,放牧行为降低了草原土壤N2O的产生速率,Wolf等[31]研究表明长期观测显示适度的放牧可以减少草原土壤N2O的排放通量.Liu等[32]对内蒙古草原封育和放牧羊草草原2年的观测结果显示放牧行为抑制了N2O的产生.本研究2012~2013年贝加尔针茅草原室内冻融模拟显示封育土壤的N2O产生速率大于放牧土壤,同期的野外观测表明冻融期间N2O排放量为封育样地(0.17kg N/hm2)>放牧样地(0.1kg N/hm2),但是从观测期的年排放总量发现:放牧土壤的N2O排放量大于封育土壤.冻融期间栏内封育土壤由于长期凋落物有机质的回归使其营养成分相对偏高,因而N2O的排放量大于放牧土壤.王艳芬[33]关于人类活动对内蒙古草原温室气体排放的研究认为,放牧对草原N2O排放通量影响显著,通量大小依次是:轻度放牧<围栏封育<中度放牧<重度放牧;对羊草草原及大针茅草原的研究表明:不同放牧强度下土壤微生物数量变化的趋势为轻度放牧<围栏封育<中度放牧<重度放牧,放牧条件下土壤-植被系统排放N2O的能力的变化与土壤微生物数量变化非常一致,由于当前草场多为中、重度放牧,因此可认为放牧行为增加了N2O的排放.青藏高原冬牧场冻融期(2012年4月)N2O的累计排放通量占全年的 13%[9],贝加尔针茅草原封育样地2013年4月春融期间,N2O排放量占全年的23.7%.不同的野外观测实验关于放牧对 N2O排放通量的影响及冻融期间 N2O排放量占全年的比例大小不同,是由于观测的时间、土壤类型、植被以及气候等因素不同造成的.
3 结论
3.1 呼伦贝尔草甸草原土壤在冻融环境下各土层、各时间点的N2O产生是不均衡的.上层(0~9cm)土壤 N2O的产生量占实验测试表层土壤(0~15cm)总产生量的70%,冻融初期2h后N2O的产生速率最高.融化更能引起不同土层N2O排放的差异,人类的放牧活动也使冻融期间的N2O排放更加复杂.
3.2 冻融期间,温差相同的情况下,随土壤经历的冻融次数的增多,N2O产生速率减小;N2O的产生速率随着冻融温差的变小而减少,其中可能包含着土壤有机质和微生物等不断减少的因素.
3.3 尽管室内模拟和野外观测都显示冻融期间封育样地的N2O排放量及其在全年排放量中所占的比例均大于放牧样地,但从年排放量上来看放牧行为还是促进了草地作为N2O源的功能.
3.4 室内模拟和野外观测表明,春融期间 N2O排放量是整个冻融期间N2O排放的主要贡献者.应该加强对冻融期间N2O田间排放通量的观测,进一步探究影响春融、秋冻期间N2O排放的规律及其影响因素.
[1]Roahe H. A comparison of the contribution of the various gases to the greenhouse effect [J]. Science, 1990,248:1217-1219.
[2]Montzka S A. Controlled substances and other source gases [R]. Scientific assessment of ozone depletion: 2002. World Meteorological Organization, Geneva, 2003:1.1-1.83.
[3]孙 忻.冻融作用下黑土氧化亚氮排放与微生物性状关系研究[D]. 大连:大连交通大学, 2009.
[4]IPCC. Climate Change: The scientific basis fourth assessment report of the intergovemmental panel on climate change [R]. Cambridge: Cambridge University Press, 2007.
[5]孙 辉,秦纪洪,吴 杨.土壤冻融交替生态效应研究进展 [J].土壤, 2008,40(4):505-509.
[6]伍 星,沈珍瑶.冻融作用对土壤温室气体产生与排放的影响[J]. 生态学杂志, 2010,29(7):1432-1439.
[7]刘 帅,于贵瑞,浅沼顺,等.蒙古高原中部草地土壤冻融过程及土壤含水量分布 [J]. 土壤学报, 2009,46(1):46-51.
[8]王连峰,蔡延江,解宏图.冻融作用下土壤物理和微生物性状变化与氧化亚氮排放的关系 [J]. 应用生态学报, 2007,18(10): 2361-2366.
[9]王广帅,杨晓霞,任 飞,等.青藏高原高寒草甸非生长季温室气体排放特征及其年度贡献 [J]. 生态学杂志, 2013,32(8):1994-2001.
[10]Caroline B, Peter M, Steven P, et al. Freezing effects on carbon and nitrogen cycling in northern Hardwood Forest soils [J]. Soil., 2001,65:1723-1730.
[11]Prieme A, Christensen S. Natural perturbations, drying-wetting freezing-thawing cycles, and the emission of nitrous oxide, carbon dioxide and methane from farmed organic soils [J]. Soil Biology and Biochemistry, 2001,33:2083-2091.
[12]宋长春,王毅勇,王跃思,等.季节性冻融期沼泽湿地CO2、CH4和N2O排放动态 [J]. 环境科学, 2005,26(4):7-12.
[13]Goldberg S D, Borken W, Gebauer G. N2O emission in a Norway spruce forest due to soil frost: Concentration and isotope profiles shed a new light on an old story [J]. Biogeochemistry, 2010, doi: 10.1007/s10533-009-9294-z.
[14]Walker V K, Palmer G R, Voordouw G. Freeze-thaw tolerance and clues to the winter survival of a soil community [J]. Applied and Environmental Microbiology, 2006,72:1784-1792.
[15]李梓铭.内蒙古呼伦贝尔草甸草原温室气体通量的观测研究[D]. 北京:中国科学院大学, 2012.
[16]王跃思,郑循华,王明星.气相色谱法检测大气中 N2O 浓度 [J].分析测试技术与仪器, 1994,2:19-24.
[17]杜 睿,王庚辰,吕达仁.放牧对草原土壤 N2O产生及微生物的影响 [J]. 环境科学, 2001,22(4):12-15.
[18]李梓铭,杜 睿,王亚玲,等.中国草地N2O通量日变化观测对比研究 [J]. 中国环境科学, 2012,32(12):2128-2133.
[19]郭明英,,朝克图,尤金成,等.不同利用方式下草地土壤微生物及土壤呼吸特性 [J]. 草地学报, 2012,20(1):42-48.
[20]Bremner J M, Robbins S G, Blackmer A M. Seasonal variability in emission of nitrous oxide from soil [J]. Geophys. Res. Lett, 1980:7,641-644.
[21]Muller C, Martina M, Stevens R J, et al. Processes leading to N2O emissions in grassland soil during freezing and thawing [J]. Soil Biol. and Biochem., 2002,34(9):1325-1331.
[22]李海防,夏汉平,熊燕梅,等.土壤温室气体产生与排放影响因素研究进展 [J]. 生态环境, 2007,16(6):1781-1788.
[23]耿远波,章 申,董云社,等.草原土壤的碳氮含量及其与温室气体通量的相关性 [J]. 地理学报, 2001,56(1):44-53.
[24]王 琼,范志平,王满贵,等.冻融交替对科尔沁沙地不同土地利用方式土壤呼吸的影响 [J]. 生态学杂志, 2010,29(7):1333-1339.
[25]Koponen H T, Martikainen P J. Soil water content and freezing temperature affect freeze -thaw related N2O production in organic soil [J]. Nutrient Cycling in Agroecosystems, 2004,69:213-219.
[26]Teepe R, Ludwig B. Variability of CO2and N2O emissions during freeze-thaw cycles: Results of model experiments on undisturbed forest-soil cores [J]. Journal of Plant Nutrition and Soil Science, 2004,167:153-159.
[27]魏丽红.冻融作用对土壤理化及生物学性质的影响综述 [J].安徽农业科学, 2009,37(11):5054-5057.
[28]Eric van Bochove, Danielle Prevost, France Pelletier. Effects of freeze-thaw and soil structure on nitrous oxide produced in a clay soil [J].Soil Sci., 2000,64:1638-1643.
[29]Lopes De Gerenyu, Kurganova I N, Teepe R, et al. Effect of contrasting changes in hydrothermic conditions on the N2O emission from forest and tundra soils [J]. Eurasian Soil Science, 2007,40(7):795-799.
[30]Goldberg S D, Muhr J, Borken W, et al .Fluxes of climaterelevant trace gases between a Norway spruce forest soil and atmosphere during repeated freeze-thaw cycles in mesocosms [J]. Journal of Plant Nutrition and Soil Science, 2008,171:729-739.
[31]Wolf Benjamin, Zheng Xunhua, Bruggemann Nicolas, et al. Grazing-induced reduction of natural nitrous oxide release from continental steppe [J]. Nature, 2010,464:881-884.
[32]Liu Xingren, Dong Yunshe, Qi Yuchun, et al.N2O fluxes from the native and grazed semi-arid steppes and their driving factors in Inner Mongolia, China [J]. Nutr. Cycl. Agroecosyst., 2010,86:23-240.
[33]王艳芬.人类活动干扰下草原温室气体地-气交换特征及碳平衡研究 [D]. 北京:中国科学院植物研究所, 2001.
致谢:感谢中国农业科学院呼伦贝尔草原站的所有工作人员在整个实验期间所提供的热心帮助.
Effect of freezing-thawing cycles on N2O fluxes from temperate Stipa baicalensis meadow grassland soils in Inner
Mongolia
QIN Sai-sai1,2, ZHAI Qiu-min2, DU Rui1*, LIANG Zong-min1, DU Peng-rui1, LU Ze-dong1, LI Zi-ming1,3
(1.College of Resources and Environment, University of Chinese Academy of Sciences, Beijing 100049, China;2.College of Environmental and Planning, Henan University, Kaifeng 475000, China;3.Beijing Meteorological Bureau, Beijing 100089, China). China Environmental Science, 2014,34(9):2334~2341
In this paper we combined the laboratory simulation tests with field experiments of greenhouse gas fluxes, and analyzed the effects of different soil layers, grazing and fencing, long-term and short-term freezing-thawing, different frequency and intensity of freezing-thawing on soil N2O production rate and emission flux in Hulunbuir meadow grassland in Inner Mongolia. During freezing and thawing, the N2O productions mainly came from topsoil of 0to 9cm depth, and gradually reduced from the surface down to depth of 15cm soil. The N2O emissions decreased with lowing temperature differences. Under the situation of the same temperature differences, the N2O emissions decreased with increasing freezing-thawing frequencies. During the freezing-thawing cycle, N2O fluxes of fenced plot were greater than that of grazing plot, contributing to 25.09% of annual N2O emissions, while the contribution is about 12.38% for grazing plot. However from the annual time scale, the grazing increased the annual total N2O emissions. Early spring thawing was the largest contributors to the N2O emission during the whole period of freezing-thawing cycles.
freezing-thawing;temperate Stipa baicalensis meadow;N2O flux
X511
A
1000-6923(2014)09-2334-08
秦赛赛(1988-),女,河南郑州人,河南大学环境与规划学院硕士研究生,主要从事冻融影响草地土壤温室气体排放的研究.
2013-11-30
中国战略性先导科技专项—应对气候变化的碳收支认证及相关问题(XDA05020401)
* 责任作者, 副教授, ruidu@ucas.ac.cn

