快立洁手消毒凝胶的微生物限度检查方法学验证
檀巧婷,严 佳,周 欣,宋洪涛 (南京军区福州总医院药学科,福建 福州 350025)
快立洁手消毒凝胶是本院自主研发制剂,临床上用于外科洗手消毒、手卫生消毒以及一般皮肤消毒。根据《中国药典》2010年版二部规定,凝胶剂必须做微生物限度检查。建立该制剂微生物限度检查法时,应进行细菌、真菌及酵母菌计数方法的验证,以确认所采用的方法是否适合于该制剂的细菌、真菌及酵母菌数的测定[1]。该凝胶中含有三氯生、乙醇等抑菌成分,进行微生物限度检查时应降低或消除其抑菌作用。经查阅相关资料和文献[2-6],对于抑菌活性强的制剂,微生物限度检查多采用薄膜过滤法,因此采用薄膜过滤法建立快立洁手消毒凝胶微生物限度检查方法。
1 试验材料
1.1样品 快立洁手消毒凝胶(批号20121112),由南京军区福州总医院制剂室提供。
1.2试验菌种 试验用菌均由福建省药检所提供,分别是:金黄色葡萄球菌(Staphylococcusaureus)[CMCC(B)26003];大肠杆菌(Escherichiacoli)[CMCC(B)44102];枯草芽孢杆菌(Bacillussubtilis)[CMCC(B)63501];白色念珠菌(Candidaalbicans)[CMCC(F)98001];黑曲霉(Aspergillusniger)[CMCC(F)98003];铜绿假单胞菌(Pseudomonasaeruginosa)[CMCC(F)10104]。
1.3培养基及稀释液 营养肉汤培养基(批号 101213)、营养琼脂培养基(批号110325)、玫瑰红钠琼脂培养基(批号110401)、改良马丁培养基(批号1011282)、改良马丁琼脂培养基(批号 1010272)、胆盐乳糖培养基(批号1012012)、甘露醇氯化钠琼脂培养基(批号101201)、溴化十六烷基三甲胺琼脂培养基(批号101124)和pH 7.0无菌氯化钠-蛋白胨缓冲液(批号 120329 )均由北京三药科技开发公司提供。
1.4仪器 隔水式电热恒温培养箱(型号:GHP-9160)、电热恒温鼓风干燥箱(型号:DHG-9145A)、无菌检查仪(型号:WJ-6)、净化工作台(型号:SW-CJ-1B)、真菌培养箱(型号:MJPS-150)、立式压力蒸汽灭菌器(型号:LDZX-40KBS)。
2 验证方法
按照《中国药典》2010年版二部附录XI J微生物限度检查法,进行3次独立的平行试验,并分别计算各试验菌每次试验的回收率。
2.1菌液和供试液制备
2.1.1菌液制备 分别取经35 ℃培养24 h后的金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌、铜绿假单胞菌的新鲜培养物,以及26 ℃培养48 h的白色念珠菌新鲜培养物,用9 ml 0.9%无菌氯化钠溶液依次10倍稀释至10-7;取经26 ℃培养7 d后的黑曲霉新鲜培养物,用5 ml含0.05%(ml/ml)聚山梨酯80的0.9%无菌氯化钠溶液将孢子洗脱,吸出孢子悬液,再10倍递增稀释。以上菌悬液同时取2份注入琼脂培养基培养,采用平皿法计数,得到所需菌落数(50~100 CFU/ml)的菌液稀释级。
2.1.2供试液制备 取样品1 ml,置于100 ml pH 7.0无菌氯化钠-蛋白胨缓冲液中,振摇,使其均匀分散,作为1:100供试液,备用。
2.2回收率测定
2.2.1结果判断标准 试验组的菌回收率(%)=[(试验组平均菌落数-供试品对照组平均菌落数)/菌液组平均菌落数]×100%
稀释剂对照组的菌回收率(%)=(稀释剂对照组的平均菌落数/菌液组的平均菌数)×100%
2.2.2细菌、真菌计数方法验证 ①试验组:取供试液1 ml,注入薄膜过滤器,用pH 7.0无菌氯化钠-蛋白胨缓冲液过滤,冲洗3次,每次100 ml,在最后一次的冲洗液中加入试验菌菌悬液1 ml(50~100 CFU/ml),过滤后取出滤膜,菌面朝上贴于相应琼脂培养基上,培养观察。②菌液组:操作同试验组,仅加菌液。③供试品对照组:操作同试验组,仅加供试液。④稀释剂对照组:取稀释液1 ml替代供试液,操作同试验组。
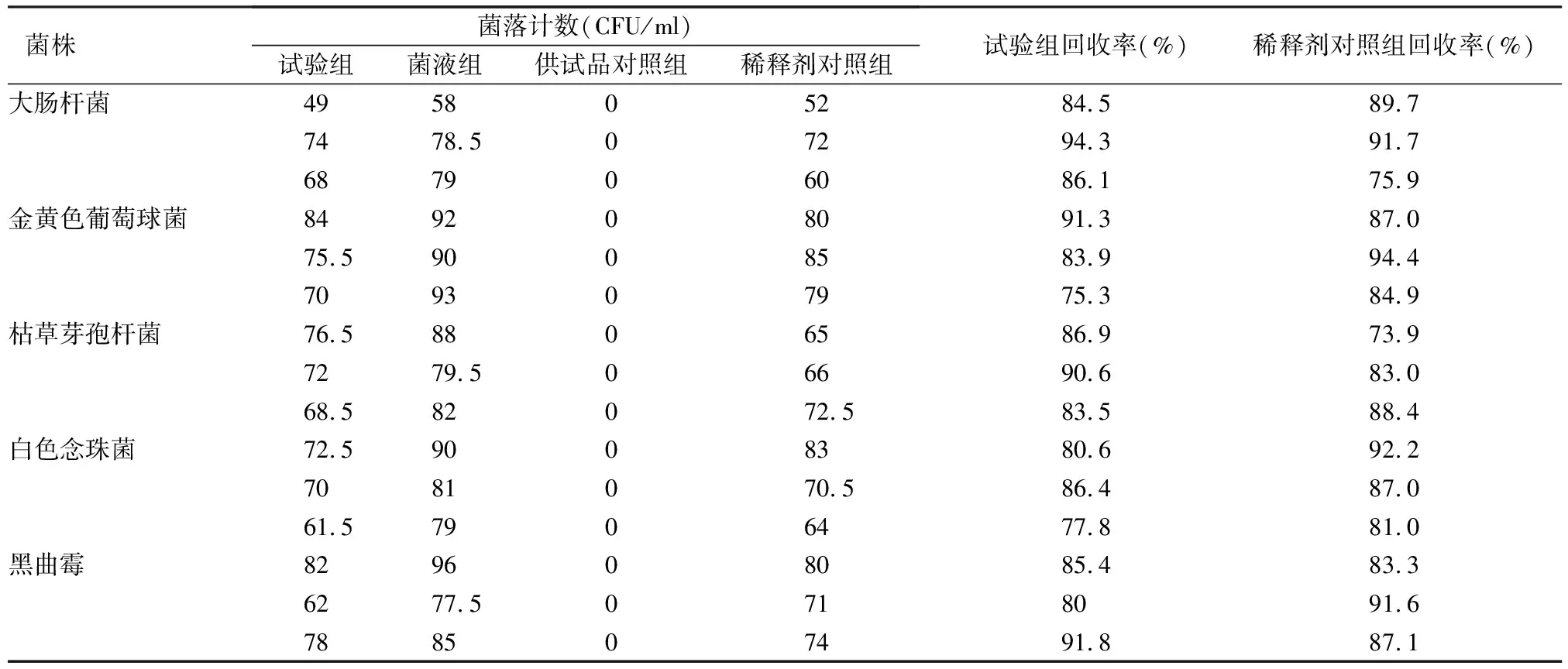
表1 细菌、真菌计数方法验证试验结果(n=3)
由表1可见:回收率均大于70%,结果符合药典要求。
2.3控制菌检查方法的验证[7]
2.3.1试验组 铜绿假单胞菌:取供试液1 ml,注入过滤器中,用pH 7.0无菌氯化钠-蛋白胨缓冲液过滤,冲洗3次,在最后一次冲洗液中加入试验菌1 ml(50~100 CFU/ml),过滤,取出滤膜,接种至100 ml的胆盐乳糖培养基中,培养24 h。取上述培养物划线接种于溴化十六烷基三甲铵琼脂培养基的平板上,培养24 h,观察结果。金黄色葡萄球菌:同铜绿假单胞菌培养方法,取出滤膜,接种至100 ml的营养肉汤培养基中,培养24 h,取上述培养物划线接种于甘露醇氯化钠琼脂培养基的平板上,培养72 h,观察结果。
2.3.2菌液组 铜绿假单胞菌:过滤器中先注入少量缓冲液,再注入菌悬液各1 ml(50~100 CFU/ml),不加供试液,过滤(同2.3.1试验组操作)。金黄色葡萄球菌:同上述铜绿假单胞菌培养方法,过滤
后取出滤膜置于营养肉汤培养基中,培养、划线(同2.3.1试验组)。
2.3.3供试品对照组 同试验组,加供试液,不加菌液。
2.3.4稀释剂对照组 取与供试液等量的稀释剂与供试品组同法操作,作为阴性对照。
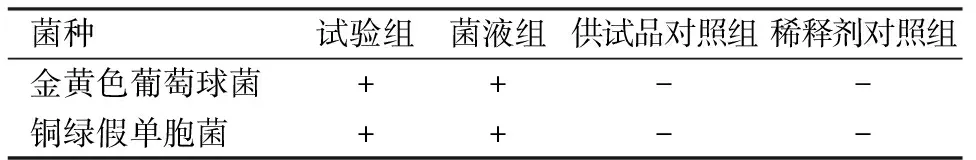
表2 控制菌检查方法验证试验结果
3 讨论
3.1样品具有抑菌作用,根据凝胶微生物限度检查方法的文献报道[2-6],采用薄膜过滤法,能有效降低或消除抑菌作用,检查结果符合要求。在验证试验过程中,供试品分别制成1:10,1:20,1:50的供试液时,薄膜过滤缓慢,滤膜易堵,试验菌生长不规则,甚至不生长,菌回收率低于70%,不符合药典要求。试验最终选取1:100供试液,菌落生长良好,薄膜过滤较为顺畅,菌回收率均高于70%,验证结果符合要求。
3.2微生物限度检查的整个步骤相当复杂,相关程序特别多,在检测的过程中,任何的检测程序中的操作不当和硬件条件不够,都会对药品微生物限度检查结果造成不同程度的影响,从而导致误差的出现[8]。
4 结论
经验证试验,采用薄膜过滤法对样品进行细菌、真菌、酵母菌检查及控制菌检查,将样品制成1:100供试液,用pH 7.0的无菌氯化钠-蛋白胨缓冲液冲洗3次,每次100 ml,试验菌回收率及控制菌检查结果均符合《中华人民共和国药典》规定。因此,在此试验条件下,采用薄膜过滤法建立快立洁手消毒凝胶微生物限度检查有效可行。
【参考文献】
[1] 国家药典委员会. 中华人民共和国药典2010年版二部[S].北京:中国医药科技出版社,2010:附录Ⅺ J108.
[2] 江 燕,张春瑛,钱文忠. 红花油凝胶微生物限度检查方法的验证[J].中国药师,2010,13(4):591-592.
[3] 李近磊,王嘉怡,迟丹怡,等. 复方克林霉素凝胶微生物限度检查法的方法验证研究[J].中国药房,2010,21(25):2380-2382.
[4] 杨淑先,赵新霞,牛 坡. 林可霉素利多卡因凝胶微生物限度检查方法研究[J].中国药房,2011,22(33):3143-3145.
[5] 钱文静,张 玫,袁耀佐. 盐酸特比萘芬凝胶微生物限度检查方法的验证[J].药物分析杂志,2008,28(12):2135-2139.
[6] 刘 宁,张文婷. 克林霉素磷酸酯凝胶微生物限度检查方法的验证[J].药物分析杂志,2007,27(12):1991-1993.
[7] 周国华,傅小英. 医疗机构制剂检验基本操作指南[M]. 北京:人民军医出版社,2012:112-121.
[8] 李佩蓉,范秋汝. 药品微生物限度检验的误差影响因素[J]. 北方药学,2011,8(3):81-119.

