拓扑替康标准方案与周疗方案治疗小细胞肺癌的荟萃分析
蔡和平,王 卓 (第二军医大学附属长海医院药学部,上海 200433)
拓扑替康(topoteca,TPT)是拓扑异构酶I型抑制剂,属S期细胞周期特异性药物。可特异性地与DNA单链断端上的拓扑异构酶I及DNA形成稳定的三元复合物,阻止拓扑异构酶I对单链修复,致使DNA双链结构破坏,诱导肿瘤细胞凋亡[1]。TPT是目前唯一被美国食品药品管理局(FDA)批准用于敏感型小细胞肺癌(SCLC)二线化疗的标准方案。基于TPT在敏感型SCLC治疗中的疗效,近年来对其在难治/耐药型SCLC的治疗中进行了许多有益的探索并获得了较好的成果。FDA推荐的TPT标准用法:1.2 mg/(m2·d),连续5 d,3周为1个周期,但该用法的主要不良反应是血液学毒性,78%的患者会发生Ⅳ度粒细胞减少,27%的患者会发生Ⅳ度血小板减少,37%的患者会发生Ⅲ ~Ⅳ度贫血[2]。Gordon等[3]研究表明,使用拓普替康1.5 mg/(m2·d),用药5 d,给药周期为21 d,其Ⅲ~Ⅳ级中性粒细胞减少症发生率为77%,因此大大限制了其在临床的应用。故有学者提出了TPT周疗方案,可能为其临床应用开辟新的途径。即d1、d8、d15分别给予TPT,以4周为一疗程,不仅可以提高疗效而且可以减少不良反应的发生[4,5],为验证这两种化疗方案的有效性和不良反应发生率,笔者采用荟萃(Meta)分析对已有的研究结果进行系统、定量的综合分析,为临床推荐一种有效、安全的化疗方案提供依据。
1 资料与方法
1.1问题的定义
1.1.1研究对象 已公开发表的有关比较拓扑替康标准方案与周疗方案疗效与不良反应的随机对照试验或设计良好的非随机对照研究。
1.1.2干预措施或暴露因素 本研究对已发表的论文用系统评价的方法进行Meta 分析以获得最终结果并将其量化。本研究最终关心的问题是两种治疗方案的疗效和不良反应。因此本研究以TPT周疗方案(d1、d8、d15分别给予TPT,4周为一疗程),作为研究组;TPT标准方案(每天1次,连续5 d,3周为1个周期),作为对照组。
1.1.3疗效评估指标 本研究是比较两组化疗方案对患者有效性和不良反应发生率的影响,所涉及的原始文献最重要的结局变量是化疗结束时有效性和不良反应发生率的高低。疗效按照RECIST疗效评价标准分为完全缓解(complete response,CR)、部分缓解(partly response,PR)、稳定(stable disease,SD)和进展(progressive disease,PD),以CR+PR计算有效率(respouse rate,RR),CR+PR+SD计算疾病控制率(disease control rate,DCR)。不良反应按照WHO抗癌药物不良反应评价标准(0~Ⅳ度)进行评估。本研究的疗效和不良反应发生率判定指标是TPT标准方案(研究组)与TPT周疗方案(对照组)疗效和发生不良反应发生率的优势比(OR)。
1.2纳入和排除标准及研究资料的特征
1.2.1 文献入选标准 有关比较拓扑替康周疗方案与标准方案疗效和不良反应发生率的研究文献; 随机研究或设计良好的回顾性研究;③研究对象为人,而非动物;④语种为英文或中文。
1.2.2文献排除标准 原始文献内容不是直接比较两种化疗方案对拓扑替康有效性和不良反应发生率影响的研究。
1.3资料检索
1.3.1资料来源 检索Sino Med数据库、Pub Med数据库,收集其建库到2013年7月10日发表的有关比较拓扑替康标准方案与周疗方案疗效和不良反应发生率的研究文献。Sino Med数据库、Pub Med数据库检索式见表1。
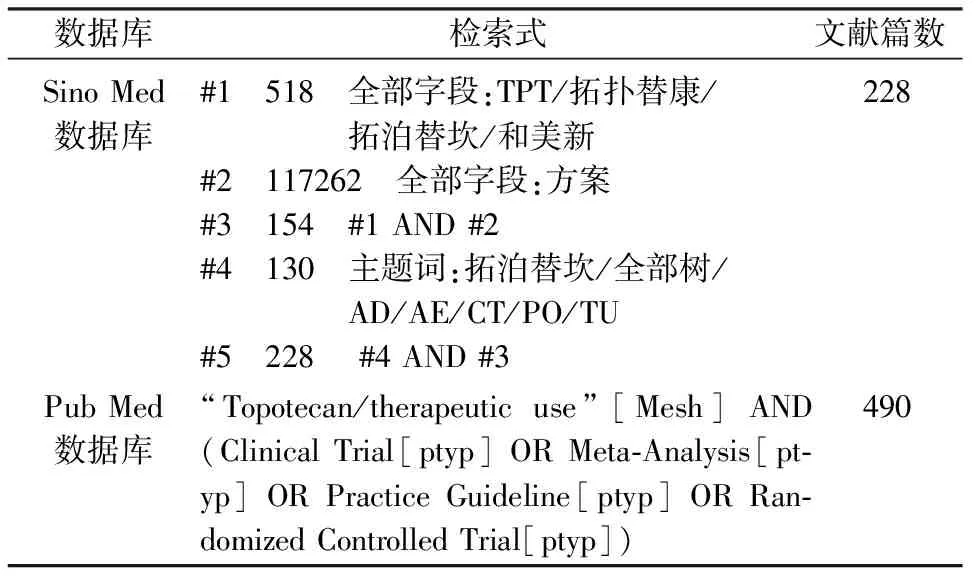
表1 数据库检索策略
1.3.2初次检索 文献初次检索共查到718篇文献,按照纳入和排除标准逐一筛选,最后纳入3篇符合条件的文献(表2)。

表2 Pub Med检索结果
1.4原始文献的研究质量评估 表2纳入的3篇文章均为随机对照研究,因此原始文献中研究组与对照组具有较好的均衡性,即原始研究的选择性偏倚较小。第1篇[6]研究的是周疗方案与标准方案有效性和安全性评价,15例患者采用标准方案,65例患者采用周疗方案,Ⅲ/Ⅳ级粒细胞减少发生率分别为93%与28%。第2篇[7]研究的是周疗方案与标准方案有效性和安全性评价,其中76例患者接受周疗方案,80例患者接受标准方案,结果发现两组总有效率接近,但周疗组Ⅲ~Ⅳ度血液毒性显著低于标准组。第3篇[8]研究的是周疗方案与标准方案有效性和安全性评价,24例患者采用标准方案,28例患者采用周疗方案,疗效和不良反应发生率周疗方案组均优于标准方案组。由于某种原因,在杂志上公开发表的文献与未发表的文献可能存在差异,如有的阴性结果可能没有发表。这种偏倚的存在是Meta 分析本身无法完全解决的。
1.5数据提取 从纳入研究的3篇文献中提取本研究所需的数据,见表3、表4。

表3 原始文献疗效数据汇总
1.6统计分析 应用Meta分析专用统计软件Rev Man 4.2进行统计分析。

表4 原始文献不良反应数据汇总
2 结果
2.1分析结果 用软件RevMan4.2中的Peto法分析得到两种化疗方案发生不良反应的优势比图(图1)。
2.2异质性分析及模型的选择 Meta分析的异质性主要由两部分组成,一是原始文献质量的异质性,该项已在“1.4”项中加以分析;异质性的另一个重要来源是纳入分析的各研究结果的一致性或趋向性,本研究的分析结果显示P=0.64(图1),P=0.54(图2),P= 0.73(图3),P= 0.97(图4),P>0.05,同质性均较好,可看成一个研究整体进行合并,均采用固定效应模型进行分析。

图1 3篇文献Peto法有效率的优势比图

图2 2篇文献Peto法Ⅲ/Ⅳ级粒细胞减少的优势比图

图3 2篇文献Peto法Ⅲ/Ⅳ级血红蛋白减少的优势比图
2.3两种化疗方案的优势比图分析
2.3.1有效率 由图1可见,第1项研究的OR=0.44,95%可信区间为0.17~1.15,跨过无效线;第2项研究的OR=0.39,95%可信区间为0.10~1.51,跨过无效线;第3项研究的OR=1.18,95%可信区间为0.15~9.09,跨过无效线,在入选的这3组研究中,两种化疗方案在有效率方面的差异均无统计学意义。最后的分析结果显示,总样本量288例,其中周疗组165例,有效17例;标准方案组123例,有效21例;合并OR=0.49,95%可信区间0.23~1.01,跨过无效线,说明两种化疗方案在有效率方面的差异无统计学意义。

图4 2篇文献Peto法Ⅲ/Ⅳ级血小板减少的优势比图
2.3.2Ⅲ/Ⅳ级不良反应发生率 图2、图3和图4分别是两种化疗方案Ⅲ/Ⅳ级粒细胞、Ⅲ/Ⅳ级血红蛋白和Ⅲ/Ⅳ级血小板减少发生率的优势比图,最后的分析结果显示总样本量132例,其中周疗组89例,Ⅲ/Ⅳ级粒细胞减少26例;标准方案组43例,Ⅲ/Ⅳ级粒细胞减少39例;合并OR=0.04,95%可信区间0.01~0.14,位于无效线的左侧,说明两种化疗方案在Ⅲ/Ⅳ级粒细胞减少的发生率方面差异有统计学意义,即周疗方案组Ⅲ/Ⅳ级粒细胞减少的发生率低。周疗组89例,Ⅲ/Ⅳ级血红蛋白减少17例;标准方案组43例,Ⅲ/Ⅳ级血红蛋白减少24例;合并OR=0.27,95%可信区间0.11~0.63,位于无效线的左侧,说明两种化疗方案在Ⅲ/Ⅳ级血红蛋白减少的发生率方面差异有统计学意义,即周疗方案组Ⅲ/Ⅳ血红蛋白减少的发生率低。周疗组89例,Ⅲ/Ⅳ级血小板减少18例;标准方案组43例,Ⅲ/Ⅳ级血小板减少32例;合并OR=0.12,95%可信区间0.04~0.32,位于无效线的左侧,说明两种化疗方案在Ⅲ/Ⅳ级血小板减少的发生率方面差异有统计学意义,即周疗方案组Ⅲ/Ⅳ血小板减少的发生率低。
3 讨论
TPT是治疗SCLC的二线药物,但采用其标准化疗方案容易造成以血液系统为主的多种不良反应,严重制约了其临床应用及患者用药依从性,在身体基础条件虚弱或连续多周期给药后患者的耐受性为更低;周疗方案能够明显提高患者对该药物的耐受性,但是否会引起疗效下降值得怀疑。本研究采用循证医学方法将已有的多个同质原始临床研究结果合并分析,证实周疗方案在提高安全性的基础上并不降低化疗疗效,为临床合理制定个体化化疗方案具有重要参考价值。
Meta分析作为一种新的文献研究分析方法,对收集到的多个研究资料进行分析和概括,以提供量化的平均效果来回答研究的问题。通过增大样本含量来增加结论的可信度,解决研究结果的不一致性;能系统、客观地对多个研究结果进行综合评价和定量分析,从而提高了检验统计效能。本研究将原始文献的结局变量定义为化疗结束的有效率与Ⅲ/Ⅳ级不良反应的发生状况,用Meta分析的方法分别计算两组方案有效率和Ⅲ/Ⅳ级不良反应发生率的效应尺度,即优势比。在所有有效率优势比中发现OR=0.49,95%可信区间0.23~1.01,说明两组方案有效率无统计学意义,但有无临床意义不清楚,有待进一步研究。在Ⅲ/Ⅳ级不良反应优势比中发现,Ⅲ/Ⅳ级粒细胞与Ⅲ/Ⅳ级血红蛋白及Ⅲ/Ⅳ级血小板减少的发生率OR值和95%可信区间分别是0.26(0.10~0.65)、0.29(0.13~0.69)、0.19(0.07~0.47),说明周疗方案Ⅲ/Ⅳ级不良反应中的粒细胞减少、血红蛋白减少和血小板减少的发生率比标准治疗组的发生率低,均有统计学意义。
由于Meta 分析本身是一种观察性研究而非试验研究,因此质控标准不可能完全统一。在研究过程中可能会出现发表偏倚,即作者不愿提供阴性结果或无结论之研究的一种倾向,这是Meta分析固有的局限性。与此同时,本主题所能纳入研究的文献数量较少,这样会对研究结果产生质疑。这说明应用随机对照试验研究两组化疗方案的有效性和Ⅲ/Ⅳ级不良反应率的文章不多。同时也说明两组化疗方案的有效性和Ⅲ/Ⅳ级不良反应率的研究仍是下一步研究的热点。在今后的研究中,需纳入更多的前瞻性随机对照研究,用累计Meta分析的方法,以期对本研究的结论不断验证和发展。
【参考文献】
[1] Tomicic MT, Christmann M, Kaina B.Topotecan-triggered degradation of topoisomerase I is p53-dependent and impacts cell survival[J].Cancer Res,2005,65(19):8920-8926.
[2] Armstrong DK, Spriggs D, Levin J,etal.Hematologic safety and tolerability of topotecan in recurrent ovarian cancer and small cell lung cancer:an integrated analysis[J].Oncologist,2005 ,10(9):686-694.
[3] Gordon AN, Fleagle JT, Guthrie D,etal.Recurrent epithelial ovarian carcinoma:a randomized phaseⅢ study of pegylated liposomal doxorubicin versus topotecan[J].J Clin Oncol,2001,19(14):3312-3322.
[4] Vandenput I, Amant F, Neven P,etal.Effectiveness of weekly topotecan in patients with recurrent epithelial ovarian cancer[J].Int J Gynecol Cancer,2007,17(1):83-87.
[5] Abushahin F, Singh DK, Lurain JR,etal.Weekly topotecan for recurrent platinum resistant ovarian cancer[J].Gynecol Oncol,2008,108(1):53-57.
[6] Herzog TJ, Sill MW, Walker JL,etal.A phase II study of two topotecan regimens evaluated in recurrent platinum-sensitive ovarian, fallopian tube or primary peritoneal cancer:a gynecologic oncology group study (GOG 146Q)[J].Gynecol Oncol,2011,120(3):454-458.
[7] Sehouli J, Stengel D, Harter P,etal.Topotecan weeklyversusconventional 5-day schedule in patients with platinum-resistant ovarian cancer: a randomized multicenter phase II trial of the North-Eastern German Society of Gynecological Oncology Ovarian Cancer Study Group[J].J Clin Oncol,2011,29(2):242-248.
[8] 刘 勇,席青松,赵 荆,等.两种方案治疗难治/耐药型小细胞肺癌比较[J].药物与临床,2011,30(5):598-601.

