氨三乙酸联合微生物对高羊茅修复重金属污染土壤的强化作用
常 晨,多立安,赵树兰
(天津师范大学a.生命科学学院,b.天津市动植物抗性重点实验室,天津300387)
天津污灌区土壤中重金属严重超标[1],土壤修复工作迫在眉睫.目前,在重金属污染土壤修复中,植物因具有良好的社会、经济和环境综合效益,适用于大规模污染土壤的修复.利用植物修复土壤的研究也有一些报道[2-3],如高羊茅对重金属污染土壤就有一定的修复作用[4].有研究认为添加螯合剂能促进植物提取更多的重金属[5-6].微生物修复技术在治理重金属污染方面也有很多优势,如成本低、环境友好、无二次污染等[7-9].城市污泥的化学组成一般都含有一定量的Cu、Pb、Zn、Ni、Cr、Cd、Hg 等重金属[10].从城市污泥中提取的微生物,很可能对重金属具有抗性,可以尝试用于重金属修复.本课题组将螯合剂氨三乙酸(NTA)、城市污泥中提取的微生物和高羊茅三者联合起来,研究螯合剂和微生物对高羊茅修复重金属污染土壤的强化作用.
1 材料与方法
1.1 实验材料
选用草坪植物高羊茅(Festuca arundinacea L.)为实验材料.
污泥取自天津市纪庄子污水处理厂,采用稀释分离法分别制备细胞浓度 10-3、10-4、10-5、10-6/L 的污泥悬浮液,根据所分离的微生物,取相应浓度的污泥悬浮液,摇匀后吸取0.2 mL加入到预先制好的平板中(真菌用马丁氏琼脂平板,放线菌用高氏一号琼脂平板,细菌用牛肉膏蛋白胨平板),用灭菌的涂布器涂抹均匀,每个处理重复3次,28℃培养.根据平板内菌落的形态、大小、色泽和生长速度等,从每个样品中尽可能多地挑取单菌落划线纯化.依据菌落性状和形态特征对菌株归类和统计数量,确定相应的优势菌,对其编号并保存.对优势菌进行基因扩增后,送至上海美吉基因公司测序.在NCBI网站上,采用BLAST软件将测序结果与GenBank核酸数据库中相关种属的16S rDNA和18S rDNA序列进行同源性比较.最终确定本研究所用菌种为施氏假单胞菌、里氏木霉和灰黄链霉菌,将这3种微生物按体积比1∶1∶1的比例混合,配制成复合微生物菌液.
选用氨三乙酸(NTA)作为螯合剂,分析纯,由国药集团化学试剂有限公司生产.
供试土壤取自天津市西青区污灌区.将采集的土壤去除草根、石块后,放置于通风处,自然风干2~3 d后,过2 mm筛备用.土壤理化性质测定参考文献[11].土壤有机质质量分数为3.62%,全氮质量分数为0.19%,全磷量为5.4 g/kg,全钾量为787.3 mg/kg,pH为7.28,土壤含水量为4.13%,电导率为0.44 mS/cm.每千克土壤中 Cd、Cu和 Zn的含量分别为 7.13、146.31和795.56 mg,分别是土壤环境质量二级标准(GB156182-1995)的 23.8、1.5和 3.2倍.
1.2 土壤处理
供试土壤共设置8个处理,分别标记为:(Ⅰ)不加NTA和菌液的对照土壤;(Ⅱ)每千克土壤添加5 mmol NTA;(Ⅲ)每千克土壤添加10 mmol NTA;(Ⅳ)每千克土壤添加15 mmol NTA;(Ⅴ)土壤中只加菌液;(Ⅵ)每千克土壤中添加菌液和5 mmol NTA;(Ⅶ)每千克土壤中添加菌液和10 mmol NTA;(Ⅷ)每千克土壤中添加菌液和15 mmol NTA.每个处理重复3次.
1.3 草坪植物培养
以直径为7 cm、高度为8 cm的塑料杯为培养容器,每杯加入170 g未添加NTA和菌液的土壤,播种0.5 g高羊茅种子.植物生长15 d后,向处理V、Ⅵ、Ⅶ、Ⅷ中加入15 mL菌液.植物生长25 d后向各组添加不同浓度的NTA,NTA处理10 d后收获高羊茅.实验周期为35 d.高羊茅培养在实验室内进行,经常调换位置以保证光照一致,培养期间室温17~31℃,相对湿度38%~60%.培植期间正常供水.
1.4 指标测定
生物量的测定:播种35 d后收获高羊茅,分为地上和地下部,经去离子水反复冲洗后,将其放入烘箱中,80℃下烘干至恒重,测其干重.
重金属含量的测定:称取植物样品0.1 g,用硝酸、高氯酸、硫酸混和液(体积比8∶1∶1)消解后,所得溶液用蒸馏水定容至25 mL,用TAS-990原子吸收分光光度计测定消化液中重金属(Cd、Cu、Zn)的含量.
1.5 数据分析处理
采用SPSS17.0软件对数据进行统计分析.
2 结果与分析
2.1 NTA和微生物对高羊茅生物量的影响
不同处理对高羊茅生物量的影响如表1所示.
由表1可以看出,5 mmol/kg NTA处理增加了高羊茅地上部生物量,比对照组增加4.7%;而10 mmol/kg和15 mmol/kg NTA处理则抑制了高羊茅地上部生物量的积累.添加菌液后,高羊茅地上部生物量显著增加,尤其以单独添加菌液的处理效果最明显,和对照组相比,增加了27.6%,添加菌液的4个处理间的差异不具有统计学意义(p>0.05).除15 mmol/kg NTA处理外,各处理组的高羊茅地下生物量均高于对照组,其中单独添加菌液的处理对高羊茅根部生物量的积累促进作用最明显,比对照组提高了约50%.总之,单独添加菌液对高羊茅生物量积累的促进效果最好,联合使用NTA后,高羊茅生物量的积累略有下降,但也显著高于对照组,尤其是地上部生物量的积累.
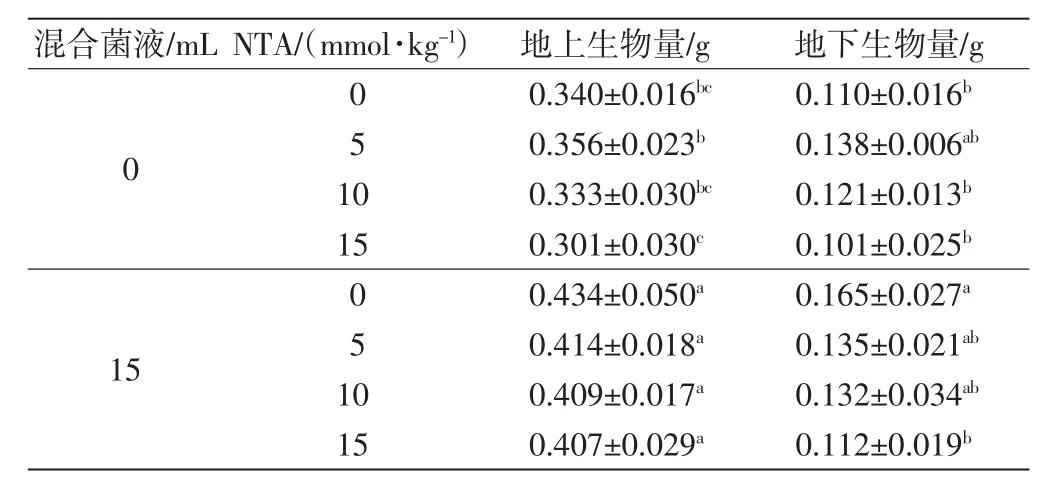
表1 不同处理对高羊茅生物量的影响Tab.1 Effects of different treatments on the biomass of F.arundinacea
2.2 NTA和微生物对高羊茅地上部重金属含量的影响
土壤中添加NTA和菌液后,高羊茅地上部重金属含量的变化如表2所示.
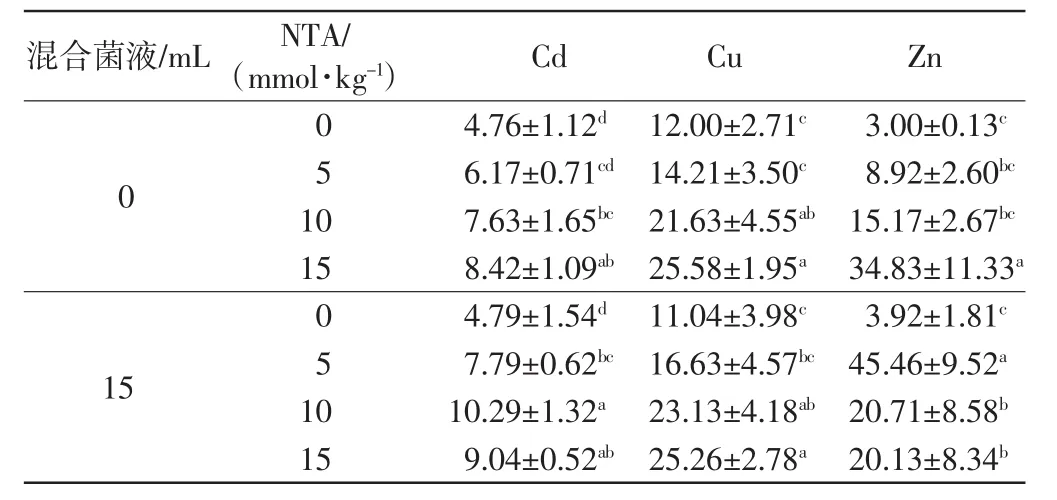
表2 不同处理下高羊茅地上部的重金属含量Tab.2 Heavy metal concentrations in shoots of F.arundinacea under different treatments μg/g
由表2可以看出,单独添加NTA处理的高羊茅地上部Cd含量随NTA浓度的增加呈上升趋势,高浓度处理组与对照组之间的差异均具有统计学意义(p≤0.05).NTA+菌液的处理方式进一步增加了高羊茅地上部分对Cd的富集,其中10 mmol/kg NTA+菌液处理组中高羊茅地上部Cd含量达到最大,是同等浓度NTA单独处理的1.35倍.
单独添加NTA处理的高羊茅地上部Cu含量也是随着NTA浓度的增加而增加,但只有NTA浓度达到10 mmol/kg后,地上部Cu的含量才显著高于对照组.NTA+菌液的处理方式也增加了高羊茅地上部对Cu的积累,但同单独添加NTA相比,作用效果并没有显著提升.所有处理中,单独添加15 mmol/kg NTA处理中高羊茅地上部Cu的积累最多.
高羊茅地上部分对Zn的积累中,随着NTA浓度的增加,地上部Zn的含量也呈增加趋势,15 mmol/kg NTA处理组中高羊茅地上部分Zn的含量是对照组的11倍.NTA+菌液的处理组中,5 mmol/kg NTA+菌液组中高羊茅地上部分Zn的含量最多,是对照组的15.15倍.高浓度的NTA联合添加菌液未能显著提升高羊茅对Zn的积累.
总的来看,单独添加菌液处理中,高羊茅地上部Cd、Cu、Zn的含量与对照组之间的差异没有统计学意义(p>0.05),表明混合菌液对高羊茅转运吸收重金属没有显著影响.单独添加NTA可以提高高羊茅地上部分对重金属Cd、Cu、Zn的积累,并且随着NTA浓度的增加,高羊茅地上部分重金属的含量也增加.螯合剂与菌液联合使用后,在一定程度上提高了高羊茅地上部分对重金属的富集能力,但对于不同的金属,螯合剂与菌液的最佳配比也不同.
2.3 NTA和微生物对高羊茅根部重金属含量的影响
土壤中添加NTA和菌液后,高羊茅根部重金属含量的变化如表3所示.
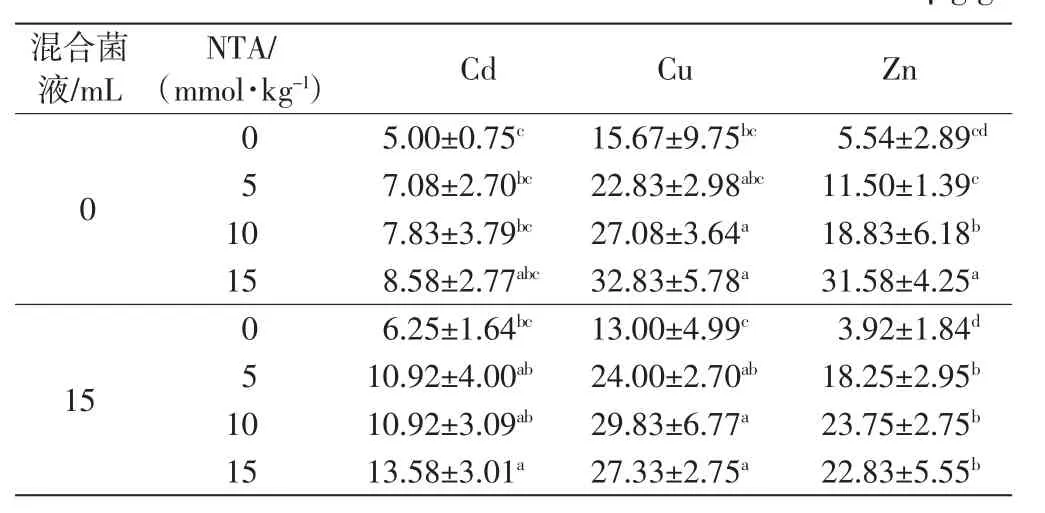
表3 不同处理下高羊茅根部的重金属含量Tab.3 Heavy metal concentrations in roots of F.arundinacea under different treatments μg/g
由表3可知,单独添加NTA的处理中,随着NTA浓度的增加,高羊茅根部Cd的含量也增加,但幅度不大.土壤中联合添加菌液后,高羊茅根部对Cd的积累增加较多,高于同等浓度NTA单独处理的效果,其中15 mmol/kg NTA+菌液处理下高羊茅根部Cd含量最大,是对照组的2.72倍.
对土壤Cu的去除效果中,单独添加NTA时,随着NTA浓度的增加,高羊茅根部Cu的含量显著增加,高浓度NTA处理组同对照组之间的差异均具有统计学意义(p≤0.05).联合添加菌液时,高浓度NTA处理组高羊茅根部对Cu的积累也显著高于对照组,但15 mmol/kg NTA+菌液处理组中,高羊茅根部Cu的含量低于单独添加同等浓度NTA的处理.
单独添加NTA的处理组中,高羊茅根部Zn的含量也是随着NTA浓度的增加而增加,高浓度NTA处理组同对照组之间的差异具有统计学意义(p≤0.05).联合添加菌液后,5 mmol/kg和10 mmol/kg NTA处理组高羊茅根部对Zn的富集增加,15 mmol/kg NTA处理组添加菌液后,高羊茅根部对Zn的富集作用反而下降.
总的来看,单独添加菌液中,高羊茅根部对重金属的富集作用没有显著提升,甚至对金属Cu和Zn的富集作用下降;单独添加NTA时,随着NTA浓度的增加,高羊茅根部对重金属的富集作用增强;螯合剂联合添加菌液后,高羊茅根部对重金属的富集效果进一步提高,尤其是对Cd的富集作用较单独添加NTA处理更为显著.
3 讨论与结论
在植物对重金属污染土壤的修复过程中,添加微生物可能会提高植物的生物量.如马文亭等[12]发现,在不同的Cd污染水平下,土壤中添加里氏木霉能够增加伴矿景天的生物量,提高其对Cd的抗性和对Cd污染土壤的修复效率;Usman等[13]研究AM菌根和EDTA对玉米和向日葵吸收Pb、Zn、Cd和Cu的影响,结果发现,接种AM后2种植物的地上部分和根部的生物量都增加.本研究发现,向污灌区土壤中添加污水处理厂中分离出的菌液,高羊茅地上部和根部的生物量都显著高于对照组和单独添加NTA的处理,即菌液对高羊茅的生长有促进作用.Quartacci等[14]的研究表明,单独添加NTA没有影响埃塞俄比亚芥的根长和地上部/根部的质量比.本研究中单独添加NTA也未能显著影响高羊茅的地上和根部生物量,而菌液与NTA联合使用,则能显著提高高羊茅的地上生物量.
在植物对土壤重金属的富集作用中,有研究表明,螯合剂能活化土壤重金属,促进植物对重金属的吸收和富集[15].本研究发现,单独添加NTA能提高高羊茅全株的重金属含量,并且高羊茅对重金属的积累随着土壤中NTA含量的增加而增加.而单独添加菌液对高羊茅富集重金属的能力没有显著影响,这与翁高艺等[16]的研究一致.研究螯合剂与菌液联合作用下高羊茅对重金属的富集作用,结果发现,针对高羊茅的不同部位和土壤中不同的重金属,螯合剂与菌液的最佳配比也不同.对于金属Cd,高羊茅地上部分的最佳处理是10 mmol/kg NTA+菌液,根部达到最大含量的处理方式是15 mmol/kg NTA+菌液;对于金属Cu,全株植物都是单独添加15 mmol/kg NTA的效果最好;对于金属Zn,地上部分的最佳处理是5 mmol/kg NTA+菌液,根部则是单独添加15 mmol/kg NTA的效果最好.由此可见,螯合剂与菌液共同添加对根部重金属含量的提高有一定的局限性,可能是由于二者的联合作用促进高羊茅地上部生长的同时,根部向地上部转移了更多的重金属.综合修复效果和经济成本,可考虑用10 mmol/kg NTA与微生物菌液联合使用,强化高羊茅对污灌区土壤重金属污染的修复效果.
[1]王祖伟,张辉.天津污灌区土壤重金属污染环境质量与环境效应[J].生态环境,2005,14(2):211-213.
[2]熊国焕,何艳明,栾景丽,等.龙葵、大叶井口边草和短萼灰叶对Pb、Cd和As污染农田的修复研究[J].生态与农村环境学报,2013,29(4):512-518.
[3]王新,贾永锋.紫花苜蓿对土壤重金属富集及污染修复的潜力[J].土壤通报,2009,40(4):932-935.
[4]ZHAO S L,JIA L N,DUO L A.The use of a biodegradable chelator for enhanced phytoextraction of heavy metals by Festuca Arundinacea from municipal solid waste compost and associated heavy metal leaching[J].Bioresource Technology,2013,129:249-255.
[5]周建民,党志,陈能场,等.3-吲哚乙酸协同螯合剂强化植物提取重金属的研究[J].环境科学,2007,28(9):2085-2088.
[6]向言词,官春云,黄璜,等.植物生长调节剂IAA、GA和6-BA对芥菜型油菜和甘蓝型油菜富集镉的强化[J].农业现代化研究,2010,31(4):504-508.
[7]高晓宁.土壤重金属污染现状及修复技术研究进展[J].现代农业科技,2013(9):229-231.
[8]EVANGELOUS M W,EBEL M,SCHAEFFER A.Chelate assisted phytoextraction of heavy metals from soil.effect,mechanism,toxicity,andfateofchelatingagents[J].Chemosphere,2007,68(6):989-1003.
[9]WU G,KANG H B,ZHANG X Y,et al.A critical review on the bioremoval of hazardous heavy metals from contaminated soils:issues,progress,eco-environmental concerns and opportunities[J].Journal of Hazardous Materials,2010,174(1/2/3):1-8.
[10]杨丽标,邹国元,张丽娟,等.城市污泥农用处置研究进展[J].中国农学通报,2008,24(1):420-424.
[11]鲍士旦.土壤农化分析[M].北京:中国农业出版社,2005.
[12]马文亭,滕应,凌婉婷,等.里氏木霉FS10-C对伴矿景天吸取修复镉污染土壤的强化作用[J].土壤,2012,44(6):991-995.
[13]USMAN A R,MOHAMED H M.Effect of microbial inoculation and EDTA on the uptake and translocation of heavy metal by corn and sunflower[J].Chemosphere,2009,76(7):893-899.
[14]QUARTACCI M F,IRTELLI B,BAKER A J.The use of NTA and EDDS for enhanced phytoextraction of metals from a multiply contaminated soil by Brassica Carinata[J].Chemosphere,2007,68(10):1920-1928.
[15]NOWACK B,SCHULIN R,ROBINSON B H.Critical assessment of chelant-enhanced metal phytoextraction[J].Environmental Science&Technology,2006,40(17):5225-5232.
[16]翁高艺,汪自强,吴龙华,等.可降解络合剂及微生物调控对海州香薷修复污染土壤的效应[J].土壤,2005,37(2):152-157.

