玉柏石松中甾体化合物对体外培养成骨细胞活性的影响
王朝元,胡 蝶
(中南民族大学 生命科学学院,武汉 430074)
玉柏石松,又名伸筋草,广泛分布于湖北、四川、贵州和西藏.在我国传统的中医药和土家族医学中,玉柏石松被用于治疗关节炎疼痛、四肢瘫痪、痛经和挫伤[1].临床用于治疗骨折,治疗效果良好[2,3],但其治疗骨折的药理学机制尚不清楚.石松属植物家族富含生物碱,具有很强的生物学活性[4].目前已有超过200种生物碱和140种石杉型三萜从石松属植物中分离出来,具有抗炎、止痛、抗菌等疗效[5,6].但这些玉柏石松中化合物促进成骨的研究尚不多见.
课题组前期从玉柏石松中分离来两个新型四环三萜类化合物[7]和甾体化合物stigmastan-3-one-21-oic acid (SA)[8].为研究玉柏石松甾体化合物SA (结构式见图1)诱导骨形成的潜能,本文通过研究SA对成骨细胞毒性、ALP活性、骨基质矿化和对骨分化相关基因(早期成骨分化和矿化相关基因)的表达的影响,来阐明SA的成骨活性,为进一步开发利用玉柏石松提供依据.
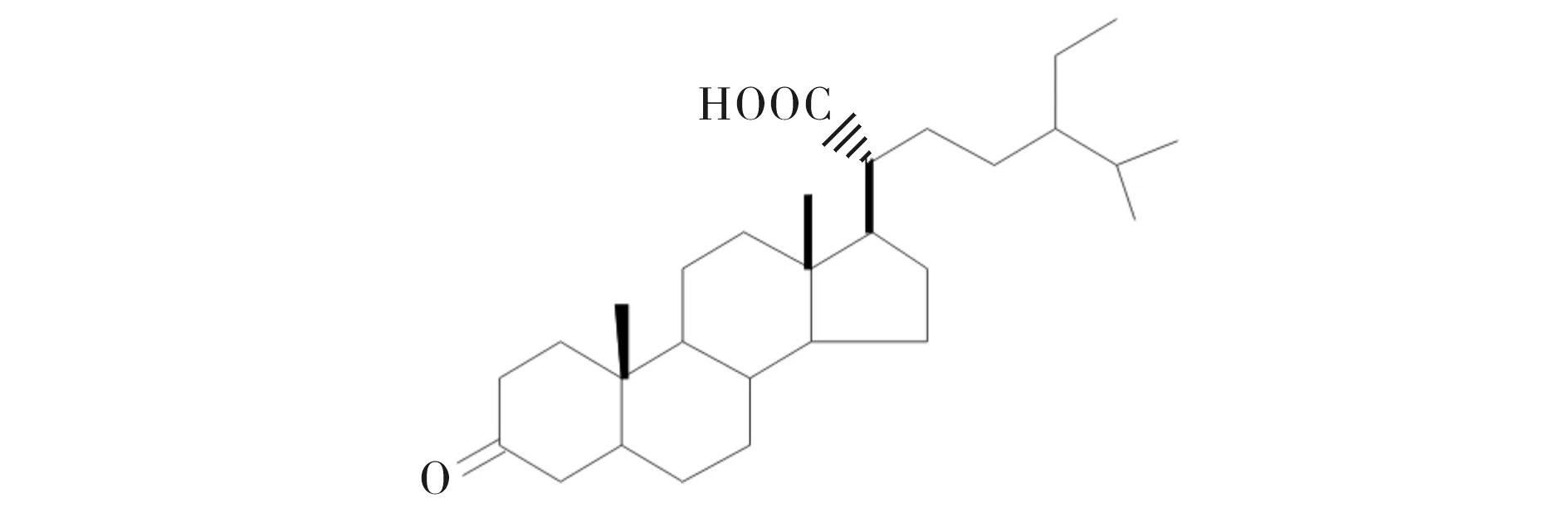
图1 豆甾烷-3-酮-21-羧酸的结构式Fig.1 The structure of stigmastan-3-one-21-oic acid
1 材料与方法
1.1 材料和仪器
本实验所用SA为本实验室从采自中国湖北省建始县的玉柏石松中分离纯化得到. α-MEM培养基(Thermo赛默飞世尔生化制品有限公司),小牛血清、胰蛋白酶、二甲基亚砜、Alamar Blue、PCR引物(Invitrogen),Alizarin red S (Sigma-Aldrich),Trizol、荧光标记试剂盒、cDNA第一条链合成试剂盒(Life Technology, Australia),矿物油(Sigma Aldrich).
96-孔板(Nunc),加样机器人(5075 Eppendorf epMotion),荧光定量PCR仪(7900HT Fast Real-time system, Applied Biosystems),酶联免疫检测仪(Optima BMG PolarStar).
1.2 SA提取与纯化
本实验所用的玉柏石松采自中国湖北省建始县.分离纯化过程详见参考文献[8].简言之,将玉柏石松风干磨成粉.用MeOH抽提3次,提取物溶解于3%的酒石酸/ H2O(pH=3)中,再用乙酸乙酯萃取,乙酸乙酯萃取物溶于90% 的H2O/MeOH中,依次用石油醚(PE),EtOAc和nBuOH萃取,将EtOAc 的提取物进行柱层析法(CC)分离,获9个组分(Fr.1~Fr.9).将Fr.5进行柱层析(硅胶,氯仿/丙酮的体积分数是1∶0→1∶1)后得到化合物SA.利用核磁共振谱技术分析化合物A的结构,得到其结构式如图1所示.
1.3 SA储存液的配制
1.6×10-3mol/L的SA储存液配制:将SA溶于二甲基亚砜(DMSO)并涡旋震荡,60℃加热30 min溶解,过滤除菌,置于-20℃长期保存.
1.4 细胞培养基
基础培养基:用于MC3T3-E1细胞生长,在α-MEM中加入10%胎牛血清,100 U/mL青霉素,100 mg/mL链霉素.
诱导培养基:用于分析SA对成骨细胞碱性磷酸酶(ALP)活性,细胞外基质矿化,成骨分化相关基因的表达,在基础培养基中加入终浓度为50 μg/mL抗坏血酸、10 mmol/L β-甘油磷酸钠、10-8mol/L地塞米松.
1.5 SA对成骨细胞存活率的影响
用Alamar Blue实验检测SA对细胞的毒性.将MC3T3-E1细胞按1×103/孔接种于96孔板中,每孔150 μL基础培养基,置于37℃、5%CO2培养箱中培养1 d后,弃去培养基,分别加入含有5种不同浓度的SA(1,2,4,8,16 μmol/L)的诱导培养基,以1%DMSO为阴性对照,每组设3个复孔.将培养板放置于37℃中培养0, 24, 72 h后,每孔加入18 μL的Alamar Blue试剂使其最终体积分数为10%.用荧光酶标仪于540 nm检测光吸收值(激发光544 nm, 发射光590 nm).
1.6 SA对成骨细胞碱性磷酸酶活性的影响
将MC3T3-E1细胞按3×104/孔接种于6孔板,置于37℃、5%CO2培养箱中培养2 h,待细胞贴壁后,弃去培养基,分别加入含有2种不同浓度的SA(8 μmol/L和16 μmol/L)的诱导培养基,以1%的DMSO为阴性对照,每组设3个重复,每3 d换一次培养基.
分别培养8 d和16 d后,弃去培养基,用PBS将细胞洗2次.加入0.1% Triton-X100裂解过夜.用细胞刮刀刮下细胞,转移至1.5 mL微量离心管中,4℃、10000 r/min离心10 min.将上清液以每孔100 μL转移到96孔板中,每孔加入200 μL para-Nitrophenylphosphate (pNPP) 显色剂,在室温黑暗条件下,轻摇96孔板反应30 min,用酶标仪检测405 nm处的吸光值.每个样品设3个重复.
1.7 SA对成骨细胞体外矿化的影响
用茜素红染色来检测细胞的矿化.将MC3T3-E1细胞按7.5×103/孔接种于48孔板中,分别加入含有2种不同浓度的SA(8 μmol/L和16 μmol/L)的诱导培养基,以1%的DMSO为阴性对照,每组设3个重复.分别培养8 d和16 d后,用PBS将样品洗2次.室温条件下,将样品固定在-20℃冰凉的甲醛上10 min之后,用dH2O洗两次,加入1%茜素红孵化,在吸出未结合的染料后,样品用dH2O洗若干次后风干,用倒置显微镜观察并拍照.
为了定量矿化,每孔中加入800 μL、体积分数为10%的乙酸.室温下,摇晃细胞培养板孵化30 min,用细胞刮刀刮下细胞,加入10%的醋酸.涡旋震荡30 s后,加入200~300 μL矿物油.加热到85℃,10 min,转移至冰上5 min,20000 r/min离心15 min.取每管上清液300~400 μL转移至新的1.5 mL的离心管中,加入体积分数为10%的氢氧化铵200 μL中和酸,取上清液150 μL转移至96孔板中于405 nm检测吸光值.每个样品设3个重复.
1.8 SA对成骨细胞骨分化相关基因mRNA表达的影响
将MC3T3-E1细胞按7.5×103/孔接种于48孔板中,加入含有SA的诱导培养基,SA的浓度为8 μmol/L和16 μmol/L,分别培养8 d和16 d,以1%的DMSO为阴性对照,每组设3个复孔.用Trizol裂解细胞,按照试剂盒说明书提取总RNA并合成cDNA第一条链.荧光定量PCR的引物如表1所示[9], GAPDH为内参基因.实验用384孔板,液体转移后进行热循环.PCR循环参数如下:95℃,10 min;变性:95℃,15 s;退火和延伸:60℃,60 s;循环数:45次,每个样品进行3次.用软件SDS2.2.2收集数据,通过2-ΔΔCT计算药物对相关基因表达影响[10].

表1 荧光定量PCR引物序列
ALP: alkaline phosphatase;OPN:osteopontin;OCN:osteocalcin;ColI:collagen I;BSP: bone sialoprotein
1.9 统计分析
用方差分析法对结果进行显著性差异分析,p<0.05被认为有显著性差异,p<0.01被认为有极显著性差异.
2 结果与分析
2.1 SA对成骨细胞增殖的影响
SA对成骨细胞增殖的影响见图2. Alamar blue试验显示:到第3 d,5个浓度的SA对MC3T3-E1细胞的增殖无明显影响.故选择2个最高的药物浓度(8 μmol/L和16 μmol/L)用于进一步实验.
2.2 对成骨细胞碱性磷酸酶活性的影响
SA对成骨细胞碱性磷酸酶活性的影响结果见图3.与对照组相比,8 μmol/L和16 μmol/L的SA处理细胞8 d后,均能抑制细胞碱性磷酸酶活性.第16 d,SA对成骨细胞碱性磷酸酶活性无显著影响(p>0.05).

1) 对照组(0 d); 2) 1 d; 3) 3 d与对照组比较,*p<0.05,**p<0.01,n=3图2 SA对体外培养成骨细胞增殖的影响Fig.2 The effect of SA on cell viability in vitro
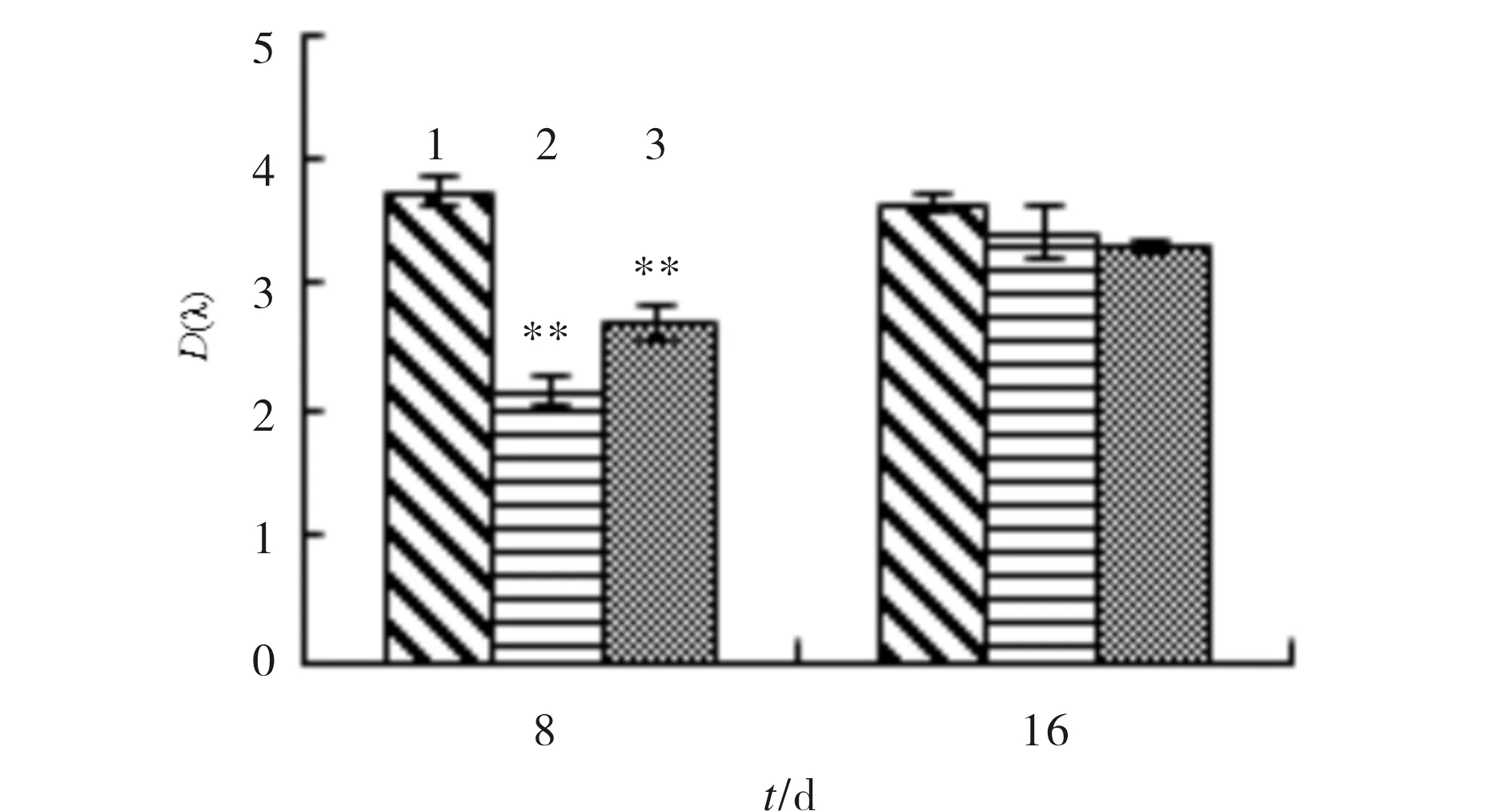
1) control; 2) 8 μmol/L SA; 3) 16 μmol/L SA与对照组比较,*p<0.05,**p<0.01,n=3图3 SA对成骨细胞碱性磷酸酶活性的影响Fig.3 The effect of SA on alkaline phosphatase activity in osteoblasts
2.3 SA对体外成骨细胞基质矿化的影响
SA对体外成骨细胞基质矿化的影响结果见图4.第8 d,对照组和SA处理组细胞都出现钙化,随着培养时间的延长,至第16 d,3组细胞均呈现较显著的体外钙化.
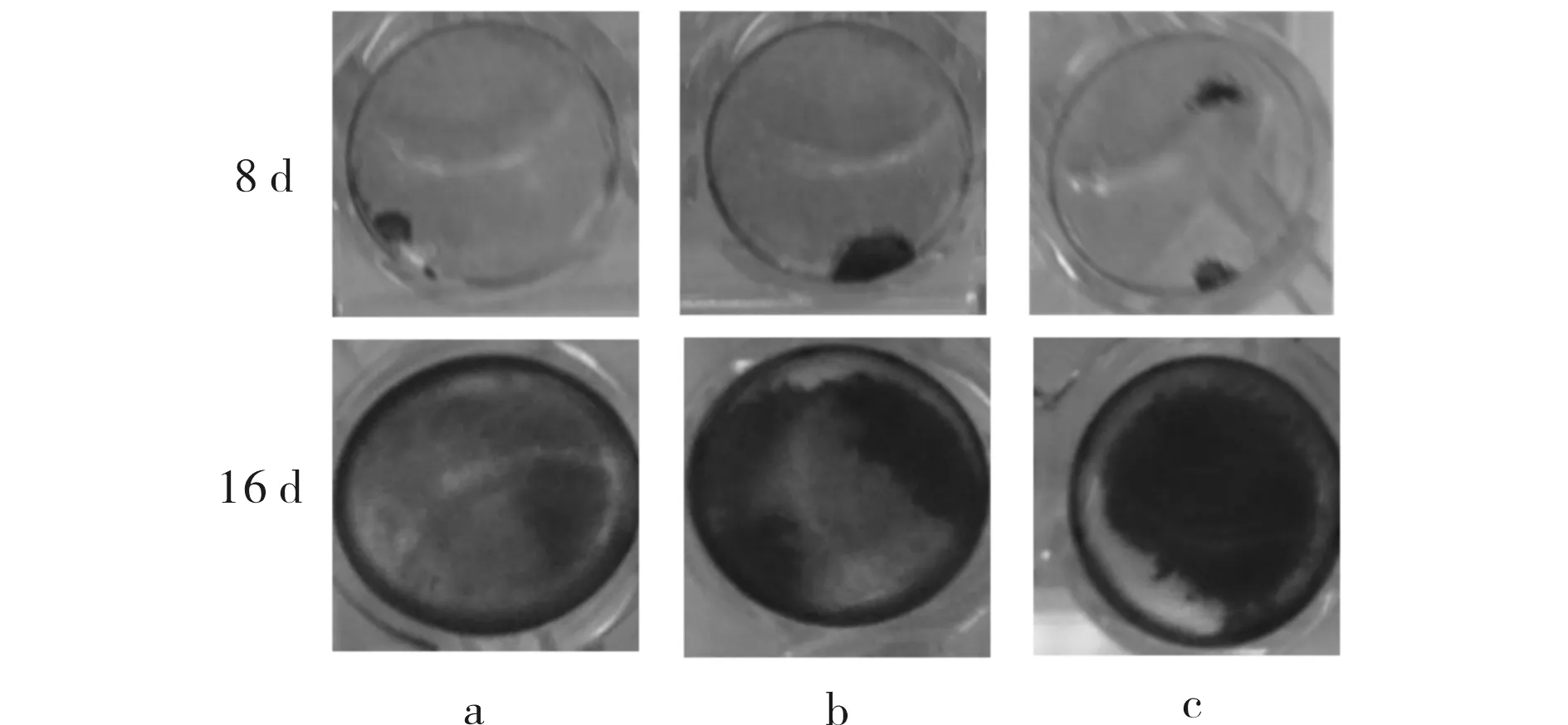
a) 0 μmol/L; b) 8 μmol/L; c) 16 μmol/L图4 SA对体外成骨细胞骨基质矿化的影响Fig.4 The effect of SA on osteoblast mineralization in vitro
不同浓度的SA对成骨细胞矿化影响如图5所示.图5中SA处理细胞16 d后,与对照组相比,8 μmol/L和16 μmol/L SA显著促进了骨基质矿化(p<0.05).

1) control; 2) 8 μmol/L SA; 3) 16 μmol/L SA与对照组比较,*p<0.05,**p<0.01,n=3图5 不同浓度的SA对成骨细胞矿化影响的定量研究Fig.5 Quantification of mineralization of osteoblasts treated with SA in vitro
2.4 SA对成骨分化相关基因表达的影响
2.4.1 SA对成骨基质蛋白基因mRNA表达的
影响
荧光定量PCR分析成骨细胞关键基因的表达结果见图6.图6a为SA对成骨细胞ALP mRNA表

1) control; 2) 8 μmol/L SA; 3) 16 μmol/L SA与对照组比较,*p<0.05,**p<0.01,n=3a) ALP;b) Col I;c) OPN;d) BSP;e) OCN图6 SA对成骨细胞骨基质形成相关基因mRNA表达的影响Fig.6 The effect of SA on the mRNA expression of bone matrix formation-related genes in osteoblasts
达的影响. SA对细胞短时间(8 d)处理抑制了ALP表达;经过16 d的培养,8 μmol/L的SA明显促进了ALP表达,而16 μmol/L的SA对ALP表达有明显抑制作用(p<0.05).图6b为SA对成骨细胞ColI mRNA表达的影响.处理细胞8 d,8,16 μmol/L的SA均抑制ColI基因表达(p<0.05);16 d SA对该基因的表达无明显影响(p>0.05).图6c为SA对成骨细胞OPNmRNA表达的影响.处理细胞8 d,8,16 μmol/L SA对OPN表达有明显促进作用;16 d后,高浓度SA(16 μmol/L)促进OPN的表达(p<0.05).图6d为SA对成骨细胞BSP mRNA表达的影响.8,16 μmol/L SA在处理细胞8,16 d,均抑制BSP表达(p<0.05).图6e为SA对成骨细胞OCNmRNA表达的影响(p<0.05).8 μmol/L和16 μmol/L的SA分别处理细胞8 d后,促进了OCN基因表达;但8 μmol/L和16 μmol/L的SA分别处理细胞16 d,OCN表达不受影响(p>0.05).
2.4.2 SA对成骨早期分化相关基因mRNA表达的影响
Runx-2和Osterix是骨祖母细胞分化成成骨细胞过程中两个关键基因.图7显示SA对成骨早期分化相关基因mRNA表达的影响.如图7a 所示,SA处理8 d抑制Runx-2的表达;处理16 d,8 μmol/L的SA对Runx-2的表达有一定促进作用,16 μmol/L的SA则表现出抑制作用.如图7b所示,SA处理显著抑制Osterix的表达(p<0.05).
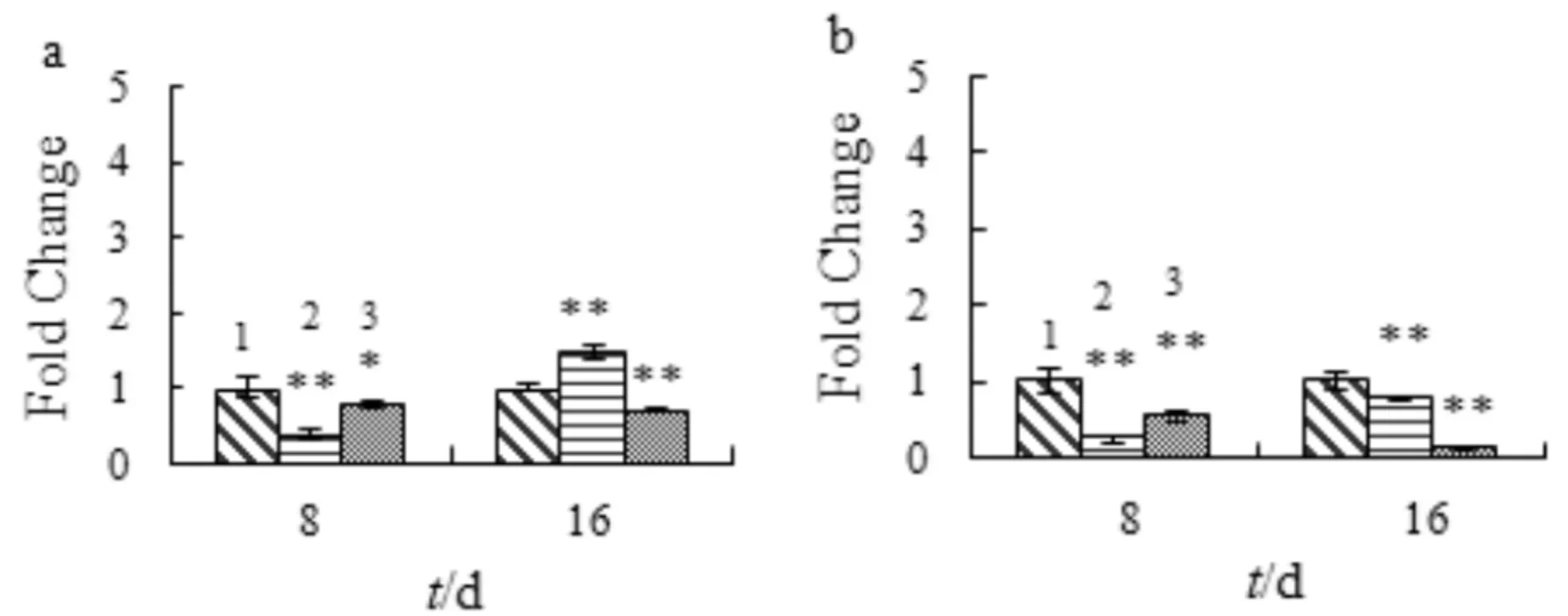
1) control; 2) 8 μmol/L SA; 3) 16 μmol/L SA与对照组比较,*p<0.05,**p<0.01,n=3a) Runx-2; b) Osterix图7 SA对成骨细胞期成骨细胞分化基因的mRNA表达的影响Fig.7 The effect of SA on the mRNA expression of early osteogenic differentiation genes in osteoblasts
2.4.3 SA对成骨细胞部分转录因子mRNA表达的影响
图8为SA对成骨细胞部分转录因子mRNA表达的影响.如图8a所示,SA处理对c-fosmRNA的表达无任何影响.如图8b和图8c所示,SA处理对Jun-D和Fra-2的表达的影响相同:SA处理细胞8 d对Jun-D和Fra-2表达影响甚微;16 d却显著促进它们的表达(p<0.05).故SA对Jun-D和Fra-2的mRNA表达影响呈时间依赖性.如图8d所示,16 μmol/L的SA分别处理显著提高细胞中Fra-1 mRNA表达量明显增加;8 μmol/L的SA处理细胞8 d后,Fra-1表达量有所增加,但16 d后,Fra-1的表达量与对照组差不多(p>0.05),故SA对Fra-1 mRNA的表达呈浓度依赖性.
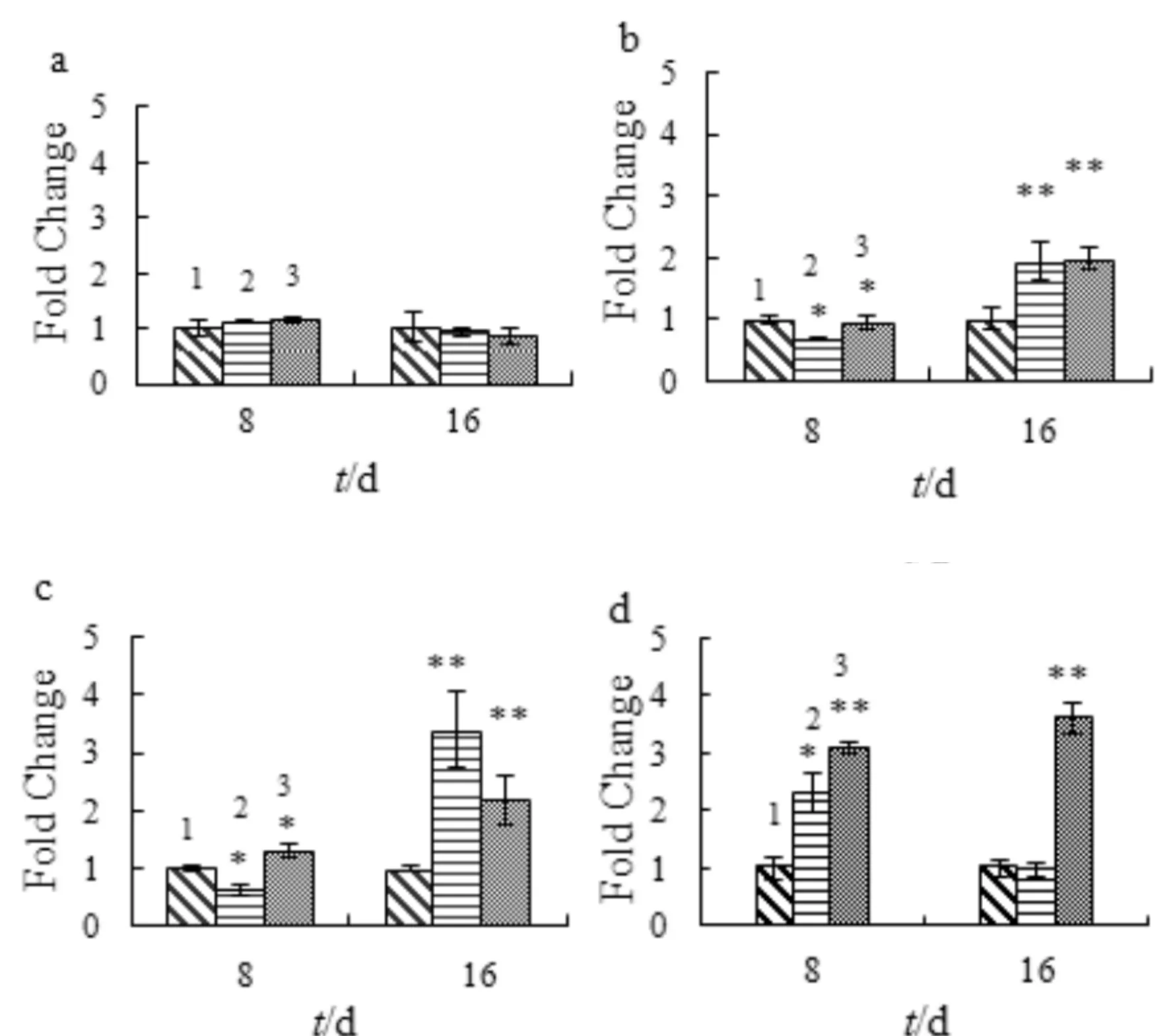
1) control; 2) 8 μmol/L SA; 3) 16 μmol/L SA与对照组比较,*p<0.05,**p<0.01,n=3a) c-fos; b) Jun-D; c) Fra-2; d) Fra-1图8 SA对成骨细胞部分转录因子mRNA表达的影响Fig.8 The effect of SA on the mRNA expression of transcription factors in osteoblasts
3 讨论
在生物体发育的过程中,骨生成是一个复杂的过程.首先涉及到MSC细胞分化成为前成骨细胞系.这个过程部分由Runx-2和Osterix这两个关键基因控制.Runx-2以一个锌指结构域结合在启动子上促进相关基因表达[11].Osterix是MSC向成骨细胞分化的特异因子,仅在正在生长的骨组织中表达[12,13].从干细胞分化到成骨细胞系的形成,Osterix基因表达贯穿了整个过程[12,13].这两个基因在骨祖母细胞分化成为成骨细胞过程中表达.本研究的结果表明:SA不利于MSC细胞分化成为前成骨细胞系.紧接着是成骨细胞基质形成及矿化阶段.成骨细胞形成后,骨基质的形成过程包括了骨相关基因的表达,这些基因包ALP,ColI,OPN,OCN和BSP,骨相关基因在骨基质的形成和骨基质钙化过程中起了重要的作用[14,15].
ALP是早期骨基质形成的标志物[16,17].OPN在骨基质的矿化和吸收过程中有重要作用.OPN分子富含天冬氨酸的区域与组织中的羟基磷灰石结合.OPN在骨折修复早期的骨重建中具有重要功能,它通过增强骨折断面旧骨的吸收加快骨折修复的进程.本研究发现:SA剂量短期处理可显著降低成骨细胞中成骨活性的代表性蛋白ALP的活性,显示其具有抑制骨生成的效果;但茜素红染色却显示出SA促进骨基质的矿化,显示出其具有促进骨生成的能力.同时,SA可显著促进OPN的表达.说明SA不利于骨折早期骨基质的形成,但可通过促进骨折界面的重吸收和后期骨基质的钙化来加速骨折的愈合.
Jun(c-Jun, Jun-B,Jun-D) 和 fos (c-fos, Fra-1, Fra-2 等)蛋白是转录因子AP1家族成员,在骨矿化阶段起着重要作用.AP1在调节骨生成和骨重建过程中起重要作用[18].本研究结果证明:SA在适当的浓度可显著地促进Jun-D、Fra-1和Fra-2的表达,具有促进骨折愈合过程中骨重建的能力.
4 结论
SA具有促进骨折愈合的活性,它通过促进转录因子Jun-D、Fra-1和Fra-2的表达,促进骨折断面旧骨的吸收和骨基质钙化等,使骨折愈合.
参 考 文 献
[1] 敖 鹏, 刘玉婕, 尹丽颖,等. 伸筋草正丁醇提取物对佐剂性关节炎大鼠血清IL-1β、IL-6、TNF-α的影响[J].中医药学报, 2011, 39(3): 22-24.
[2] 叶盛英, 杨本明, 杜 欣,等. 中药伸筋草研究概况[J].药学实践杂志, 2009, 27(1):18-21.
[3] 张志勇, 陈 华, 杨小莹,等. 伸筋草及其制剂研究进展[J].中国药师, 2014,17(3): 474-477.
[4] 滕翠翠,何永志,王 颖,等. 伸筋草化学成分及药理作用研究进展[J].医学综述,2008,14(20): 3174-3175.
[5] Li X L, Zhao Y, Cheng X, et al. Japonicumins A-D: four new compounds fromLycopodiumjaponicum[J]. Helvetica Chimica Acta, 2006, 89:1467-1473.
[6] Yan J,Zhang X M,Li Z R, et al. Three new triterpenoids fromLycopodiumjaponicumThunb[J]. Helvetica Chimica Acta, 2005, 88(2):240-244.
[7] Zhao Y H,Deng T Z,Chen Y,et al.Two new triterpenoids fromLycopodiumobscurumL[J]. J Asian Nat Prod Res, 2010, 12(8): 666-671.
[8] 邓铁忠. 玉柏石松化学成分研究与天然光敏剂类似物嘧啶并[5,4-c]喹啉-4-酮衍生物的合成[D]. 武汉:中南民族大学, 2009: 14.
[9] Lee S U, Park S J, Kwak H B, et al. Anabolic activity of ursolic acid in bone: Stimulating osteoblast differentiationinvitroand inducing new bone formationinvivo[J]. Pharmacol Res, 2008, 58(5/6):290-296.
[10] Livak K J,Schmittgen T D. Analysis of relative gene expression data using real time quantitative PCR and the 2-ΔΔCTmethod[J]. Methods, 2001, 25(4):402-408.
[11] Sun D M, Liu Z B, Zhao Y, et al. Runx 2 is involved in regulating osterix promoter activity and gene expression[J]. Prog Biochem Biophys, 2006, 33(10): 957-964.
[12] Nakashima K, Zhou X, Kunkel G, et al. The novel zinc finger-containing transcription factor Osterix is required for osteoblast differentiation and bone formation[J]. Cell, 2002, 108(1): 17-29.
[13] Ohyama Y, Nifuji A,Maeda Y,et al. Spaciotempora association and bone morphogenetic protein regulation of selerostin and ostetix expression during embryonic esteogenesis[J]. Endocrinology, 2004, 145(10): 4685- 4692.
[14] Fisher L W, Termine J D. Noncollagenous proteins in-fluencing the local mechanisms of calcification[J]. Clin Orthop Relat Res, 1985, 200:362-385.
[15] Mundlos S, Otto F, Mundlos C, et al. Mutations invol-ving the transcription factor CBFA1 cause cleidocranial dysplasia[J]. Cell, 1997, 89(5):773-779.
[16] Owen T A, Aronow M, Shalhoub V, et al. Progressive development of the rat osteoblast phenotypeinvitro: reciprocal relationships in expression of genes associated with osteoblast proliferation and differentiation during formation of the bone extracellular matrix[J]. J Cell Physiol, 1990, 143(3):420-430.
[17] Pockwinse S M, Wilming L G, Conlon D M, et al. Expression of cell growth and bone specific genes at single cell resolution during development of bone tissue-like organization in primary osteoblast cultures[J]. J Cell Biochem, 1992, 49(3):310-323.
[18] Wagner E F. Functions of AP1 (Fos/Jun) in bone development[J].Ann Rheum Dis, 2002, 61(sup 2):ii40-ii42.

