强化血糖控制对重症急性胰腺炎患者血糖变异性及预后的影响
施莉 韦炜 向华 吴珍萍 杜蓓莉
重症急性胰腺炎(SAP)常伴有以应激性高血糖为特征的胰岛素抵抗,且波动性较大,不易控制,故其对机体的危害比单纯的高血糖大[1-2]。研究发现,血糖变异性(glucose variability, GV)是血糖控制的重要环节,被视为SAP病死率及相关并发症的独立危险因素,与患者预后密切相关[3]。目前对于SAP患者的血糖控制范围以及是否需要强化血糖控制仍存在争议[4],且GV对预后影响的研究也鲜有报道。本研究采用前瞻性随机对照的方法对SAP患者进行强化血糖控制,旨在探讨强化血糖控制对患者GV及预后的影响。
一、资料与方法
1.一般资料:收集2008年1月至2013年6月金华市人民医院收治的年龄≥18岁的SAP患者98例,诊断均符合2004年中华医学会消化病学分会胰腺疾病学组制定的标准[5],并经B超、CT或磁共振胰胆管成像(MRCP)检查明确者。排除有糖尿病史、长期使用激素及心、肝、肾功能不全者。98例患者中男性58例,女性40例;年龄29~72岁,平均(47±5)岁。病因:外伤性胰腺炎34例,病毒性脑炎伴AP 29例,复发性AP 21例,过敏性紫癜伴AP 11例,不明病因3例。本研究经我院伦理学委员会审议通过,患者及家属均签署知情同意书。
2.治疗方法:按照随机数字表法将SAP患者分为强化组和对照组,各49例。两组患者性别、年龄、原发病因等具有可比性。患者早期急性期均采用非手术常规治疗,包括禁食,胃肠减压,抑制胰酶活性,控制感染,纠正水、电解质、酸碱平衡及胃肠外营养支持等。根据Van den Berghe胰岛素强化治疗方案[6],当患者血糖>8.3 mmol/L时,采用胰岛素(诺和灵R)50 IU加0.9%生理盐水50 ml持续静脉泵入,最大速度不超过50 IU/h,其中强化组血糖控制在4.4~6.1 mmol/L,对照组血糖控制在6.1~8.3 mmol/L,并根据监测的血糖水平调整患者的胰岛素用量。
3.检测指标:入院后1、3、7 d抽取空腹静脉血,HITACH I17600-020全自动生化分析仪测定空腹血糖(FBG)、空腹胰岛素定量(FINS),采用免疫散射速率比浊法测定 C-反应蛋白(CRP)。佩戴Guardian RT CGMS(Mini Med Inc)监测血糖,采用血糖水平的标准差作为GV指标。记录两组患者的住院时间、APACHEⅡ评分的变化、低血糖事件发生率及病死率。

二、结果
1.两组患者血FBG、FINS及 CRP水平比较:入院后1、3、7 d,强化组FBG、CRP均较对照组明显降低,差异有统计学意义(P值均<0.05);入院后1 d,两组间FINS水平差异无统计学意义(P>0.05),而入院后3、7 d,强化组FINS显著低于对照组,差异有统计学意义(P值均<0.05,表1)。
2.两组患者GV、APACHEⅡ评分、低血糖发生率、病死率、住院天数比较:强化组患者的住院时间、入院后7 d APACHEⅡ评分、GV均显著低于对照组,差异具有统计学意义(P值均<0.05);两组入院时APACHEⅡ评分、低血糖发生率、病死率的差异均无统计学意义(表2)。

表1 两组患者血FBG、FINS、CRP水平的变化
注:与对照组比较,aP<0.05
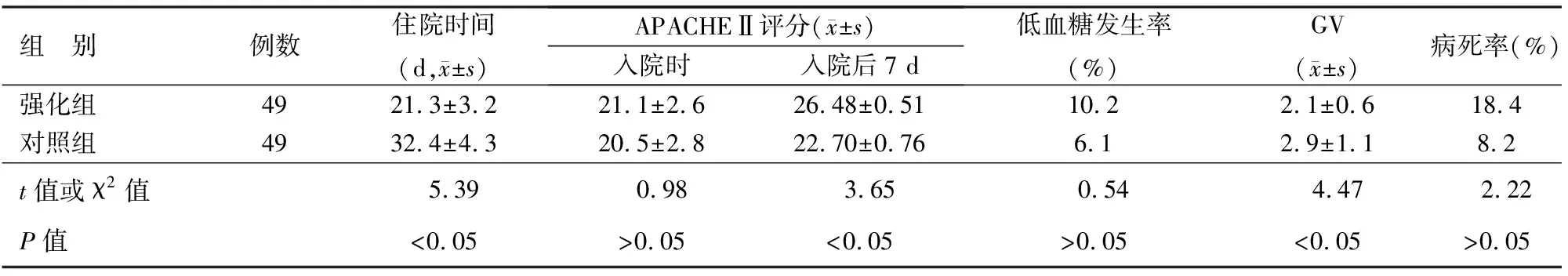
表2 两组患者的GV及预后指标比较
3.GV与病死率的相关性分析
以住院时间、GV、入院时及入院后7 d的APACHEⅡ评分、低血糖事件为自变量,结局(病死或存活)为因变量建立Logistic回归模型,结果显示,在排除住院时间、入院时及入院后7 d的APACHEⅡ评分、低血糖事件的影响后,GV是SAP患者病死的独立危险因素(OR=4.121,P<0.05)。
讨论SAP时机体处于严重应激状态,常伴有糖皮质激素、胰高血糖素等升糖激素的大量释放,同时存在胰岛素抵抗现象。过去临床上将这种一过性血糖升高视为一种机体保护性反应,往往不建议将血糖控制得过于严格[7]。2004年Van den Berghe[6]的研究指出,在血糖水平未达到11~12 mmol/L(可引发其相关并发症的阈值)之前无需特殊处理,但其随后的研究又发现,对应激性高血糖患者进行强化胰岛素治疗,血糖控制在4.4~6.1 mmol/L,可使患者的病死率绝对值降低3.4%,且相关并发症亦明显降低[8]。
目前,对于强化血糖控制能否改善SAP患者的预后尚存在争议。Reeds[9]的研究认为,与血糖6.1~8.3 mmol/L相比,适度的高血糖(8.3 mmol/L)并不会对SAP患者的预后造成影响,且后者出现低血糖事件的风险更低。本研究采用Van den Berghe胰岛素强化血糖控制方案,与传统的血糖控制方法比较,结果显示强化组血FBG、CRP、FINS、入院后7 d的APACHEⅡ评分、GV、住院天数均较对照组明显降低,且未增加低血糖的发生率,说明强化血糖控制是有效的。其机制一方面是减轻了高血糖对胰岛B细胞的毒性,改善或修复胰岛B细胞的功能,重塑胰岛素分泌能力,发挥胰岛素本身的抗炎作用;另一方面是血糖水平的降低减轻了胰岛素抵抗,增强机体对胰岛素的敏感性,从而恢复胰岛素的生理作用。但本研究的强化组病死率未见明显降低,考虑可能与样本量较少有关。
GV是血糖控制的一个重要环节,其对预后的影响可能更大,但目前尚无控制GV的有效方法[10]。本研究以血糖水平的标准差作为GV的指标,结果显示GV是SAP患者病死的独立危险因素,说明强化血糖控制可降低SAP患者的血糖波动,且GV对患者病死率有一定的预测价值,与Ali等[11]研究结果一致。Krinsley[12]的研究表明,GV在P5、P50、P75、P95四分位数的病死率分别为12.1%、19.9%、27.7%和37.8%,也说明GV与SAP的预后密切相关。
参 考 文 献
[1] Gardner TB,Vege SS,Pearson RK,et al.Fluid resuscitation in acute pancreatitis[J].Clin Gastroenterol Hepatol,2008,6(10):1070-1076.
[2] 倪海滨,李维勤,柯路,等.液体复苏对重症急性胰腺炎患者内稳态影响的临床分析[J].中国危重病急救医学,2010,22(9):522-524.
[3] Chen L.A literature review of intensive insulin therapy and mortality in critically ill patients[J].Clin Nurse Spec,2010,24(2):80-86.
[4] Hermanides J,Vriosendorp TM,Besman RJ,et al.Glucose variability is associated with intensive care unit mortality[J].Crit Care Med,2010,38(3):838-842.
[5] 中华医学会消化病学分会胰腺疾病学组.中国急性胰腺炎诊治指南(草案)[J].胰腺病学,2004,4(1):35-38.
[6] 刘向新,赵宏胜,张彬,等.强化胰岛素治疗对重症急性胰腺炎45例患者预后影响[J].南通大学学报(医学版),2010,30(2):151-153.
[7] Van den Berghe G.How does blood glucose control with insulin save lives in intensive care[J]?J Clin Invest,2004,114(9):1187-1195.
[8] Van den Berghe G,Wilmer A,Milants I,et al.Intensive insulin therapy in mixed medical/surgical intensive care units:benefit versus harm[J].Diabetes,2006,55(11):3151-3159.
[9] Reeds D.Near-normal glycemia for critically ill patients receiving nutrition support:fact or folly[J].Curr Opin Gastroenterol,2010,26(2):152-155.
[10] Hermanides J,Vriosendorp TM,Besman RJ,et al.Glucose variability is associated with intensive care unit mortality[J].Crit Care Med,2010,38(3):838-842.
[11] Ali NA,O′Brien JM Jr,Dungan K,et al.Glucose variability and mortality in patients with sepsis[J].Crit Care Med,2008,36(8):2316-2321.
[12] Krinsley JS.Effect of an intensive glucose management protocol on the mortality of critically ill adult patients[J].Mayo Clin Proc,2004,79(8):992-1000.

