铜、锌离子对厌氧氨氧化污泥脱氮效能的影响
李 祥,黄 勇,刘福鑫,袁 怡,陈钟姮,丁 敏 (1.苏州科技学院环境科学与工程学院,江苏 苏州 215011;2.苏州科技学院环境生物技术研究所,江苏 苏州 215011)
厌氧氨氧化脱氮过程无需有机物、分子氧的参与和脱氮效能高的优势,而受到研究者的广泛关注[1-5].但是,厌氧氨氧化菌倍增时间长,导致反应器启动缓慢.所以在厌氧氨氧化反应器启动过程中对控制参数及环境的要求十分严格[6-7].然而工业废水成分往往比较复杂,若直接运用厌氧氨氧化处理,还存在着诸多问题.其中铜、锌等重金属(一般10~20mg/L)的毒性就是主要影响因素之一.同时,工业废水排放过程中难免出现金属浓度的波动.而重金属离子对厌氧氨氧化菌的影响研究较少.本文以工业废水中常见重金属离子(Cu2+、Zn2+)为对象,研究其长短期内对厌氧氨氧化污泥脱氮效能及污泥形态的影响,并探求抑制现象是否可逆.
1 实验材料与方法
1.1 实验装置
重金属对厌氧氨氧化污泥短期影响的实验装置采用带有螺纹盖的玻璃试管,有效体积100mL.重金属对厌氧氨氧化污泥长期影响的实验装置采用 SBR反应器,有效体积 500mL.泥水混合状态和温度由水浴振荡器实现:温度控制在32℃,振荡速度为100r/min.
1.2 接种污泥与废水组成
接种污泥为经过长期富集培养的厌氧氨氧化颗粒污泥,污泥直径 1~3.6mm.厌氧氨氧化污泥在种泥反应器中的脱氮效能为 82g N/(gVSS·d),MLVSS/MLSS为0.552.采用人工配制废水,主要由NH4Cl 382mg/L,NaNO2640mg/L,NaHCO31g/L,KHCO31g/L,KH2PO427mg/L,CaCl2·2H2O 136mg/L,MgSO4·7H2O 20mg/L,微量元素Ⅰ1mL/L 和微量元素Ⅱ1.25mL/L.微量元素浓缩液组分为Ⅰ:EDTA 5000mg/L,FeSO45000mg/L;微量元素浓缩液Ⅱ组分为:EDTA 5000mg/L, ZnSO4·7H2O(因素影响实验按 需 配 制 ), CoCl2·6H2O 240mg/L,MnCl2·4H2O 990mg/L,CuSO4·5H2O(因素影响实验按需配制),NaMoO4·2H2O 220mg/L,NiCl2·6H2O190mg/L,NaSeO4·10H2O 210mg/L,H3BO414mg/L.通过0.1mol/L的盐酸将进水pH值控制在7.5±0.1.通过高纯氮气曝气20min,以保证厌氧环境.
1.3 分析方法
指标测定方法均按照《水和废水监测分析方法》[8].NH4+-N采用纳氏分光光度法;NO2--N采用 N-(1萘基)-乙二胺分光光度法;NO3--N采用紫外分光光度法;pH值采用哈纳 pH211型酸度计;温度由水银温度计测定; Cu2+、Zn2+:火焰原子吸收法;称重:精密分析天平(精确至 0.0001g);MLSS和MLVSS:重量法.
1.4 试验方法
1.4.1 Cu2+、Zn2+浓度对厌氧氨氧化污泥脱氮效能的短期影响 为了能够等分含水量较高的厌氧氨氧化湿污泥,在每批实验前将厌氧氨氧化污泥等分为24份,每份污泥湿重2g.通过数次培养后,选取脱氮效能相近(最大差值控制在 5%以内)的12支作为一批,进行单一重金属离子影响试验.对12支试管分别进入含有不同Cu2+(Zn2+)浓度的废水进行培养(表 1),经过 10~12h培养后,通过测定废水中含氮化合物的变化评估 Cu2+(Zn2+)浓度对厌氧氨氧化污泥脱氮效能的短期影响,以氮去除速率表征.每种金属离子影响做2次平行实验.
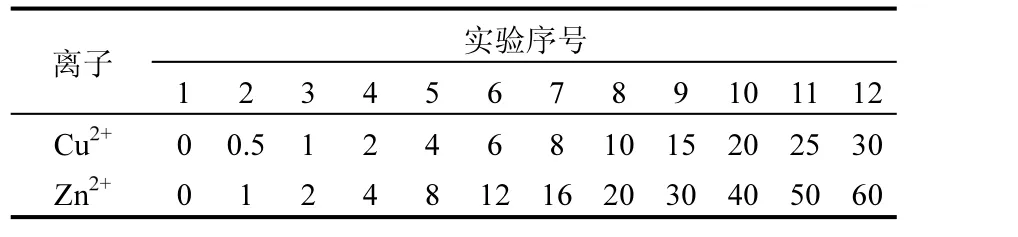
表1 短期实验进水Cu2+、Zn2+浓度(mg/L)Table 1 The influent concentration of Cu2+ and Zn2+ in short-time experiment (mg/L)
1.4.2 长期内Cu2+、Zn2+浓度对厌氧氨氧化污泥脱氮效能的影响 采用2个有效体积500mL的SBR反应器分别标记为R1、R2.R1进行Cu2+长期影响实验,R2进行Zn2+长期影响实验.每个反应器分别接种厌氧氨氧化湿污泥 4g,初始运行周期设定为12h.待其脱氮效能稳定后逐步提高进水重金属离子浓度,直至出现脱氮效能大幅下降,厌氧氨氧化污泥脱氮效能处于稳定抑制状态后,降低进水重金属浓度,研究其恢复难易程度.
1.5 半抑制浓度的计算
通常用重金属的半数有效浓度(IC50)来定量表征重金属对活性污泥的毒性, 本实验采用如下公式拟合计算IC50值:
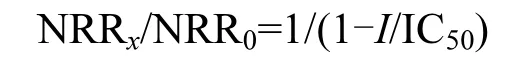
式中:NRR0为进水重金属离子浓度为 0时厌氧氨氧化污泥活性,gN/(gMLVSS·d);NRRx进水重金属离子浓度为x mg/L时厌氧氨氧化污泥活性, gN/(g MLVSS·d);I为进水重金属质量浓度, mg/L.
2 结果与讨论
2.1 Cu2+、Zn2+对厌氧氨氧化污泥脱氮效能的短期影响
2.1.1 短期内 Cu2+对厌氧氨氧化污泥脱氮效能的影响 进水NH4+-N浓度100mg/L,NO2--N浓度130mg/L,进行 10h培养后,由图 1可知,随着水中Cu2+浓度的增大,出水NH4+-N、NO2--N浓度呈先下降后升高的趋势.作为对照实验的 1号出水NH4+-N、NO2--N浓度分别为 39.04,74.74mg/L,氮去除速率为 82.82gN/(gMLVSS·d).当进水 Cu2+浓度达到1~8mg/L时,出水NH4+-N、NO2--N浓度基本未受到影响,氮去除速率维持在 145.34~162.74gN/(gMLVSS·d).当进水Cu2+浓度大于8mg/L时,出水NH4+-N、NO2--N浓度开始逐渐升高,厌氧氨氧化污泥的脱氮效能开始逐步下降.最终当进水Cu2+浓度大于30mg/L时,厌氧氨氧化污泥氮去除速率下降到38.96g N/(g MLVSS·d).
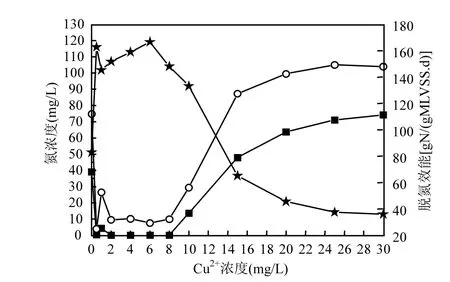
图1 短期内厌氧氨氧化污泥脱氮效能随Cu2+浓度的变化Fig.1 The variation of nitrogen removal efficiency on Anammox with Cu2+ concentration in short-time

Chamchoi等[9]在厌氧氨氧化反应器启动过程中将厌氧氨氧化过程分为 3个阶段:污泥水解阶段;增值阶段和稳定阶段.Tang 等[10-11]基于厌氧氨氧化污泥对氮的去除,增加了迟滞阶段和抑制阶段.通过10h批式实验可知,Cu2+浓度变化对厌氧氨氧化的影响较大,具体可以分为3个阶段:活性刺激阶段,随着 Cu2+浓度的提高(0~1mg/L),厌氧氨氧化污泥的活性获得刺激,有利于污泥脱氮效能的提高,刺激后的最大氮去除速率是刺激前的 1.97倍;稳定阶段(1~8mg/L),Cu2+浓度在此范围内变化时,厌氧氨氧化污泥活性不随 Cu2+浓度变化而变化;抑制阶段(大于 8mg/L),随着 Cu2+浓度的进一步提高,厌氧氨氧化污泥活性开始下降,最终处于完全抑制状态.荣宏伟等[12]研究表明,当Cu2+浓度从0mg/L上升到0.5mg /L,硝化细菌的生物活性未受到不利影响,反而对反硝化细菌的活性具有一定的促进作用,提高微生物的生长率, 使处理效果得到增强.张蕾等[13]在研究铁离子浓度对厌氧氨氧化影响时表明,将进水铁离子浓度从0.03mmol/L 提高到0.075mmol/L后可提高厌氧氨氧化污泥的基质转化能力,厌氧氨氧化菌对 NH4+-N、NO2--N的最大去除速率分别提高了1.8倍和1.6倍.说明适当提高进水重金属离子的浓度是有利于厌氧氨氧化菌生长.而yang等[14]在研究重金属对厌氧氨氧化活性的影响过程中仅出现抑制阶段,未发现本文所述的刺激阶段和稳定阶段,分析其原因可能是厌氧氨氧化菌活性较低,且重金属离子浓度较高.

图2 短期内厌氧氨氧化污泥脱氮效能随Zn2+浓度的变化Fig.2 The variation of nitrogen removal efficiency on Anammox with Zn2+ concentration in short-time
2.1.2 Zn2+短期内对厌氧氨氧化污泥脱氮效能的影响 如图2所示,培养12h后,随着进水Zn2+浓度的增加,出水NH4+-N、NO2--N浓度也出现先下降后升高的趋势.但是升高和下降所对应的Zn2+浓度与 Cu2+有所区别.作为对照实验的 1号经过10h培养后,出水NH4+-N、NO2--N浓度分别为45.14, 71.5mg/L,氮去除速率为154.56g N/(g MLVSS·d).当进水 Zn2+浓度达到 4mg/L 时,氮去除速率增加到最大240.61g N/(g MLVSS·d).随着进水 Zn2+浓度的增加,厌氧氨氧化污泥的脱氮效能开始逐渐下降.最后当进水 Zn2+浓度达到60mg/L时,其氮去除速率下降到 65.33g N/(g MLVSS·d).由于前几只试管进水Zn2+浓度跨度较大,所以在 2批实验中均未发现脱氮效能的稳定阶段.仅观察到 2个阶段:刺激阶段(0~4mg/L),刺激后的厌氧氨氧化污泥最大脱氮效能为刺激前的1.56倍;抑制阶段(大于4mg/L),厌氧氨氧化污泥的脱氮效能开始逐步下降.
2.2 Cu2+、Zn2+长期内对厌氧氨氧化污泥脱氮效能的影响

图3 Cu2+浓度的变化对厌氧氨氧化污泥脱氮效能影响及恢复Fig.3 The effect of nitrogen removal efficiency on Anammox with Cu2+ concentration in long-time
2.2.1 Cu2+长期内对厌氧氨氧化污泥脱氮效能的影响 如图 3所示,在反应器 R1运行初期(0~29d),进水 Cu2+浓度由 0mg/L 逐步升高到2mg/L时,厌氧氨氧化污泥对 NH4+-N、NO2--N的去除率基本上保持在95%以上.当进水Cu2+浓度达到4mg/L时,厌氧氨氧化污泥的脱氮效能开始逐渐下降,并且随着运行天数的增加,脱氮效能出现大幅度下降,最终氮去除速率降到 55.2gN/(m3·d).于是在反应器R1运行的42d,将进水Cu2+浓度下降到1mg/L,经过28d的培养, NH4+-N、NO2--N基本得到去除.厌氧氨氧化污泥的氮去除速率回升到 457gN/(m3·d).反应器运行的70,90d,氮去除速率基本处于稳定状态.说明 Cu2+对厌氧氨氧化污泥的抑制可以得到恢复.
2.2.2 Zn2+长期内对厌氧氨氧化污泥脱氮效能的影响 由图4可见,随着进水Zn2+浓度由0逐步增加到4mg/L时,出水NH4+-N、NO2--N浓度基本保持在10mg/L左右,说明厌氧氨氧化污泥的脱氮效能未因 Zn2+浓度提高而发生变化,反应器氮去除速率稳定在 450g N/(m3·d).当将进水 Zn2+浓度增加到6mg/L时,出水NH4+-N、NO2--N浓度升高,经过9d培养,出水NH4+-N、NO2--N浓度基本处于稳定,此时厌氧氨氧化污泥的氮去除速率为 313g N/(m3·d).为了进一步了解 Zn2+浓度对厌氧氨氧化影响,在反应器运行的 46d,将进水 Zn2+浓度增加到8mg/L,此时出水NH4+-N、NO2--N浓度进一步降低,最终反应器氮去除速率下降到160g N/(m3·d).在反应器运行的 67d,将进水 Zn2+浓度下降到2mg/L时,反应器出水NH4+-N、NO2--N浓度逐步降低,经过27d的培养,NH4+-N、NO2--N出水浓度下降到反应器运行初期的状态,氮去除速率上升到 440g N/(m3·d).

图4 Zn2+浓度的变化对厌氧氨氧化污泥脱氮效能影响及恢复Fig.4 The effect of nitrogen removal efficiency on Anammox with Zn2+ concentration in long-time

2.3 Cu2+、Zn2+对厌氧氨氧化污泥形状影响
Cu2+、Zn2+对厌氧氨氧化污泥形态的影响基本相同,所以就 Cu2+对厌氧氨氧化污泥的影响为例,分析其影响,如图5所示.在接种入反应R1的厌氧氨氧化污泥如图5A所示,为鲜艳的红色颗粒污泥.随着进水Cu2+浓度增加到4mg/L时,厌氧氨氧化污泥的脱氮效能开始逐步下降,污泥的颜色也开始出现变化.经过 41d的培养,厌氧氨氧化污泥颜色基本呈现出灰白色,少量颗粒表面呈现出硫酸铜的浅蓝色,还有少量污泥仍具有一点淡黄色.说明大量的 Cu2+吸附并积累到厌氧氨氧化颗粒污泥中,并且有可能与部分蛋白质结合,使细胞内蛋白质变形,最终导致厌氧氨氧化污泥的脱氮效能受到严重抑制[15].但是从图 5(B)可以看出(长期影响过程中运行 42d的污泥),由于厌氧氨氧化颗粒污泥在观其内受到抑制,所以其颗粒形态未发生明显的变化.当进水 Cu2+浓度降低后,经过48d(即反应器运行 90d时)培养,反应器的脱氮效能恢复到实验前期,污泥的颜色得到部分恢复(如图 5C所示).因此污泥颜色能够很好的指示重金属离子对厌氧氨氧化污泥活性的影响.

图5 厌氧氨氧化污泥受Cu2+ 抑制前后形态(A接种污泥,B抑制后污泥,C抑制恢复后)Fig.5 The morphology of Anammox granular slugde fore-and-aft inhibition by Cu2+
2.4 Cu2+、Zn2+浓度对厌氧氨氧化污泥活性影响机理
微量重金属是微生物生命活动所需营养物质,也是酶的活化剂或活性基,可以促进微生物生长[16].但是微生物对重金属的需要量极少.当环境中重金属的含量超过一定浓度时,会对微生物产生毒性作用,它们与必要的金属竞争含硫化合物和氧的结合位点,既可取代生物大分子活性点位上原有的金属,也可结合该分子的其他位置,破坏核酸和蛋白质结构,干扰氧化磷酸化和渗透压平衡.通过短期研究及线性拟合计算出 Cu2+和Zn2+对厌氧氨氧化污泥活性的有效半抑制浓度分别为22.2,48.3mg/L.说明厌氧氨氧化菌对Cu2+的敏感性明显强于 Zn2+.Yang等[14]利用活性为(12.4± 3.1)mgN/(gVSS·h)的厌氧氨氧化污泥进行短期批式试验表明,Cu2+半抑制浓度为12.9mg/L.Lotti 等[17]利用活性为(0.68±0.4)gN2-N/(VSS·d)的厌氧氨氧化颗粒污泥进行生活污水中 Zn2+浓度对厌氧氨氧化活性影响研究,经过 1h反应,其半抑制浓度为 4.5mg/L.本研究中,经过 24h反应,半抑制浓度为 3.9mg/L,并且随着运行时间的延长,半抑制有效浓度会逐渐降低.而本实验的研究结果明显高于Yang和Lotti的报道值,出现此结果可能是污泥粒径较大,使得颗粒内外存在较高的重金属离子浓度梯度.Volcke等[18]在研究颗粒分布对厌氧氨氧化污泥转化基质浓度影响实验时也发现厌氧氨氧化污泥颗粒尺寸的增大将有助于对抑制物耐受性的提高.
短期研究表明,当进水Cu2+和Zn2+浓度分别为10,8mg/L时,厌氧氨氧化污泥的活性出现明显抑制.但是长期实验研究表明,当进水Cu2+和Zn2+浓度分别达到 4,6mg/L时,厌氧氨氧化污泥活性就受到抑制.说明在长期培养过程中厌氧氨氧化污泥对重金属离子具有累积功能.其主要原因可能是因为厌氧氨氧化污泥具有丰富的胞外聚合物,具有较强的吸附能力,将环境中的金属离子吸附到颗粒污泥表面.当厌氧氨氧化污泥受到抑制后,将进水 Cu2+和 Zn2+浓度分别下降到 1,2mg/L时,厌氧氨氧化污泥的脱氮效能能够恢复到初始状态,说明这种累积不是一种无限制的累积.
目前在厌氧氨氧化反应器的启动和污泥驯化培养过程中一般采用人工配水,进水 Cu2+和Zn2+浓度分别为 0.08,0.126mg/L[19-21].而由本实验可知,当进水Cu2+浓度从0mg/L增加到1mg/L或者Zn2+浓度从0mg/L增加到4mg/L时,厌氧氨氧化污泥的活性均获得刺激,其效果分别是不含金属离子培养的1.97倍和1.55倍.说明适当提高进水重金属离子的浓度是有利于厌氧氨氧化菌生长的.因此在厌氧氨氧化污泥驯化及培养过程中适当提高进水 Cu2+和 Zn2+的浓度可以有效地缩短反应器的启动时间.
3 结论
3.1 批式实验表明,Cu2+和Zn2+离子对厌氧氨氧化污泥脱氮效能的影响可分为刺激、稳定和抑制3个阶段.当进水Cu2+浓度0~1mg/L和Zn2+浓度0~4mg/L时,随着进水金属离子浓度的增加,微生物活性受到刺激,氮去除速率迅速增加; Cu2+浓度1~8mg/L时,氮去除速率处于稳定状态.Cu2+浓度大于8mg/L和Zn2+大于4mg/L时,随着进水金属离子浓度的增加,氮去除速率逐步下降.
3.2 在厌氧氨氧化污泥长期培养过程中,进水Cu2+、Zn2+浓度应低于4,6mg/L以避免厌氧氨氧化污泥的活性受到抑制.
3.3 Cu2+、Zn2+离子对厌氧氨氧化污泥活性的半抑制浓度分别为22.2,48.3mg/L.将进水Cu2+、Zn2+浓度分别降低到 1,2mg/L后,受重金属抑制的厌氧氨氧化污泥活性可以恢复.
[1]李 祥,黄 勇,朱 莉,等.蚀刻液废水厌氧氨氧化脱氮性能研究 [J].中国环境科学, 2011,32(12):2199-2204.
[2]李 祥,黄 勇,郑宇慧,等.厌氧氨氧化富集培养研究及其工业应用进展 [J].水处理技术, 2010,36(5):18-21.
[3]Zhu Liang, Liu Junxin.Landfill leachate treatment with a novel process: Anaerobic ammonium oxidation (Anammox) combined with soil infiltration system [J].Journal of Hazardous Materials,2008,151:202-212.
[4]Zhang Li, Yang Jiachun, Furukawa Kenji.Stable and high-rate nitrogen removal from reject water by partial nitrification and subsequent anammox [J].Journal of Bioscience and Bioengineering, 2010,110(4):441-448.
[5]陈旭良,郑 平,金仁村,等.味精废水厌氧氨氧化生物脱氮的研究 [J].环境科学学报, 2007,27(5):747-750.
[6]Araujo J C, Campos A C, Correa M M et al.Anammox bacteria enrichment and characterization from municipal activated sludge[J].Water Science and Technology, 2011,64(7):1428-1434.
[7]Jin Ren Cun, Yang Guang Feng, Yu Jin Jin, et al.The inhibition of the Anammox process: A review [J].Chemical Engineering Journal, 2012,197:76-82.
[8]国家环境保护局.水和废水监测分析方法(第四版) [M].北京:中国环境科学出版社, 2002:258-282.
[9]Chamchoi N, Nitisoravut S.Anammox enrichment from different conventional sludges [J].Chemosphere, 2007,66:2225-2232.
[10]Tang C J, Zheng P, Mahmood Q, et al.Start-up and inhibition analysis of the anammox process seeded with anaerobic granular sludge [J].J.Ind.Microbiol.Biotechnol, 2009,36:1093-1100.
[11]Tang C J, Zheng P, Zhang L, et al.Enrichment features of anammox consortia from methanogenic granules loaded with high organic and methanol contents [J].Chemosphere, 2010,79:613-619.
[12]荣宏伟,王 勤,张朝升,等.Cu2+、Zn2+对生物脱氮系统的影响[J].环境工程学报, 2009,3(4):617-620.
[13]张 蕾,郑 平,胡安辉.铁离子对厌氧氨氧化反应器性能的影响 [J].环境科学学报, 2009,29(8):1629-1634.
[14]Yang Guang Feng, Ni Wei Min, Wu Kai, et al.The effect of Cu (II)stress on the activity, performance and recovery on the Anaerobic Ammonium-Oxidizing (Anammox) process [J].Chemical Engineering Journal, 2013,226:39-45.
[15]Hu Z Q, Chandran K, Grasso D, et al.Impact of metal sorption and internalization on nitrification inhibition [J].Environ.Sci.Technol., 2003,37:728-734.
[16]Jefferson B, Burgess J E, P ichon A, et al.Nutrient addition to enhance biological treatment of gray water [J].Wat.Res.,2001,35(11):2702-2710.
[17]Lotti T, Cordola M, Kleerebezem R, et al.Inhibition effect of swine wastewater heavy metals and antibiotics on anammox activity [J].Water Science and Technology, 2012,66(7):1519-1526.
[18]Volcke E I P, Picioreanu C, De Baets B, et al.The Granule Size Distribution in an Anammox-Based Granular Sludge Reactor Affects the Conversion Implications for Modeling [J].Biotechnology and Bioengineering, 2012,109(7):1629-1636.
[19]Li Huosheng, Zhou Shaoqi, Ma Weihao, et al.Fast start-up of ANAMMOX reactor: Operational strategy and some characteristics as indicators of reactor performance [J].Desalination, 2012,286:436-441.
[20]Qiao Sen, Nishiyama Takashi, Fujii Tatsuo, et al.Rapid startup and high rate nitrogen removal from anaerobic sludge digester liquor using a SNAP process [J].Biodegradation, 2012,23:157-164.
[21]Duan Xiumei, Zhou Jiti, Qiao Sen, et al.Start-up of the anammox process from the conventional activated sludge in a hybrid bioreactor [J].Journal of Environmental Sciences, 2012,24(6):1083-1090.

