不同来源精子对卵胞浆内单精子注射治疗结局的影响
张志宏,朱海波,张馨月,邓舒,刘睿智,侯毅
(1.吉林大学白求恩第一医院生殖医学中心产前诊断中心,长春 130021;2.吉林大学中日联谊医院泌尿外科,长春 130031)
自1992年Palermo等[1]第一次报道了卵胞浆内单精子注射技术(ICSI)以来,解决了很多因男性因素导致的不育。随着技术的发展,ICSI不但可使用新鲜的射出精子,还可以使用睾丸精子抽吸术(TESA)或经皮附睾精子抽吸术(PESA)取出的精子,这些技术使无精子症患者获得其后代成为可能[2,3]。
精子发生在体内经过了睾丸、附睾内一系列成熟和修饰过程,即不同来源的精子在畸形率、DNA和染色体异常、成熟度和印记基因等方面差异甚多[4]。关于不同来源精子是否会影响ICSI的治疗结局,文献报道不一。本文通过观察不同来源精子行ICSI治疗后的受精率、胚胎发育及妊娠结局情况,旨在探讨不同来源精子对ICSI治疗后结局的影响,为临床无精子症患者的ICSI治疗及预后提供依据。
一、材料与方法
1.研究对象:回顾性分析2011年5月至2013年4月于我院生殖中心接受辅助生殖治疗的154个ICSI周期的患者妊娠结局,均为男方因素不育。根据男方精液的来源不同,将154个ICSI周期分为3组:严重少、弱精子症射出精子组(A组),即至少两次精液常规检查均提示精子浓度<1×106/ml或处理后前向运动精子浓度<1×106/ml的96周期(89对夫妇);附睾精子组(B组),32周期(30对夫妇);睾丸精子组(C组),26周期(25对夫妇)。睾丸、附睾精子组男方均为无精子症或极度少精子症、隐匿精子症,取卵当日新鲜精液无活动精子。三组患者外周血染色体核型均正常。
本研究中,射出精子组、附睾精子组和睾丸精子组的一般情况列于表1。三组患者不育年限、内膜厚度、移植胚胎数均无统计学差异(P>0.05);睾丸精子组女方年龄比射出精子组小(P=0.032),与附睾精子组相比无统计学差异(P>0.05)。
2.精子收集:(1)射出精子:男方清洁外阴及双手后,手淫取精,将精液留取于无菌容器内。液化后1,600r/min离心5min。去除上层精浆,留取离心管底部0.3ml沉淀,加入3ml Quinn’s 1006精子洗涤液(SAGE,美国)重悬离心洗涤2次,1,600r/min离心5min,备用。(2)附睾精子:术野常规消毒铺巾,1%利多卡因局麻。10ml注射器接7号针头,先吸取1ml Quinn’s 1006精子洗涤液,直接穿刺进入附睾体内,保持负压后退出,将抽吸出的含附睾液的培养液置于倒置显微镜(×400)下,寻找精子。若见活动精子则将培养液1,600r/min离心5min。去除上层液体,留取离心管底部0.3ml沉淀,加入3ml Quinn’s 1006精子洗涤液重悬离心洗涤2次,1,600r/min离心5min,备用。若多次抽吸未发现精子,改行睾丸穿刺取精。(3)睾丸精子:术野常规消毒铺巾,1%利多卡因局麻。20 ml注射器直接穿刺进入睾丸体内,保持负压后退出,将吸出的生精小管移入Quinn’s 1006精子洗涤液中,用1ml注射器撕碎曲细精管,倒置显微镜(×400)下,寻找精子。若见活动精子则将含精子培养液的睾丸组织1,000r/min离心至10min,吸取上清液以1,600r/min离心5min。去除上层液体,留取离心管底部0.3ml沉淀,加入3ml Quinn’s 1006精子洗涤液重悬离心洗涤2次,1,600r/min离心5min,备用。
3.促排卵方案:常规促性腺激素释放激素激动剂(GnRHa,默克雪兰诺,德国)、尿人绝经期促性腺激素(HMG,丽珠制药)、重组人卵泡刺激素(rFSH,默克雪兰诺,德国)方案促排卵,当优势卵泡直径≥18mm时,于当晚注射人绒毛膜促性腺激素(HCG,丽珠制药)8,000IU,34~36h后取卵。常规双腔取卵针穿刺双侧阴道,超声下吸取卵泡。将获得的卵泡液置于体式镜(×10)下,获取卵冠丘复合物(OCCs)。将OCCs置于 Quinn’s受精液含5%人血清白蛋白(HAS)的1020(SAGE,美国)中培养,2~4h后去除颗粒细胞,将 MII期卵子行ICSI。16~18h后观察有明显双原核和双极体者判断为正常受精卵,并移入Quinn’s卵裂液含10%血清蛋白代用品(SPS)的1026(SAGE,美国)中培养,于第3天移入Quinn’s囊胚培养液含10%血清蛋白代用品(SPS)的1029(SAGE,美国)中培养至移植。
4.相关标准:精液常规分析采用WHO第5版的标准[5]。优质胚胎评价标准:卵裂速度正常,细胞大小均一或略有不均,形状基本规则,碎片≤20%,第2天无多核现象。移植后常规黄体酮(浙江仙居仙明制药)支持,移植后14d测血HCG,确定是否生化妊娠,移植后35dB超检查,有孕囊及心管搏动者确定为临床妊娠。
5.统计学分析:应用SPSS 17.0软件进行统计分析,计量资料以(¯x±s)表示,采用两个独立样本t检验分析,率的比较采用卡方检验,P<0.05为差异有统计学意义。
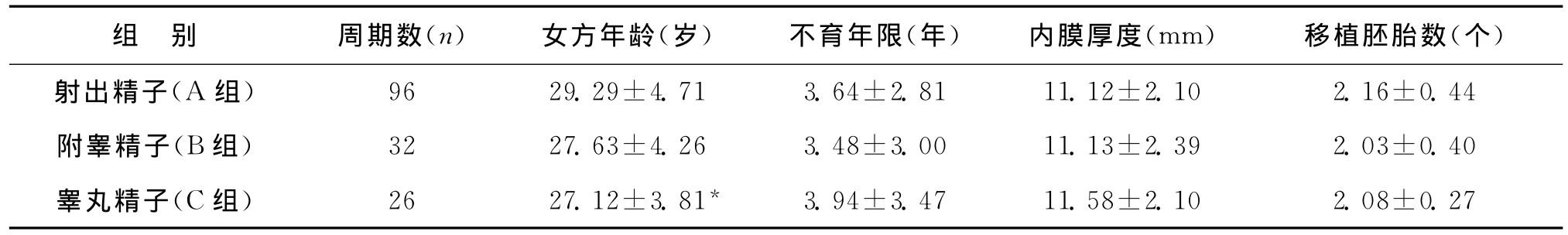
表1 射出精子组、附睾精子组和睾丸精子组的一般情况(x-±s)
二、结果
射出精子组、附睾精子组和睾丸精子组的ICSI治疗后结局:附睾精子组2PN率、2PN卵裂率、优质胚胎率、妊娠率和种植率与射出精子组相比均无统计学差异(P>0.05)。与射出精子组比较,睾丸精子组2PN率、优质胚胎率均降低(P=0.000;P=0.000),与附睾精子组比较,睾丸精子组2PN率、优质胚胎率均降低(P=0.003;P=0.000);而与射出精子组、附睾精子组比较,睾丸精子组的2PN卵裂率、妊娠率和种植率均无统计学差异(P>0.05)(表2)。

表2 射出精子组、附睾精子组和睾丸精子组的ICSI治疗结局(%)
三、讨论
ICSI是治疗严重少精子症、弱精子症以及梗阻和非梗阻性无精子症等男性不育的有效手段,当今应当关注的是不同来源的精子是否会影响经辅助生殖技术治疗后的胚胎发育及妊娠结局。精子从产生到排出体外,在体内经历了睾丸、附睾内的一系列不同成熟过程。理论上,睾丸内的精子已经完成了减数分裂过程,成为单倍体的遗传配子,在一定程度上,已经可以使卵子受精;精子在附睾中的成熟包括细胞膜结构和功能的变化,顶体外膜抗原分布改变和获能状态的保持等,这些变化可能会增加精子的受精能力[6]。有学者报道,与射出精子相比,用附睾、睾丸精子行ICSI,受精率无显著差异,同时认为只要处理精子的过程合理,ICSI过程中找到形态正常并且活动的精子,其受精情况与精子来源并无相关性[7,8]。也有学者认为,睾丸精子的受精率比附睾精子低,原因是睾丸精子并没有经过在附睾中的成熟过程,可能导致其激活卵子,使其授精的能力降低,但附睾精子、睾丸精子及射出精子经过ICSI治疗后妊娠结局并无显著差异[9]。另有学者认为,虽然用睾丸精子行ICSI后其受精率较附睾精子低,种植率却增高,认为睾丸精子中存在某些避免精子过度成熟的物质[10]。
本文研究表明,睾丸精子经ICSI治疗后正常受精率、优质胚胎率均低于射出精子及附睾精子,分析其原因可能与睾丸精子成熟度低有关。另外,睾丸精子组正常受精率低也与非梗阻性无精子症患者坚持拒绝供精,于取卵当日获得极少量精子,个别使用不活动精子行ICSI或行ICSI时无法选择精子形态有关。睾丸精子组优质胚胎率显著低于其他两组,说明精子不成熟可能影响早期胚胎发育。而附睾精子组正常受精率、优质胚胎率与射出精子组比较无显著差异,说明附睾精子与射出精子成熟度基本一致,可获得与射出精子更相近的结果。而临床上为避免造成医源性梗阻性无精子,往往只对梗阻性无精子症患者于取卵当日选择附睾穿刺。
Raman等[11]和张晔等[12]报道,行ICSI治疗时射出精子和手术获得精子的妊娠结局无明显变化,本文研究结果与其一致。但辅助生育过程中女方年龄是影响妊娠结局的一个重要因素[13]。在无精子症不育夫妇中,女性卵巢排卵功能和内膜容受性大多是正常的,本研究中睾丸精子组的女方年龄较射出精子组低,但与附睾精子组相比无显著差异,这可能是导致本研究中睾丸精子与附睾精子、射出精子相比妊娠率和种植率没有统计学差异的一个原因。今后,我们将做更多大样本、前瞻性的相关研究。本研究表明,手术得到的精子与射出精子相比,虽然成熟度较低,相关功能可能不完整,但并不影响ICSI治疗后的妊娠结局。同时有文献报道,睾丸精子与附睾精子相比DNA损伤程度更低[14];应用附睾精子治疗失败的患者改用睾丸精子治疗可获得更高的临床妊娠率[15]。本文研究结果进一步证明,通过PESA或TESA得到的精子行ICSI助孕是无精子症不育男性有效的治疗手段。
染色体异常或基因异常是导致无精子症的一个重要原因[16],而ICSI可将这些遗传缺陷传递给下一代。所有这些无精子患者虽然可通过PESA或TESA结合ICSI实现孕育后代的愿望,但也必须清楚地认识到,ICSI本身机械性穿透卵子越过自然受精的过程,可能存在表观遗传学改变等风险以及其他隐患;同时ICSI可将异常精子信息传递给下一代,而这些异常信息无法体现在胚胎早期的形态学上,所以对于无精子症患者治疗前必须进行染色体检查、遗传学咨询、种植前遗传学诊断和产前检查等,避免严重畸形儿的出生,以达到无精子症患者优生优育的治疗目的。
综上所述,尽管睾丸精子行ICSI,可能影响受精及早期胚胎发育,但与严重少弱精子症患者射出精子及附睾来源的精子行ICSI相比,妊娠结局没有显著差异。
[1] Palermo G,Joris H,Devroey P,et al.Pregnancies after intracytoplasmic injection of single spermatozoom into an oocyte[J].Lancet,1992,340:17-18.
[2] Glina S,Fragoso JB,Martins FG,et al.Percutaneous epididymal sperm aspiration(PESA)in men with obstructive azoospermia[J].Int Braz J Urol,2003,29:141-146.
[3] Gorgy A,Podsiadly BT,Bates S,et al.Testicular sperm aspiration(TESA):the appropriate technique[J].Hum Reprod,1998,13:1111-1113.
[4] Kobayashi H,Sato A,Otsu E,et al.Aberrant DNA methylation of imprinted loci in sperm from oligospermic patients[J].Hum Mol Genet,2007,16:2542-2551.
[5] WHO.世界卫生组织人类精液检查与处理实验室手册[M].第5版 .北京:人民卫生出版社,2010:115-119.
[6] Cooper TG.Sperm maturation in the epididymis:a new look at an old problem[J].Asian J Androl,2007,9:533-539.
[7] 王俊霞,孙海翔,胡娅莉,等 .附睾及睾丸精子行ICSI治疗无精子症妊娠结局[J].中华男科学杂志,2004,10:751-754.
[8] Sukcharoen N, Sithipravej T, Promviengchai S,et al.Comparison of the fertilization rate after intracytoplasmic sperm injection(ICSI)using ejaculated sperms,epididymal sperms and testicular sperms[J].J Med Assoc Thai,1998,81:565-571.
[9] 宋成,曾勇,胡晓东,等.ICSI中不同来源精子对临床结局的影响[J].中华男科学杂志,2009,15:822-824.
[10] Dozortsev D,Neme R,Diamond MP,et al.Embryos generated using testicular spermatozoa have higher developmental potential than those obtained using epididymal spermatazoa in men with obstructive azoospermia[J].Fertil Steril,2006,86:606-611.
[11] Raman JD,Schlegel PN.Testicular sperm extraction with intracytoplasmic sperm injection is successful for the treatment of non-obstructive azoospermia associated with cryptorchidism[J].J Urol,2003,170:1287-1290.
[12] 许张晔,叶碧绿,黄学峰,等 .不同来源精子对ICSI治疗后妊娠结局的影响[J].中国男科学杂志,2007,21:41-44.
[13] 谢妍,林德伟,熊露,等 .女性年龄和获卵数对PESA-ICSI治疗结果的影响 [J].暨南大学学 报 (医 学版),2011,32:629-631.
[14] Moskovtsev SI,Jarvi K,Mullen JB,et al.Testicular spermatozoa have statistically significantly lower DNA damage compared with ejaculated spermatozoa in patients with unsuccessful oral antioxidant treatment[J].Fertil Steril,2010,93:114-116.
[15] 徐志鹏,孙海翔,张宁媛,等 .睾丸精子行ICSI改善严重畸形精子症患者治疗结局5例报告[J].中华男科学杂志,2009,15:218-222.
[16] Ferlin A,Arredi B,Foresta C.Genetic causes of male infertility[J].Reprod Toxicol,2006,22:133-141.

