高山姬鼠瘦素抵抗模式的初步研究*
余婷婷, 杨盛昌, 朱万龙, 高文荣, 郑佳,沐远, 章迪, 王政昆
(云南师范大学 生命科学学院,云南 昆明 650500)
1994年,Zhang等利用位点克隆技术成功克隆了小鼠的肥胖(ob)基因及人类的同源序列,并阐明ob基因产物—瘦素的分子结构及生理作用,发现其在体脂及能量代谢等分子调控方面具有重要作用[1].瘦素由白色脂肪细胞分泌,含有166或167个氨基酸残基,分子量为16 KD,具有降低体重、抑制摄食和促进产热的作用[2].正常机体中,瘦素一方面作用于下丘脑,引起食欲下降,增加产热及能量消耗;另一方面则作用于胰岛、肝脏、脂肪等瘦素受体,刺激外周去甲肾上腺素的释放,进而增加能量消耗[3].
瘦素的发现起到划时代的意义[4-5],瘦素抵抗(leptin resistance)的发现则给人们提供新的视野来认识动物能量稳态[6].瘦素抵抗表现为瘦素水平增加时,并不一定表现出食欲的增强被抑制.瘦素抵抗主要表现出两种状态,一种是病理性的,例如食物诱导性肥胖,另一种为允许体重调节点出现变化的适应性反应,例如哺乳动物的妊娠或动物的季节性变化[7].目前关于瘦素抵抗的研究主要涉及病理变化[4],且肥胖症动物模型主要来自啮齿动物中的小鼠和大鼠[8-9],而野外小型啮齿动物食物诱导瘦素抵抗及其适应意义的研究报道并不多,本研究中高山姬鼠食物诱导瘦素抵抗的研究可能为瘦素抵抗研究提供一种新的模型动物.
高山姬鼠(Apodemuschevrieri)属于鼠亚科,多分布于横断山脉及附近地区,如云南的昆明、昭通、大理、丽江、澜沧江、怒江流域地区等[10],本研究以栖息于横断山地区的高山姬鼠为对象,测量体重、脂肪重量、摄入能、血清瘦素含量,对其在长期充足摄食条件下是否存在瘦素抵抗进行研究.
1 实验材料和方法
1.1 实验动物
实验所用高山姬鼠于2012年11月捕自大理剑川的灌丛(海拔2 560 m),该地区属横断山区,干湿季节分明,气温随海拔高度的增加而降低,年温差小,日温差大,使该地区气温低于同纬度平原地区,表现出明显的温带季风型气候特征,6月月平均气温最高(18.8 ℃),1月月平均气温最低(-4.3 ℃).
1.2 实验动物处理
捕获的实验动物带回云南师范大学生科院实验动物房(昆明),每天喂以充足的饲料(昆明医科大学生产),用塑料瓶供水.实验选取15只健康雄性高山姬鼠,平均体重为(32.98±0.96) g,在光照为12 L:12 D、温度为(25±1) ℃条件下驯化3个月.每28 d测定体重,驯化3个月后,发现7只高山姬鼠的体重显著增加(肥胖组),8只高山姬鼠的体重维持稳定(正常组).
1.3 摄入能的测定
能量收支利用食物平衡法测定[11],每个代谢笼放置一只实验动物,无巢材.15只高山姬鼠在代谢笼内适应一周后开始实验,84 d后进行能量摄入的测定.实验前一天11:00~13:00时,给动物充足喂食,第二天人工仔细分离剩余的食物,置于恒温干燥箱(65 ℃)干燥至恒重,然后称重(精确到0.01 g),每次收集时间均在11:00~13:00时进行.用长沙友欣仪器制造有限公司生产的全自动氧弹式热量仪(YX-ZR/Q型)测定热值,进行摄入能的计算.摄入能(kJ/d)=食物热值(kJ/g)×摄入干物质(g/d).
1.4 血清瘦素含量的测定
驯化结束后,将动物处死取血,制备血清样本,采用瘦素放射免疫分析试剂盒(美国Linco公司生产)测定血清瘦素的含量.
1.5 体脂重量的测定
将内脏去除,但保留消化道上脂肪,动物尸体置于烘箱(65 ℃)烘至恒重,然后粉碎混匀,称取约1 g粉碎后的样品用SoxtecTM2043浸提装置测定体脂重量.
1.6 统计分析
采用SPSS16.0对实验数据进行统计分析.对驯化条件下高山姬鼠的体重变化、摄入能、脂肪重量和血清瘦素含量采用独立样本t检验(Independent-Sample T Test)进行分析,体重、摄入能、身体脂肪重量和血清瘦素含量间的关系采用Person相关分析.结果均表示为平均值±标准误(Mean±SE),P< 0.05差异显著,P<0.01差异极显著.
2 结 果
2.1 体重
实验前15只高山姬鼠,平均体重为(32.98±0.96) g,驯化3月后,8只(正常组)高山姬鼠的体重维持稳定(33.94±0.83) g,而另7只(肥胖组)高山姬鼠体重为(50.58±2.00) g,两组的体重差异极显著(t=-5.990,P<0.01).
2.2 摄入能、脂肪重量、血清瘦素含量
驯化3个月后,肥胖组高山姬鼠的胴体重、摄入能和血清瘦素含量极显著高于正常组(胴体重:t=-3.946,P<0.01;摄入能:t=-2.536,P<0.01;血清瘦素含量:t=-4.068,P<0.01),肥胖组脂肪重量显著高于正常组(t=-2.285,P<0.05)(见表1).
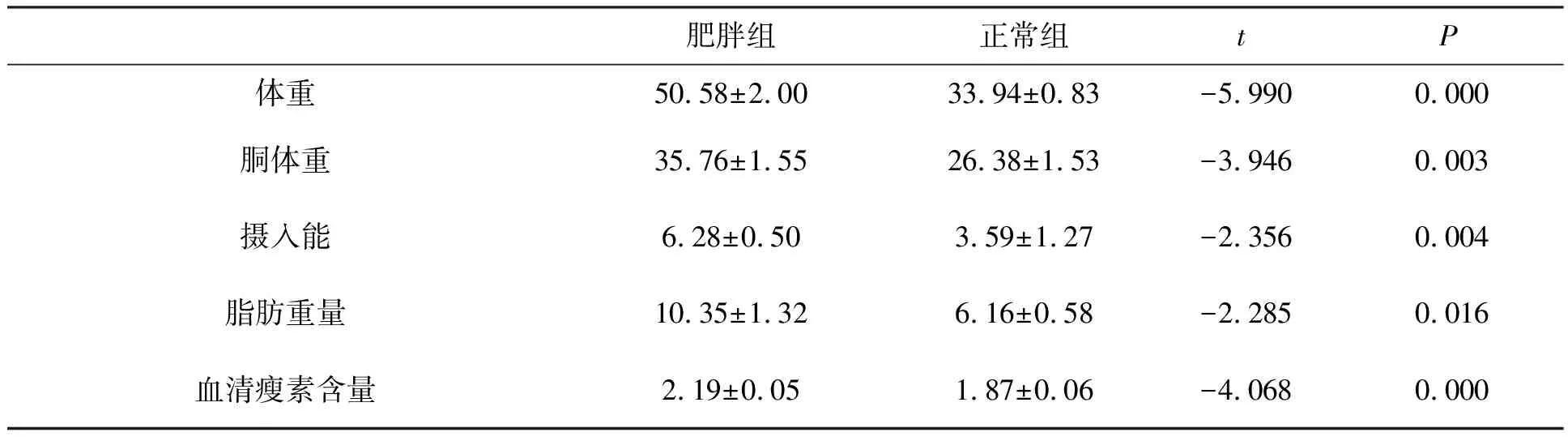
表1 肥胖组与正常组高山姬鼠体重、胴体重、摄入能、脂肪重量、血清瘦素含量的比较
2.3 血清瘦素含量与体重、脂肪重量及摄入能的相关性
高山姬鼠血清瘦素含量与体重(r=0.016,P=0.001,图1)、脂肪重量(r=0.466,P=0.005,图2)和摄入能(r=0.481,P=0.004,图3)显著正相关.
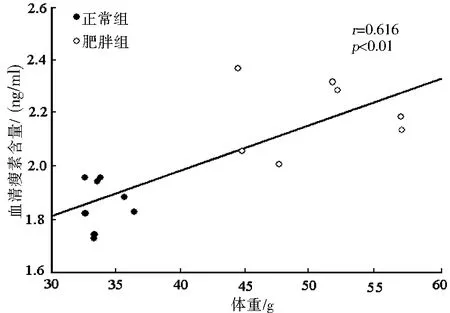
图1 高+山姬鼠血清瘦素含量与体重的相关关系
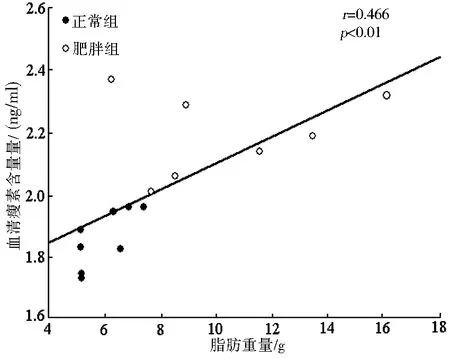
图2 高山姬鼠血清瘦素含量与脂肪重量的相关关系

图3 高山姬鼠血清瘦素含量与摄入能的相关关系
3 讨 论
Kennedy[12]提出了“脂类稳态”模型(lipostat model)来解释动物的能量稳态维持机制,该模型认为脂肪组织可能产生了某种信号物质,通过这种物质反馈调节食欲的强弱,从而调节有机体的能量稳态.脂肪组织分泌的瘦素能量稳态的调节中意义重大[13],其可以作为信号分子而作用于下丘脑,调节体内脂肪含量,从而维持体重稳定[14].注射外源瘦素后的小鼠,其摄入能、体重和体脂均降低,但代谢率、体温均升高,说明高浓度血清瘦素具有抑制摄食、促进产热及降低体重的作用[2].瘦素在啮齿动物血浆中的浓度与体重和脂肪含量呈正相关[15].啮齿类肥胖模型中,血浆瘦素水平比正常个体高,瘦素可以使野生型鼠体重下降12%,体脂降低11.5%,表明瘦素对野生型鼠具有调节其体内脂肪储存的作用,但体重减轻的幅度较肥胖鼠低[16].高山姬鼠血清瘦素含量季节性变化的研究结果显示,血清瘦素含量与体重、身体脂肪重量均呈正相关关系,而与摄入能、UCP1含量负相关,表明瘦素可能作为一种脂肪信号参与高山姬鼠能量代谢的调节[17].
目前,瘦素调节能量稳态的研究主要集中在瘦素抵抗的分子机制[6-7].如人类在病理条件下(如肥胖)的瘦素抵抗分子机制[18-19].研究也发现许多动物在妊娠或季节性变化条件下,其瘦素水平明显上升,而动物的摄食量和体重没有下降,表明机体可能对瘦素不敏感,即产生了leptin resistance[20-21].这可能是动物应对繁殖需要和季节性环境变化的能量代价增加,通过增加摄入能,改变体重调节点使体重高于“缺失值”水平,从而满足繁殖期和温度及光照变化下增加的能量需求.对小型哺乳动物的病理性研究也发现,动物在食物诱导条件下也存在leptin resistance.例如:大鼠在长期食物诱导条件下,瘦素水平增加,其食欲的增强没有被抑制,即出现leptin resistance[8,22].本研究中,高山姬鼠在3个月的充足喂食条件下,15只高山姬鼠中有7只(肥胖组)出现过度肥胖,体重达到(50.58±2.00) g,极显著地高于其他8只(正常组).然而肥胖组高山姬鼠血清瘦素浓度显著高于正常组,其摄食量和体重并没有下降,并且血清瘦素浓度与摄入能呈现极显著的正相关关系,表明了高山姬鼠在长期的充足食物诱导条件下,存在瘦素抵抗.然而高山姬鼠的瘦素抵抗的确切机制尚不清楚,有待进一步深入研究.
参 考 文 献:
[1] ZHANG Y,PROENCA R,MAFFEI M,et al.Positional cloning of the mouse obese gene and it's human homologue[J].Nature,1994,372(6505):425-432.
[2] FRIEDMAN J M,HALAAS J L.Leptin and the regulation of body weight in mammal[J].Nature,1998,395(6704):763-770.
[3] 李卉,姜一农.代谢综合征患者的血清瘦素[J].高血压杂志,2006,14(1):28-32.
[4] DENVER R J,BONETT R M,BOORSE G C.Evolution of leptin structure and function[J].Neuroendocrinology,2011 (94):21-38.
[5] COLEMAN D L.A historical perspective on leptin[J].Nat Med,2010,16(10):1097-1099.
[6] MYERS M G,COWLEY M A,MÜNZBERG H.Mechanisms of leptin action and leptin resistance[J].Annu Rev Physiol,2008 (70):537-556.
[7] TUPS A.Physiological models of leptin resistance[J].Journal of Neuroendocrinology,2009,21(11):961-971.
[8] 刘荣,孙长颢,李颖,等.饮食诱导肥胖抵抗和肥胖大鼠血中激素水平的比较[J].卫生研究,2003,32(3):212-214.
[9] 杨春壮,马英,徐永良,等.针刺对单纯性肥胖大鼠血清瘦素含量和下丘脑瘦素受体表达的影响[J].针刺研究,2007,32(6):384-388.
[10]黄文几,陈延熹,温业新.中国啮齿类[M].上海:复旦大学出版社,1995.
[11]ROSENMAN M,MORRISON P.Maximum oxygen consumption and heat loss facilitation in small homeotherms by He-O2[J].Am.J.Physiol,1974,226(3):490-495.
[12]KENNEDY G C.The role of depot fat in the hypothalamic control of food intake in the rat[J].Proc R Soc Lond B:Biol Sci,1953,140(901):578-596.
[13]WOZNIAK S E,GEE L L,WACHTEL M S,et al.Adipose tissue:the new endocrine organ? a review article[J].Digestive Diseases and Sciences,2009,54(9):1874-1856.
[14]CAMPFIELD L A,SMOTH F J,GUISEZ Y,et al.Burn P.Recombinant mouse OB protein:evidence for a peripheral signal linking adiposity and central neural networks[J].Science,1995,269(5223):546-549.
[15]MAFFEI M,HALAAS J,RAVUSSIN E,et al.Leptin levels in human and rodent: measurement of plasma leptin and ob RNA in obese and weight-reduced subjects[J].Nat Med,1995,1(11):1155-1161.
[16]HALAAS J L,GAJIWALA K S,MAFFEI M,et al.Weight-reducing effects of the plasma protein encoded by the obese gene[J].Science,1995,269(5223):543-546.
[17]ZHU W L,YANG S C,ZHANG LIN,et al.Seasonal variations of body mass,thermogenesis and digestive tract morphology inApodemuschevrieriin Hengduan mountain region[J].Animal Biology,2012,62(4):463-478.
[18]杨盛昌,单振光,黄春梅,等.大绒鼠冷驯化和脱冷驯化能量代谢特征的变化[J].动物学杂志,2012,47(2):120-126.
[19]ROTH J D,ROLAND B L,COLE R L,et al.Leptin responsiveness restored by amylin agonism in diet-induced obesity: evidence from nonclinical and clinical studies[J].Proc Natl Acad Sci USA,2008,105(20):7257-7262.
[20]MANTZOROS C,FLIER J S,LESEM M D,et al.Cerebrospinal fluid leptin in anorexia nervosa: correlation with nutritional status and potential role in resistance to weight gain[J].J Clin Endocrinol Metab,1997,82(6):1845-1851.
[21]杨盛昌,王政昆,杨晓楠,等.瘦素抵抗在妊娠期大绒鼠体重调节中的作用[J].云南师范大学学报:自然科学版,2013,33(5):59-63.
[22]刘莉,刘亚莉,任亚浩,等.饮食诱导肥胖大鼠脂肪细胞对瘦素反应影响[J].中国公共卫生,2012,28(5):625-626.

