125I粒子植入及动脉灌注吉西他滨+奥沙利铂治疗肝癌TACE术后残存病灶的临床研究
伦俊杰 孙建业 殷好治 胡效坤
125I粒子植入及动脉灌注吉西他滨+奥沙利铂治疗肝癌TACE术后残存病灶的临床研究
伦俊杰 孙建业 殷好治 胡效坤
目的 探讨125I放射性粒子植入及肝动脉灌注化疗治疗肝癌TACE术后残存病灶的临床价值。方法 选取2008年1月~2012年1月总共63例肝癌行TACE治疗后残留病灶的患者纳入研究。随机分成2组:33例行125I放射性粒子植入治疗,为A组,30例行肝动脉灌注吉西他滨+奥沙利铂治疗,为B组。分别评价2组患者的临床疗效及毒副反应。结果125I放射性粒子植入治疗33例患者,总有效率81.8%(27/33),中位生存期18.5个月。肝动脉灌注吉西他滨+奥沙利铂治疗30例,总有效率44.33%(13/30),中位生存期13个月。125I放射性粒子植入组有效率及中位生存期明显高于吉西他滨+奥沙利铂组,差异有统计学意义(P<0.05)。结论125I放射性粒子植入治疗肝癌TACE术后残存病灶是一种安全、有效的治疗方法。
肝癌;残存病灶;碘放射性核素;吉西他滨;奥沙利铂
Hepatocellular carcinoma; Residual lesions;125I radioactive particles; Oxaliplatin; Gemcitabine
肝细胞癌(hepatocelluar carcinoma,HCC)是我国最常见的恶性肿瘤之一,肝动脉化疗栓塞术(transcatheter arterial chemoembolization,TACE)目前为不能外科手术切除肝癌的首选方法[1]。但TACE术后肿瘤完全坏死率仅22%~29%[2]。TACE术后残存病灶一直是临床治疗难点。125I放射性粒子近距离治疗恶性肿瘤是一种新的局部放疗手段,对多种恶性肿瘤具有良好的疗效[3]。肝动脉灌注奥沙利铂+吉西他滨治疗肝癌,局部药物浓度高,疗效显著[4]。本研究回顾性分析125I放射性粒子及肝动脉灌注奥沙利铂+吉西他滨治疗肝癌TACE术后残存病灶的疗效,为肝癌的综合治疗提供依据。
1 资料与方法
1.1 一般资料 选取2008年1月~2012年1月在昌乐县人民医院住院的中晚期肝癌患者63例,45例经病理确诊,18例结合患者病史、体征、AFP及影像学检查作出临床诊断。63例患者共接受120次TACE治疗,平均每例患者1.9次,其中23例行强化CT检查,25例行强化MRI检查,5例行PET-CT检查,10例行DSA检查确定肿瘤残存。根据住院号单、双数随机分2组,33例行125I粒子治疗,为A组;其中男27例,女6例,平均年龄(58±7)岁;肿块平均直径(3.6±0.5)cm;甲胎蛋白阳性(>20 ng/L)29例;Child-Push分级A级26例,B级7例。30例行肝动脉灌注奥沙利铂+吉西他滨治疗,为B组,其中男25例,女5例;平均年龄(56±8)岁;肿块平均直径(3.8±0.6)cm;甲胎蛋白阳性(>20 ng/L)25例;Child-Pugh分级A级23例,B级7例。2组一般资料差异无统计学意义,具有可比性(见表1)。
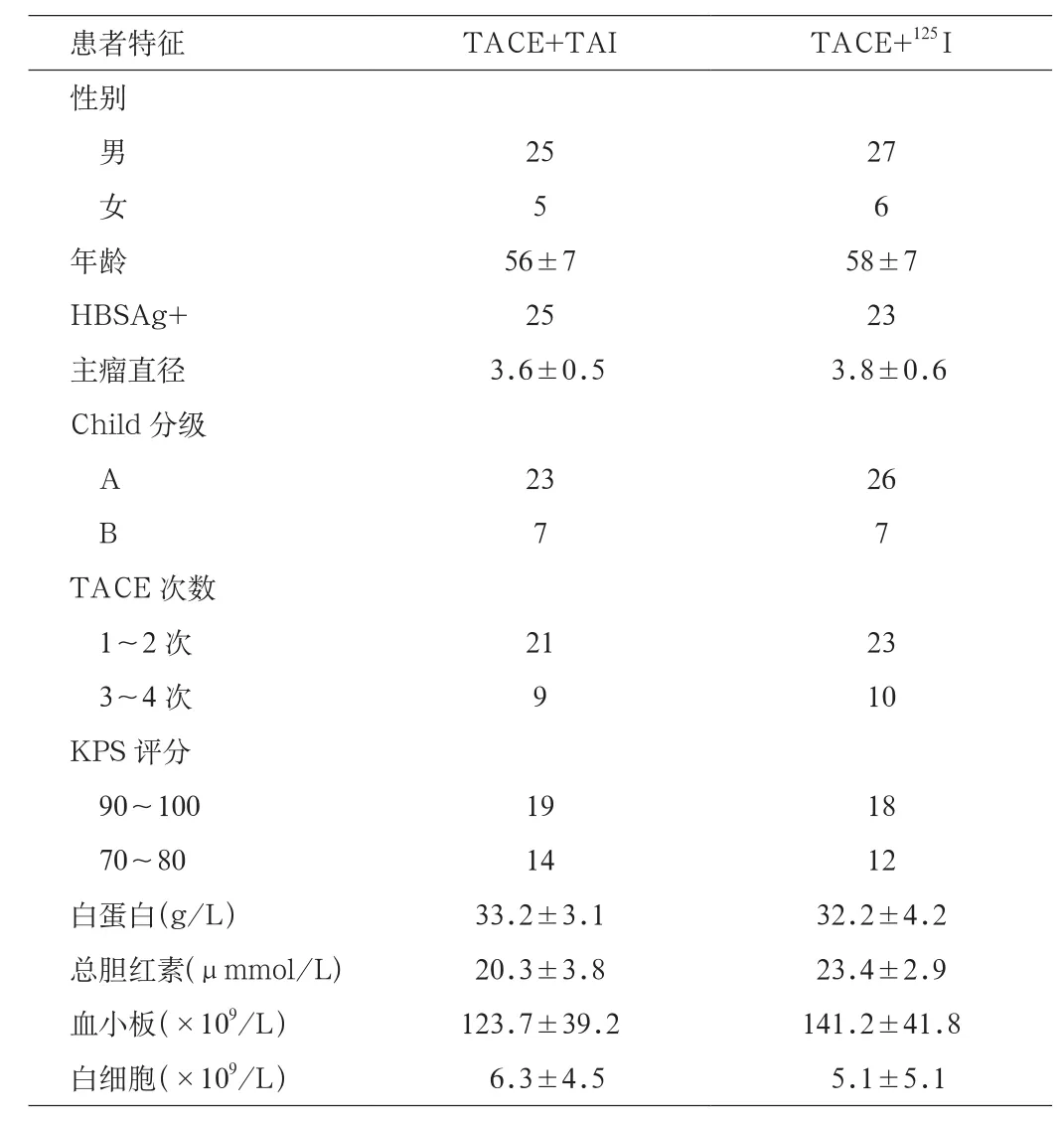
表1 2组一般临床资料比较
1.2 仪器、设备与方法
1.2.1 所用仪器、设备、药品 (1)西门子64层螺旋CT、Siemens公司3.0 T磁共振、GE Disxovery ST 16 PETCT、岛津公司DSA。(2)TPS(Treatment Planning System)治疗计划系统:北京飞天兆业医疗设备有限公司。(3)125I粒子:北京智博有限公司制造。规格:直径0.8 mm,长4.5 mm,圆柱形,钛合金外壳,半衰期T1/2=59.43 d,放射活度为18.5~37.0 MBq,有效作用半径17 mm,125I粒子的平均能量为27~35 Kev。(4)125I粒子:转盘式植入枪。(5)奥沙利铂:江苏恒瑞制药有限公司,商品名:艾恒,50 mg/支;吉西他滨:江苏豪森药业股份有限公司,商品名:泽菲,0.2 g/支。
1.2.2 肝动脉化疗方法 30例明确肿瘤残存患者,采用改良Seldinger技术穿刺股动脉,插管肝动脉成功后注入对比剂,瘤体不能染色或无明显供应瘤体血管,后退导管至腹腔动脉处,灌入奥沙利铂100 mg/m2+吉西他滨1000 mg/m2,灌注持续时间20~30 min,如见瘤体有染色或有供血动脉则注入超液化碘油与吉西他滨混合物,并灌注奥沙利铂,治疗后4周复查CT以确定是否继续治疗。
125I放射性粒子植入方法 采用CT定位。术前1~2 d行增强CT扫描,将图像传送到TPS系统。勾画等剂量曲线图和剂量体积直方图(dose volume histograms,DVH),形成三维空间分布计划,计算肿瘤与周围毗邻器官所受剂量及所需粒子总数,订购粒子以待手术。根据影像资料,明确肿瘤大小、形态、边界、位置。采用定位栅格贴于大致进针位置,选择进针点,用CT测量游标实时计划进针路线、深度及角度。定位后常规消毒、铺巾,利多卡因局麻。利用转盘式植入枪后退式植入粒子,穿刺针每后退0.5 ~1.0 cm植入一颗粒子,距肿瘤影像学边缘0.5 cm植入完成,如此反复直至达到术前制定计划。粒子植入后立即行CT检查,了解粒子分布情况,同时行术后TPS验证,对空间分布欠均匀者,立即行补充粒子植入。术后常规给予抗感染、止血及保肝治疗。术后24 h再次行上腹部CT检查,了解病灶情况。对乙肝处于活动期患者,常规给予拉米夫定抗病毒治疗。
1.2.3 疗效评估 按RESIST 1.0[8]版实体瘤疗效评价标准分为,完全缓解(CR):病灶完全消失并维持1个月;部分缓解(PR):病灶缩小>50%以上并维持四周以上;稳定(SD):病灶缩小<50%或增大未超过25%,无新发病灶出现;进展(PD):一处或多处病灶增大超过25%,或出现转移灶。有效率:(CR+PR)/总例数;疾病控制率:(CR+PR+PD)/总例数。A组疗效评价为植入后2月,B组疗效评价以最佳疗效为准。AFP下降率:AFP下降超过50%判定为下降。临床症状改善:术后临床症状减轻记为改善。复查时间为:治疗结束后2、4、6月,复查项目为平扫+增强CT,AFP,生化指标检测。
1.2.4 随访 所有纳入研究的病例均通过门诊或电话咨询随访,随访截止日期为2013年10月30日。对所有患者建立详细的档案,评价各组近期疗效。
1.2.5 不良反应评价 根据美国肿瘤放射治疗协会(Radiation Therapy Oncology Group,RTOG)推荐标准评价粒子植入后不良反应。观察介入治疗中及治疗后患者化疗药物不良反应,以NCI-CTC AE 3.0版评价毒副反应。奥沙利铂神经毒性采用Levi神经病变分级标准评判。
1.2.6 统计学方法 所有数据采用SPSS 13.0统计软件包处理,计量资料以“x±s”表示,计数资料以百分率表示。计数资料比较采用四格表χ2检验,当有两格理论频数<5时,用Fisher确切概率法,正态计量资料比较用t检验,生存分析采用寿命表法,以P<0.05为差异有统计学意义。
2 结果
2.1 治疗情况 63例患者均成功完成放射粒子及肝动脉灌注化疗手术。A组,植入粒子次数:1次15例;2次10例;3次5例;4次3例,共62例次。B组,注入对比剂后有14例患者见残留病灶染色,加用超液化碘化油栓塞治疗,量5~10 mL。治疗次数,2次13例;3次13例;4次4例,共81例次。A组125I放射性粒子植入后2月复查CT见病灶呈高密度粒子影,病情控制好,CR 10(30.3%)例(见图1),B组无CR病例,2组患者治疗有效率、疾病控制率、临床症状改善率和甲胎蛋白转阴率比较,差异均有统计学意义(均P<0.05)。中位生存期A组较B组长5.5个月,2组比较差异有统计学意义(P<0.05),A组1年生存率72.7%(24/33),B组1年生存率56.7%(17/30),术后1年生存率比较差异无统计学意义(见表2)。
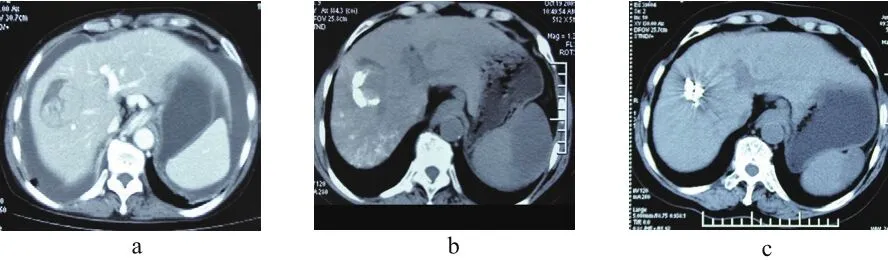
图1 图a治疗前病灶 图bTACE治疗后肿瘤残存 图c放射粒子治疗后2月病灶CR
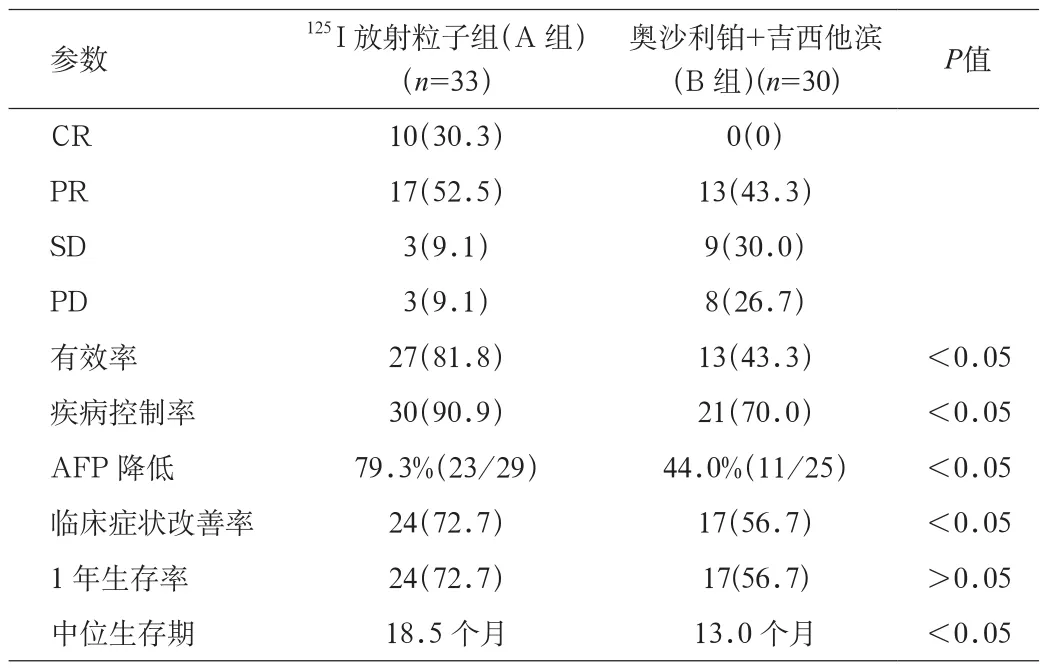
表1 2组随访结果
2.2 不良反应125I植入术后即刻行CT检查,5例患者见肝被膜下轻度血肿,术后8例患者诉右上腹疼痛,其中2例疼痛明显,予止痛对症处理可缓解,1例患者术后出现寒战高热,对症处理后缓解。2组均无穿刺点及瘤体出血、胆汁瘘等并发症发生,所有患者均未出现肝功恶化及造血系统功能障碍。奥沙利铂+吉西他滨组最常见的不良反应是骨髓毒性,发生3/4度的白细胞、中性粒细胞和血小板减少的分别为6、8和3例,发生重度贫血的有1例。5例患者出现神经毒性,其中1度的有2例,2度有3例。总共有4例患者出现轻度肝功能损害,为谷丙转氨酶和谷草转氨酶升高。发生严重不良反应1例,为中性粒细胞减少伴腹泻及发热,经抗感染、止泻支持治疗后痊愈,无化疗导致的死亡。
3 讨论
肝癌血供具有多样性和复杂性,TACE术后供血动脉大多仅主干闭塞,肝脏潜在的供血侧支,及来自门静脉的血供造成单纯TACE治疗效果差,远期疗效不理想,单纯TACE治疗后1~2个月残存肿瘤就可通过侧支循环再获得血供[5]。李培民等[6]对33例少血供型肝癌患者行TACE治疗,其1年的生存率为42%,2年的生存率为0%,生存率低主要与少血供肝癌单纯TACE术后肿瘤细胞完全坏死率低、异位血供的肿块栓塞不彻底、侧枝循环供血等因素有关[5]。因此,确定TACE后残存病灶的活性成为提高疗效的关键。TACE术后CT、MR、超声、PETCT等评价残存病灶各有优势。TACE治疗后1个月复查CT碘化油沉积不完全者,行全肝3期强化CT检查,对于残留病灶检出效果好,本组共23例,通过术中注入对比剂,全肝CT灌注成像能够对肝癌病灶提供比较高的时间和空间分辨力影像,但患者接受的射线量较高。MRI同样能较准确检测出残留病灶的活性, MRI表观扩散系数(ADC)图可反映活体组织的微观结构,水分子的扩散能够显示存活细胞与坏死细胞之间明显的信号差异,是肝癌TACE术后早期检测瘤体细胞活性较好的选择。选择最佳时机合理应用检查手段,可进一步提高TACE术后残留肝癌检出的敏感性和特异性,本组共25例,PET-CT费用高本组共5例,DSA为10例,但为有创检测,不作常规应用,明确判断肿瘤残存后,通过植入125I放射粒子,提高了生存率。
奥沙利铂(草酸铂,OXA)作为第三代铂类衍生物,其抗瘤活性强,抗瘤谱大。基础研究显示奥沙利铂对肝癌细胞株具有良好的抗肿瘤效果[7]。王少雷等[8]用奥沙利铂灌注化疗治疗肝癌,98例患者PR 42例(42.9%),SD 44例(44.9%)PD 12例(12.2),有效率42例(42.9%),疾病控制率86例(87.8%),中位疾病无进展时间9.2月,明显高于对照组吡喃阿霉素组。高嵩等[9]TACE联合奥沙利铂、氟尿嘧啶、亚叶酸钙肝动脉化疗治疗中晚期原发性肝癌,疗效显著。Louafi等[10]的一项以吉西他滨联合奥沙利铂全身化疗的Ⅱ期临床研究中,共34例晚期肝癌患者纳入研究,结果有效率达19%,稳定为58%,疾病控制率为76%,中位无进展生存期和总生存期分别为6.3个月和11.5个月。Azmy等[11]的一项二期临床试验,用吉西他滨+卡铂方案治疗进展期原发性肝癌,共40例病例,总有效率为23%,疾病控制率为69%,中位无瘤生存期5个月,总生存期达到8个月。本研究显示灌注吉西他滨+奥沙利铂组肿瘤完全缓解0例(0%),部分缓解13(43.33%),稳定9(30.00%),进展8(26.67%),总有效率13(43.33%),疾病控制率21(70%),甲胎蛋白降低或转阴率为44.0%(11/25),临床症状改善率56.6%(17/30)。术后1年生存率56.7%(17/30),中位生存期13.0月,虽低于125I放射性粒子组,仍显示了在肝癌TACE术后残存病灶治疗中的作用。
125I放射性粒子植入,是将125I粒子微型放射源植入肿瘤内或肿瘤浸润组织,125I放射性粒子通过持续发出低能量γ射线和X射线,对肿瘤进行杀伤。125I内照射可使肿瘤细胞生长缓慢、凋亡增加,随放射活度的增加,放射线可直接破坏细胞DNA双键,并激活相关细胞凋亡基因,诱导细胞程序性死亡,并且125I粒子可提高肿瘤患者的机体的免疫功能,进一步提高抗肿瘤效果[12]。TACE联合放射性粒子植入治疗肝癌已经取得了良好的治疗效果[13],通过本组病例总结,CT可准确显示病灶的大小、外形、位置、病灶内的坏死空腔区以及与血管等周围结构的解剖关系,有利于125I粒子植入计划的顺利实施。本组患者TACE术后复查因肿瘤缺乏血供而碘化油沉积不佳5例,碘化油沉积有缺损区18例。对于多次TACE术后残存病灶,再次行单纯TACE治疗效果欠佳,125I放射性粒子植入是较好的选择。
通过对比分析,125I放射性粒子组在总有效率、疾病控制率、甲胎蛋白转阴率、临床症状改善率方面较奥沙利铂+吉西他滨组高,2组差异有统计学意义,术后1年生存率及不良反生存率方面2组无统计学意义,但中位生存期125I组较灌注化疗组高,2组比较差异有统计学意义。近期疗效及中位生存期仍提示125I治疗方法在TACE术后残存病灶治疗中显示出更好的治疗效果,通过2组病例对照研究认为,对于单发富血供病灶,或病灶多于3个的富血供结节病灶,应首选TACE,1~4个疗程后复查,如果无存活瘤组织,3个月后定期复查,如果患者碘油聚集不完整,有存活瘤体组织,就施行125I放射性粒子植入。特别是对有明确的结节,病灶不大于5cm,数目少于3个,而且远离肝门、胆囊、胃肠道和横膈等重要结构,残留病灶形态极不规则,或者有门脉癌栓形成,可选择放射性粒子植入。
总之,CT引导下125I粒子植入治疗肝癌TACE术后残存病灶近期疗效好,并发症少,不良反应低,是一种安全、有效的治疗方法。TACE术后序贯125I粒子植入,明显提高了肝癌的局部控制率,是单纯TACE疗效不佳者的理想选择。
参考资料
[1] 吴孟超,陈汉,沈锋,等.微创在肝癌外科治疗中的地位[J].中国微创外科杂志[J],2002,2(2):69-70.
[2] Llovet JM,Bruix J.Novel advancements in the management of patocellular carcinoma in 2008[J].J Hepatol,2008,48 Suppl 1:S 20-37.
[3] 欧阳育树,杨志刚,吴万垠,等.影像引导125I放射性粒子植入治疗恶性肿瘤的临床疗效观察[J].当代医学,2012,8(24):5-7.
[4] 闫赵斌,马亦龙,欧盛秋,等.吉西他滨联合奥沙利铂经TACE治疗中晚期肝癌的临床观察[J].广西医科大学学报,2013,30(2):266-268.
[5] 张根山,周胜利,曹刚,等.CT引导下125I粒子植入在原发性肝癌TACE后残余病灶治疗中的临床应用[J].中国现代医学杂志,2013, 23(4):71-74.
[6] 李培民.血供对原发性肝癌介人治疗预后影响的研究[J].长治医学院学报,2010,24(2):130-131.
[7] Wang Z,Zhou J,Fan J,et al.Oxaliplatin induces apoptosis in hepatocellular carcinoma cells and inhibits tumor growth[J].Exp Opin Investig Drugs,2009,18(11):1595-1604.
[8] 王少雷,李森,魏宏,等.奥沙利铂与吡喃阿霉素介入治疗原发性肝癌的比较研究[J].介入放射学杂志,2012,21(9):738-742.
[9] 高嵩,朱旭,杨仁杰,等.TACE联合奥沙利铂、氟尿嘧啶、亚叶酸钙肝动脉化疗治疗中晚期原发性肝癌[J].介入放射学杂志,2012, 21(5):377-383.
[10] Louafi S,Boige V,Ducreux M,et al.Gemcitabine plus oxaliplatin(GEMOX) in patients with advanced hepatocellular carcinoma(HCC):results of a phase 2 study[J].Cancer,2007,109(7):1384-1390.
[11] Azmy AN,Nasr KE,Gobran NS,et al.Gemcita-bine Plus Carboplatin in Patients with Advanced Hepatocellular Carcinoma:Results of a phase 2 study[J].ISRN Oncology,2012,420931.
[12] 李彦,王超,李晓刚,等.125I粒子体外照射诱导结肠癌细胞凋亡及对表皮生长因子受体表达的影响[J].中华实验外科杂志,2012, 29(1):102.
[13] 向国安,陈开运,王汉宁,等.肝癌切除术后肝断面125I粒子植人对机体免疫的影响[J].南方医科大学学报,2011,30(2):292-294.
10.3969/j.issn.1009-4393.2014.24.004
山东 262400 山东省昌乐县人民医院肿瘤科 (伦俊杰 孙建业 殷好治) 266011 青岛大学附属医院介入医学中心 (胡效坤)
[Abjective] Objective To evaluate the clinical efficacy of125I seeds implantation and transarterial infusion in the treatment of residual hepatocellular carcinoma after transcatheter arterial chemocebolization. Methods From January 2008 to January 2012. Retrospectively analyzed clinical datas of 63 patients were randomly divided into two groups. 33 cases were treated with125I seeds (group A), 30 cases were treated with gemcitabine and oxaliplatin (group B). The eff i cacy and toxicity in the two groups were evaluated. Results In125I seeds group the total effcetive rate was 81.8%(27/33),the median survival times was 18.5 months. In gemcitabine and oxaliplatin group the total effcetive rate was 43.33%(13/30), the median survival times was 13 months. The total effcetive rate and median survival in125I seeds group were signif i cantly higher and longer than those in gemcitabine and oxaliplatin group (P<0.05). Conclusion It is safe and effective that radioactive seeds125I was used for implantation in treating residual hepatocellular carcinoma after TACE.

