高尿酸血症合并非酒精性脂肪性肝病患者颈动脉内膜中层厚度与脂联素的关系
田 峰 郑志刚 郑仲萍 郭杏花 郭 锋
广东省深圳市盐田区盐港医院内科,广东 深圳 518083
高尿酸血症(hyperuricemia,HUA)常与高血压、高脂血症、2 型糖尿病(type 2 diabetes mellitus,T2DM)、肥胖、胰岛素抵抗(insulin resistance,IR)等代谢性心血管危险因素伴发,使人群心血管疾病的患病风险大为增加。非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)作为一种除外酒精和其他明确因素所致的以弥漫性肝细胞大泡性脂肪变为主要特征的肝脏病变,其发病机制与IR为基础的代谢综合征(metabolism system,MS)各相关成分关系密切[1]。近年来,随着人们饮食结构的改变,NAFLD作为MS的肝脏表现已成为我国常见的慢性肝病之一。流行病学资料显示:中国成人NAFLD患病率为20%~33%,其中非酒精性脂肪肝炎 (NASH)和肝硬化分别占10%~20%和2%~3%;而高脂血症患者NAFLD患病率分别为28%~55%和27%~92%[2-3]。HUA及NAFLD二者同时存在对人群的心血管疾病风险是否较单纯HUA更为明显,目前临床缺乏相应研究。而脂联素(adiponectin,APN)作为脂肪细胞特异分泌的细胞因子,其基因位置位于染色体3q27,正是MS的易感基因所在区域。该基因的多态性不仅与MS的各种特征相关,而且与胰岛B细胞的功能有关[4]。在近年的研究中APN被证实:它是一种同时具有抗炎、增加胰岛素敏感性及心血管保护作用的脂肪细胞因子[5]。以颈动脉内膜中层厚度(CIMT)作为衡量动脉粥样硬化靶器官损害,已被公认为反映亚临床动脉硬化的客观指标[6],可作为评估大血管病变存在与否的早期指标。本研究旨在明确HUA及NAFLD对大血管病变的影响,并探讨其可能的机制。
1 资料与方法
1.1 一般资料
选择2011年1月~2012年12月在广东省深圳市盐田区盐港医院(以下简称“我院”)体检人群175例,作为本次研究的对象,实验分为以下三组:HUA合并NAFLD组(HUA+NAFLD组,60例),单纯 HUA组(HUA 组,60例),健康对照组(55例)。具体如下:高尿酸血症(HUA)诊断标准按2009年中国医师协会心血管内科医师分会《无症状高尿酸血症合并心血管疾病诊治建议专家共识》:正常嘌呤饮食状态下,非同日两次空腹血尿酸水平男性高于420 μmol/L(7 mg/dL),女性高于 357 μmol/L(6 mg/dL),即可诊断为 HUA。非酒精性脂肪肝病依据中华医学会肝脏病学分会脂肪肝和酒精性肝病学组在2006年制定的 《非酒精性脂肪肝诊断标准》[2]。凡具备下列第l~5项和第6或第7项中任何一项者即可诊断为NAFLD:①无饮酒史或饮酒折含乙醇量男性每周小于140 g,女性每周小于70 g;②除外病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性等可导致脂肪肝的特定疾病;③除原发疾病临床表现外,可有乏力、消化不良、肝区隐痛、肝脾肿大等非特异性症状及体征;④可有体重超重和(或)内脏性肥胖、空腹血糖增高、血脂紊乱、高血压等MS相关组分;⑤血清转氨酶和γ谷氨酰转肽酶水平可有轻至中度增高(小于5倍正常值上限),通常以谷丙转移酶(ALT)增高为主;⑥肝脏影像学表现符合弥漫性脂肪肝的影像学诊断标准;⑦肝活体组织检查组织学改变符合脂肪性肝病的病理学诊断标准。排除以下因素:有不稳定心绞痛,或曾有明确冠心病发作病史者;有慢性肾小球肾炎,和(或)肾功能不全者;检查前3 d连续进食高嘌呤食物,如:肉类、海鲜、动物内脏、浓肉汤等;检查前1 d,过量饮酒(啤酒、白酒)及剧烈体育锻炼者;近期连续服用普萘洛尔、硝苯地平、噻嗪类利尿剂、复方降压片、小剂量阿司匹林、吡嗪酰胺片等影响尿酸排泄药物者;及有长期饮酒史或饮酒折含乙醇量男性每周≥140 g,女性每周≥70 g;病毒性肝炎、药物性肝病、全胃肠外营养、肝豆状核变性等,可导致脂肪肝的特定疾病;严重的心衰、肾衰、感染、发热、糖尿病急性并发症;肝功能指标≥正常上限的2倍。HUA合并NAFLD组患者60例,其中男31例,女29例,平均年龄(58.5±7.6)岁。单纯HUA组患者60例,其中男33例,女17例,平均年龄(56.4±8.4)岁。诊断符合上述《无症状高尿酸血症合并心血管疾病诊治建议专家共识》中诊断标准。以同期来我院接受体检的55例健康者,其中男 32 例,女 23 例,平均(54.3±6.5)岁,为对照组;以上研究通过医院伦理委员会同意,所有研究对象均签署知情同意书。
1.2 方法
1.2.1 资料收集 本次研究的175例对象,在接受本院检查或者是入院时均进行了身高、体重和血压测定,血压由专人、专血压器测量,取坐位测量的3次收缩压(SBP)和舒张压(DBP)的均值。所有受试者均禁食8 h,次晨空腹采静脉血检测血浆脂联素(APN)、C反应蛋白(CRP)、空腹血糖(FPG)、空腹胰岛素(Fins)、三酰甘油(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、总胆固醇(TC)等指标。计算体重指数 (body mass index,BMI)。胰岛素抵抗指数(HOMA-IR)计算公式:HOMA-IR=FPG×Fins/22.5。
1.2.2 脂联素水平的测定 脂联素采用ELISA测定(试剂盒由上海沪尚公司提供),板内变异系数<10%,板间变异系数<15%。
1.2.3 颈动脉血管多普勒彩超检查 由专人操作,应用德国SIEMENS多功能彩超诊断仪。探头频率为7.5~11.0 MHz,分别测量左颈动脉、右颈总动脉远端分叉1 cm处、颈内动脉起始端、颈动脉窦部3个点的内膜中层厚度(IMT)。两侧共6点值,然后取平均值。因后壁显示最清晰,故以后壁IMT为标准。
1.2.4 B超诊断脂肪肝 具体标准为,肝区近场弥漫性高回声,回声强度高于脾脏和肾脏,少数表现为灶性高回声;远场回声衰弱,光点稀疏;肝内管道结构显示不清;肝脏轻度或中度肿大,肝前缘变钝(由专人操作)。1.2.5其他研究指标 腰臀围测量方法为:受试者直立,两脚分开30~40 cm,用一根没有弹性、最小刻度为1 mm的软尺放在右侧腋中线胯骨上缘与第十二肋骨下缘连线的中点(通常是腰部的天然最窄部位),沿水平方向围绕腹部1周,紧贴而不压迫皮肤,在正常呼气末测量腰围的长度;臀围测量是臀部的最宽处。计算腰臀比值(WHR),WHR=腰围/臀围。
1.3 统计学方法
采用SPSS 13.0统计软件包对数据进行统计学分析。非正态分布数据经对数转换为正态分布,计量资料符合正态分布资料以均数±标准差()表示,多组间比较采用方差分析,两两比较采用LSD-t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 三组临床资料比较
三组间性别、年龄、舒张压等比较,差异无统计学意义(P>0.05),具有可比性。见表1。

表1 三组临床资料比较
2.2 三组其他临床指标情况比较
HUA+NAFLD组及 HUA组收缩压、BMI、WHR、HOMA-IR、C反应蛋白(CRP)等指标,与对照组比较差异有统计学意义(P<0.05)。其中,BMI及CRP指标,HUA+NAFLD组与对照组比较差异有高度统计学意义(P< 0.01)。见表 2。
2.3 三组血脂情况比较
与对照组比较,HUA+NAFLD组与HUA组的TG、TC、LDL-C升高,HDL-C降低,组间比较差异有统计学意义(P<0.05)。其中,NAFLD组与HUA组相比,TG 升高差异有统计学意义(P<0.05),TC、LDL-C、HDL-C之间差异无统计学意义(P>0.05)。见表3。
表2 三组其他临床指标情况比较()
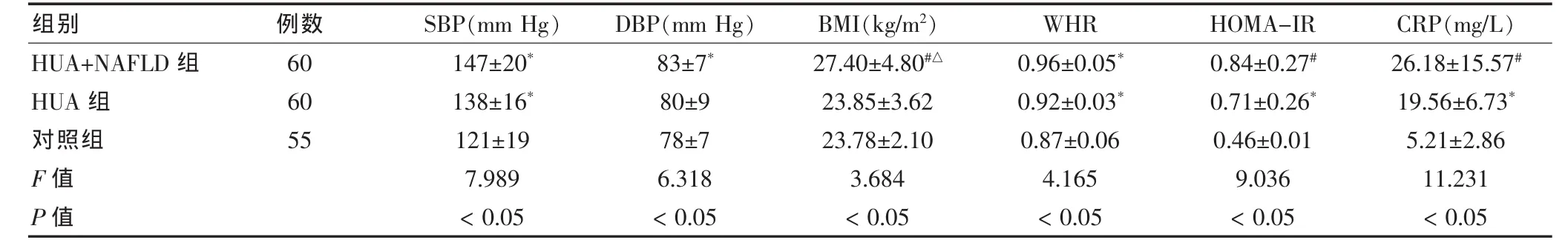
表2 三组其他临床指标情况比较()
注:与对照组比较,*P<0.05,#P<0.01;与 HUA 组比较,△P<0.05;SBP:收缩压;BMI:体重指数;WHR:腰臀比;HOMA-IR:胰岛素抵抗指数;CRP:C 反应蛋白;1 mm Hg=0.133 kPa
组别 例数SBP(mm Hg) DBP(mm Hg) BMI(kg/m2) WHR HOMA-IR CRP(mg/L)HUA+NAFLD组HUA组对照组F值P值606055147±20*138±16*121±197.989<0.0583±7*80±978±76.318<0.0527.40±4.80#△23.85±3.6223.78±2.103.684<0.050.96±0.05*0.92±0.03*0.87±0.064.165<0.050.84±0.27#0.71±0.26*0.46±0.019.036<0.0526.18±15.57#19.56±6.73*5.21±2.8611.231<0.05
表3 三组血脂情况比较()
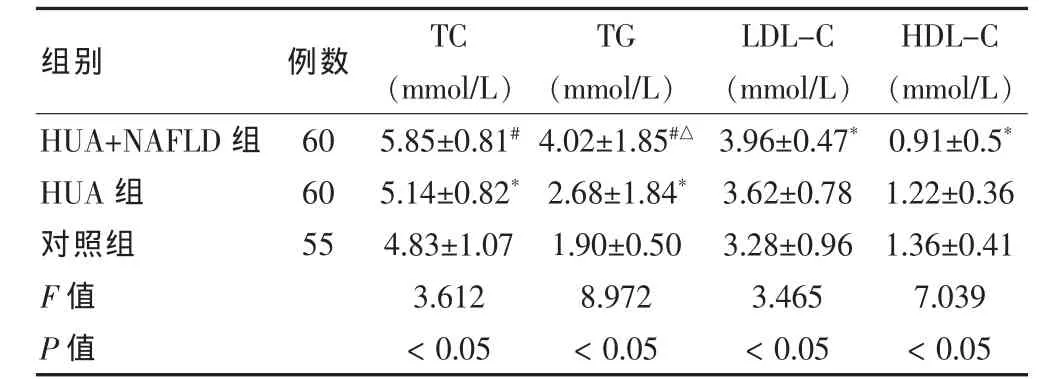
表3 三组血脂情况比较()
注:与对照组比较,*P<0.05,#P<0.01;与 HUA 组比较,△P<0.05;TC:总胆固醇;TG:三酰甘油;LDL-C:低密度脂蛋白胆固醇;HDL-C:高密度脂蛋白胆固醇
组别 例数TC(mmol/L)TG(mmol/L)LDL-C(mmol/L)HDL-C(mmol/L)HUA+NAFLD组HUA组对照组F值P值6060555.85±0.81#5.14±0.82*4.83±1.073.612<0.054.02±1.85#△2.68±1.84*1.90±0.508.972<0.053.96±0.47*3.62±0.783.28±0.963.465<0.050.91±0.5*1.22±0.361.36±0.417.039<0.05
2.4 三组APN、CIMT比较
颈动脉内膜中层厚度 (CIMT)比较结果显示:HUA+NAFLD组与HUA组中CIMT,较对照组明显升高,差异有统计学意义(P<0.05或P<0.01)。APN比较结果显示:与对照组相比,APN在HUA+NAFLD组及 HUA 组中下降(P<0.05),其中,HUA+NAFLD组下降尤为明显(P<0.01)。见表4。
表4 三组 APN、CIMT 比较()
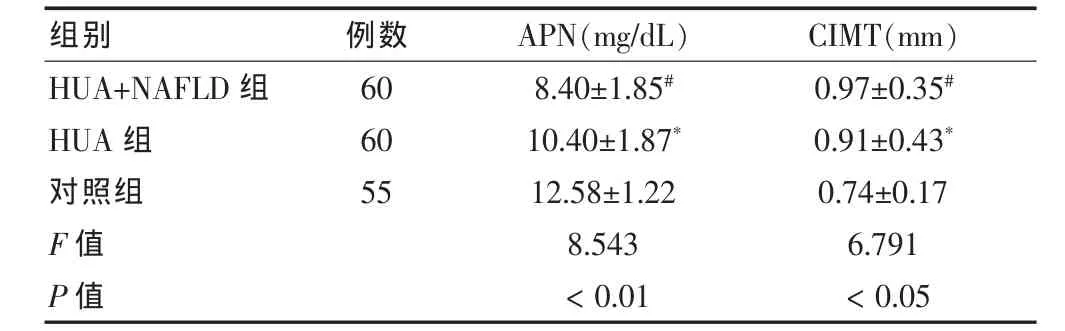
表4 三组 APN、CIMT 比较()
注:与对照组比较,*P<0.05,#P<0.01;APN:脂联素;CIMT:颈动脉内膜中层厚度
组别 例数APN(mg/dL) CIMT(mm)HUA+NAFLD组HUA组对照组F值P值6060558.40±1.85#10.40±1.87*12.58±1.228.543<0.010.97±0.35#0.91±0.43*0.74±0.176.791<0.05
2.5 C-IMT与APN、CRP等指标的相关性分析
对HUA+NAFLD组及HUA组中CIMT、CRP、APN分别进行年龄、血压、血脂、BMI、WHR、HOMA-IR、尿酸(UA)等直线相关性分析,结果显示:CRP和C-IMT、腰围、腰臀比、TG、HOMA-IR呈正相关(P<0.05或P<0.01),与 APN 水平呈负相关(P<0.01),CIMT 与SBP、WHR、BMI、HOMA-IR、血脂、CRP、UA 等指标呈正相关(P<0.05或 P<0.01),与APN 呈负相关(P<0.05)。APN 与腰臀比、HOMA-IR、CRP、C-IMT、UA 呈负相关 (P<0.05或P<0.01),与HDL-C呈正相关(P<0.05);与其他的因素均没有相关性(P>0.05)。详见表 5~7。
3 讨论
研究表明:在高尿酸血症人群中,存在许多传统的心血管危险因素,包括肥胖、糖尿病、高甘油三酯血症、高血压等[7]。一项覆盖1600人的横断面调查中显示:在有代谢性危险因素的中国人群中,男性、女性的HUA患病率分别为20.58%和30.55%;而在HUA个体中,同时合并肥胖、糖尿病、血脂异常及高血压等3种以上代谢危险因素者,男、女比例分别高达76.92%和67.64%[8],其中,约80%的HUA患者合并高血压,合并超重或肥胖为50%~70%,高脂血症则为67%以上。HUA通过与经典危险因素的相互作用或独立作用,参与心血管疾病的发生、发展及转归。对高尿酸血症进行早期干预,可能会对心血管疾病的预防和治疗产生积极的影响。对5929例25~74岁研究对象平均随访16.4年的NHANESⅠ研究结果显示:1593例死亡中,无论是男性、女性、白人还是黑人,其血UA水平与心血管病病死率呈正相关,其中731例(45.9%)归因于心血管疾病;血尿酸每升高59.48 μmol/L,因缺血性心肌病死亡的心血管病危险比率男性为1.09,女性为1.26[9]。本研究观察到:与正常人群相比,无论是否存在NAFLD情况,HUA个体的CIMT均有明显增加(P<0.05)。进一步验证并提示:HUA个体存在更为明显的动脉粥样硬化趋势,CVD风险更为突出。这种风险与脂代谢异常、胰岛素抵抗、腹型肥胖及血压都有明显相关。

表5 C反应蛋白与各变量之间相关性分析

表6 颈动脉内膜中层厚度与其他变量之间相关性分析

表7 脂联素与其他变量之间相关性分析
NAFLD是指以弥漫性肝细胞大泡性脂肪为主要特征的临床病理综合征,导致NAFLD的原因不包括酒精和其他明确病毒感染等因素。作为非感染性因素所致的慢性肝脏疾病,NAFLD目前被认为是MS在肝脏的表现。根据病理和临床表型情况,非酒精性脂肪肝病的类型可以分为单纯性脂肪肝 (SFL)、NASH和NASH相关性肝硬化。目前,关于非酒精性脂肪肝病的发病原因学术界没有统一的说法。关于其发病机制的“二次打击”学说,被学术界广泛接受。其中,第1次打击主要是由于IR引起的TG沉积;第2次打击主要是由于氧化应激,导致炎症的发生[10]。NAFLD患者均有不同程度的IR,使得TG过度沉积,同时合并糖原合成异常,造成内脏,尤其是肝脏内细胞TG异常堆积。存在HUA等代谢危险因素的个体,因IR的病理机制,造成机体对胰岛素的生理效应不敏感,脂代谢途径异常并同时合并脂质过氧化,造成肝脏在IR情况下更易出现肝脏氧化应激损伤[11]。HUA等代谢综合征人群中的高胰岛素血症及内脏型肥胖,目很多学者认为:IR应该是NAFLD形成的一个独立危险因素,特别是:肝源性IR也被认为是NAFLD的发病关键因素[12]。IR使胰岛素抑制脂肪酶的活性下降,外周脂肪组织分解增多,游离脂肪酸(FFA)水解增高,大量的FFA更容易通过门静脉系统进入肝脏,使肝脏对FFA氧化和利用不足,从而脂化形成TG增加,而肝细胞内脂肪运出肝的能力受限,使肝细胞内脂肪堆积形成脂肪肝。NAFLD本身也加重IR。本研究结果同样显示出:HUA同时合并NAFLD的人群,其IR程度更为突出,中心性肥胖更为明显,以血压、血脂为临床表象的代谢异常也较正常人群及单纯HUA者更为典型。其颈动脉为代表的血管硬化及内膜增厚等血管损害表现也非常明显。
NASH增加心血管疾病的风险,已被证实与炎性物质及脂肪产生的激素相关[13]。脂肪组织产生的激素,特别是:APN有独立的心血管疾病相关性,并具有明确的抗炎,抗AS作用。在肥胖合并NAFLD患者中,APN水平比单纯肥胖者降低,提示APN除了可通过直接或间接的方法增加胰岛素的敏感性,促进肌肉对脂肪酸的摄取及代谢,降低肌肉、肝脏、循环血液中FFA及TG浓度,从而解除高脂血症所引起IR。同时,APN也直接作用于肝组织,抑制葡萄糖的生产和防止脂质堆积,并通过抑制单核细胞的前体细胞增殖及成熟巨噬细胞的功能而抑制TNF-α基因表达,最终对炎症反应起负调节作用,从而有助于血管受损部位内皮细胞的恢复,对心血管系统起间接保护作用[14]。近期研究中,APN水平降低与转氨酶和α-GT水平增加相关,提示:APN除了上述作用外,还可能在维持肝细胞功能完整性方面有不可或缺的功能。在本项研究中,APN在NAFLD组及HUA组中均较正常对照组明显下降(P<0.05),且直线回归分析显示:APN浓度变化与CIMT负相关,也进一步揭示:在HUA及NAFLD等代谢组分明显异常的个体中,APN的浓度降低参与、促进了这类患者的大血管病变进展过程。
总之,HUA合并 NAFLD流行病学形势严峻;与单纯性HUA比较,合并NAFLD的IR更为明显,大血管病变风险更为突出。因此,加强对HUA伴NAFLD患者脂肪肝的综合防治与早期检测CIMT、APN及CRP等非常重要。本研究结果表明:首先,HUA并非NAFLD者,CIMT明显高于正常对照组;提示相对于正常人群,这两类患者的心、脑血管并发症风险更为明显。另外,血脂代谢异常及中心性肥胖等代谢危险因素的存在与否,是NAFLD及HUA者存在心血管疾病发病率增加的重要相关介质。因此,通过本研究可以证明在HUA并NAFLD的患者中,心血管疾病风险更为增加。同时,本研究结果也进一步证实了,以前研究数据所表明的:NAFLD是MS在肝脏中的体现。更重要的是,通过此项研究结果显示:以超声检查评估NAFLD患者的影像学表现,与其颈动脉内膜厚度增加平行性良好,并与HUA及NAFLD组患者的临床MS表型吻合。因此,早期对HUA及NAFLD等CVD高危人群进行CIMT及超声检查,具有良好的临床实践推广价值。
[1]Angulo P.GI epidemiology:nonalcoholic fatty liver disease[J].Aliment Pharmacol Ther,2007,25:883-889.
[2]中华医学会肝脏病学分会脂肪肝和酒精性肝病学组.非酒精性脂肪性肝病诊疗指南[J].中华肝脏病杂志,2006,14(3):161-163.
[3]中华医学会肝病学分会脂肪肝和酒精性肝病学组.非酒精性脂肝性肝病诊疗指南(2010年修订版)[J].中华肝脏病杂志,2010,18(3):163-166.
[4]汪学军,姜志胜,黄佳克.2型糖尿病合并肥胖患者脂联素水平与胰岛素抵抗的相关性[J].中国动脉硬化杂志,2009,17(7):535-538.
[5]Tsubakio YK,Matsuura F,Koseki M,et al.Adiponectin prevents atherosclerosis by increasing cholesterol effiux from macrophages[J].Biochem Biophys Res Commun,2008,375(3):390-394.
[6]O′pLeary DH,Polak JK,Kronmal RA,et al.Carotid artery inter-media thickness as a risk factor for myocardial infarction and stroke in older adults[J].N Engl JM,1999,340(6):34-42.
[7]Nakanishi N,Okamoto M,Yoshida H,et al.Serum uric acidand risk for development of hypertension and impaired fasting glucose or type 2 diabetes in Japanese male office workers[J].Eur Epidemiol,2003,18:523-530.
[8]张立晶,胡大一,杨进刚,等.有心血管疾病危险因素人群中高尿酸血症的发生率及其相关因素[J].首都医科大学学报,2005,26(4):520-524.
[9]Fang J,Alderman MH.Serum uric acid and cardio vascularmortality:the NHANESⅠepidemiologic follow-upstudy,1971-1992[J].JAMA,2000,283:2404-2410.
[10]Leon A,Paul A,Keith D.Nonalcoholic fatty liver disease[J].CMAJ,2005,172(7):899-905.
[11]Targher G,Bertolini L.Prevalence of nonalcoholic fatty liver disease and its association with cardiovascular disease among type 2 diabetic patients [J].Diabet Care,2007,30:1212-1218.
[12]Angulo P,Alba LM,Petrovic LM.Leptin,insulin resistance,and liver fibrosis in human nonalcoholic fatty liver disease[J].Hepatol,2004,41:943-949.
[13]Scorletti E,Calder P,Byrne C.Non-alcoholic fatty liver disease and cardiovascular risk:metabolic aspects and novel treatments[J].Endocrine,2011,40:332-343.
[14]Musso R,Gambino,Durazzo M,et al.Adipokines in NASH:postprandial lipid metabolism as a link between adiponectin and liver disease[J].Hepatology,2005,42(200):1175-1183.

