干酪乳清酶解产物对小鼠抗氧化性的影响
霍建新,赵文博,白彩艳,赵征,*
(1.晋中学院,山西晋中030600;2.天津科技大学食品工程与生物技术学院,天津300457)
乳清蛋白的乳糖、脂肪和胆固醇含量低,具有较高的营养价值。乳清蛋白抗癌、增加骨密度、降低胆固醇含量。特别是干酪乳清在碱性蛋白酶的作用下,能产生具有抗氧化性活性肽[1-3]。抗氧化肽具有清除体内过剩的活性氧自由基,保护线粒体和细胞的正常结构与功能,抑制脂质过氧化[3]。因此,乳清蛋白的医疗保健作用日益受到注目,国内对干酪乳清酶解物的动物实验处于起步阶段。本研究探讨酶解产物对小鼠的血清与肝脏中超氧化物歧化酶、谷胱甘肽过氧化物酶和丙二醛的含量等抗氧化活性指标的影响。
1 材料与方法
1.1 干酪乳清酶解产物的制备
新鲜干酪乳清(天津科技大学干酪科学与工程研究室提供),经90℃,5 min的预处理后,在pH9.0、反应温度50℃、酶底物比0.04,分别加入Alcalase2.4 L碱性蛋白酶和木瓜蛋白酶水解2.0 h,得到两种干酪乳清酶解液,放于4℃冰箱备用。
1.2 动物与分组
昆明种小鼠100只(中国人民解放军军事医学科学院实验动物中心提供),体重(18 g~22 g)。随机分为5组,每组20只,雌雄各半。每笼10只喂养,喂指定饲料,自由进食、饮水,保持环境温度(20±1)℃,相对湿度(60±5)%。A组每天皮下注射生理盐水,其他组皮下注射50 mg/mL D-半乳糖,均在颈背部。实验期为45 d,建衰老模型。小鼠适应10 d后,开始样品的测试,A、B、C、D、E组分别灌胃生理盐水、生理盐水、乳清、木瓜蛋白酶解液、碱性蛋白酶解液。每天灌胃1次,剂量为0.3 mL,测试期为45 d。
1.3 小鼠的抗氧化活性指标的测量方法
试验末期:动物禁食12 h后称重,摘取眼球取血,在4℃,3 000 r/min条件下离心20 min,离心分离血清,-70℃贮藏备用;颈椎脱臼法处死,开胸迅速摘下肝脏,预冷的PBS灌洗,滤纸吸干,称重,-20℃冻藏待用。取肝0.3 g制备肝脏匀浆,生物组织匀浆机得到浓度为10%匀浆,在4℃,3 000 r/min条件下离心10 min,取上清液,现配现用。
1.3.1 小鼠肝脏与血清中超氧化物歧化酶(SOD)的测定
SOD活力测定用黄嘌呤氧化酶法。超氧阴离子自由基由黄嘌呤与黄嘌呤氧化酶反应系统产生,然后氧化羟胺形成亚硝酸盐,在显色剂的存在下,表现为紫红色,吸光度用可见分光光度计测定。当样品中存在SOD时,抑制超氧阴离子自由基的产生,减少亚硝酸盐形成,测定时样品管的吸光度值低于对照管的吸光度值,通过公式计算,样品中的SOD活力计算可得。采用试剂盒进行测定,SOD测定试剂盒购于南京建成生物工程研究所。
1.3.2 小鼠肝脏与血清中谷胱甘肽过氧化物酶(GSHPX)的测定
在谷胱甘肽过氧化酶(GSH-PX)的作用下,还原型谷胱甘肽(GSH)与过氧化氢(H2O2)反应生成氧化性谷胱甘肽(GSSG)和H2O。用谷胱甘肽过氧化物酶的活力用酶促反应的速度来表示,通过酶促反应中还原型谷胱甘肽的含量变化的测定,酶的活力可计算。
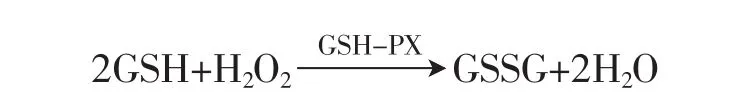
GSH-PX的活力用催化GSH的反应速度表示,由于GSH和H2O2在没有酶的作用下,也能进行氧化还原反应,称为非酶促反应,所以酶活力计算时必须扣除非酶促反应使的GSH减少的量。
GSH量的测定:GSH和二硫代二硝基苯甲酸反应生成5-硫代二硝基苯甲酸阴离子,此种物质表现为黄色,且稳定,然后在波长为412 nm处测其吸光度,GSH的量可得。采用试剂盒进行测定,GSH-PX测定试剂盒购于南京建成生物工程研究所。
1.3.3 小鼠肝脏与血清中丙二醛(MDA)的测定
过氧化脂质降解生成丙二醛,丙二醛(MDA)与硫代巴比妥酸(TBA)发生缩合反应,红色物质产生,此物质在波长为532 nm处有最大吸收峰。采用试剂盒进行测定,MDA测定试剂盒购于南京建成生物工程研究所。
1.4 数据处理
实验数据取平均值,以“平均值±标准差”表示。用SPSS 11.5软件进行方差分析和LSD多重比较。
2 结果与分析
2.1 干酪乳清酶解物对小鼠血清与肝脏中超氧化物歧化酶(SOD)的影响
干酪乳清酶解物对小鼠血清与肝脏中超氧化物歧化酶(SOD)的影响,见表1。
表1 干酪乳清酶解物对小鼠血清与肝脏中超氧化物歧化酶(SOD)的影响Table 1 Effects of whey hydrolysates on SOD in mice(±s,n=10)

表1 干酪乳清酶解物对小鼠血清与肝脏中超氧化物歧化酶(SOD)的影响Table 1 Effects of whey hydrolysates on SOD in mice(±s,n=10)
注:A)假衰老组;B)对照组;C)干酪乳清组;D)木瓜蛋白酶乳清水解液;E)碱性蛋白酶乳清水解液;同列数据相同字母上标表示差异不显著(P>5%)。
分组 肝脏SOD 血清SOD雌性 雄性 雌性 雄性A 74.53±44.84ab87.34±24.80a140.04±22.43a139.83±21.31ab B 55.96±40.18bc 20.90±7.06b 84.14±21.73b 113.43±50.25b C 15.91±5.54c 30.94±8.38b 150.73±9.62a 122.06±11.23ab D 109.52±7.06a 93.79±7.72a 146.00±4.01a 147.33±6.89ab E 94.18±1.43ab 83.48±5.77a 151.03±26.60a162.02±13.16a
木瓜蛋白酶水解干酪乳清组的雌性鼠和雄性鼠的肝脏中SOD含量与假衰老组无显著性差异(p>0.05),与对照组的含量有显著性差异(p<0.05),与乳清组也有显著性差异(p<0.05)。碱性蛋白酶水解干酪乳清组的雌性鼠和雄性鼠的肝脏中SOD含量与假衰老组无显著性差异(p>0.05),与对照组的雄性鼠有显著性差异(p<0.05),雌性鼠无显著性差异(p>0.05),与乳清组有显著性差异(p<0.05)。
木瓜蛋白酶组、碱性蛋白酶的雌性组血清中的SOD含量分别与对照组有显著性差异(p<0.05),与假衰老组与乳清组无显著性差异(p>0.05)。碱性蛋白酶雄性组与对照组有显著性差异,与其他组差异不显著。
因此,乳清的木瓜蛋白酶与碱性蛋白酶水解液可以提高小鼠肝脏和血清中的SOD的含量,与假衰老组相比,差异不显著。
2.2 干酪乳清酶解物对小鼠血清与肝脏中谷胱甘肽过氧化物酶(GSH-PX)的影响
干酪乳清酶解物对小鼠血清与肝脏中谷胱甘肽过氧化物酶(GSH-PX)的影响,见表2。
表2 干酪乳清酶解物对小鼠血清与肝脏中谷胱甘肽过氧化物酶(GSH-PX)的影响Table 2 Effects of whey hydrolysates on GSH-PX in mice(±s,n=10)

表2 干酪乳清酶解物对小鼠血清与肝脏中谷胱甘肽过氧化物酶(GSH-PX)的影响Table 2 Effects of whey hydrolysates on GSH-PX in mice(±s,n=10)
注:A)假衰老组;B)对照组;C)干酪乳清组;D)木瓜蛋白酶乳清水解液;E)碱性蛋白酶乳清水解液;同列数据相同字母上标表示差异不显著(P>5%)。
分组 肝脏GSH-PX 血清GSH-PX雌性 雄性 雌性 雄性A 94.60±14.87b227.69±65.99b124.96±30.82b110.93±9.15b B 96.22±69.86b202.86±59.22b 121.71±6.06b146.51±27.41b C 93.92±37.59b302.77±155.28b124.80±32.52b112.40±1.34b D 251.20±49.84a112.16±39.91b295.35±111.26ab358.14±71.60a E 248.19±67.31a909.42±573.28a516.28±247.75a365.89±75.94a
碱性蛋白酶组肝脏中的GSH-PX含量与假衰老组、对照组、乳清组有显著性差异(p<0.05),与木瓜酶雌性组无显著性差异(p>0.05)、雄性组有显著性差异(p<0.05)。碱性蛋白酶组血清中的GSH-PX含量与假衰老组、对照组、乳清组有显著性差异(p<0.05),与木瓜酶组差异性不显著(p>0.05)。
因此,乳清的碱性蛋白酶水解液可以提高小鼠肝脏和血清中的GSH-PX的含量,有显著性差异。
2.3 干酪乳清酶解物对小鼠血清与肝脏中丙二醛(MDA)的影响
干酪乳清酶解物对小鼠血清与肝脏中丙二醛(MDA)的影响,见表3。
表3 干酪乳清酶解物对小鼠血清与肝脏中丙二醛(MDA)的影响Table 3 Effects of whey hydrolysates on MDA in mice(±s,n=10)
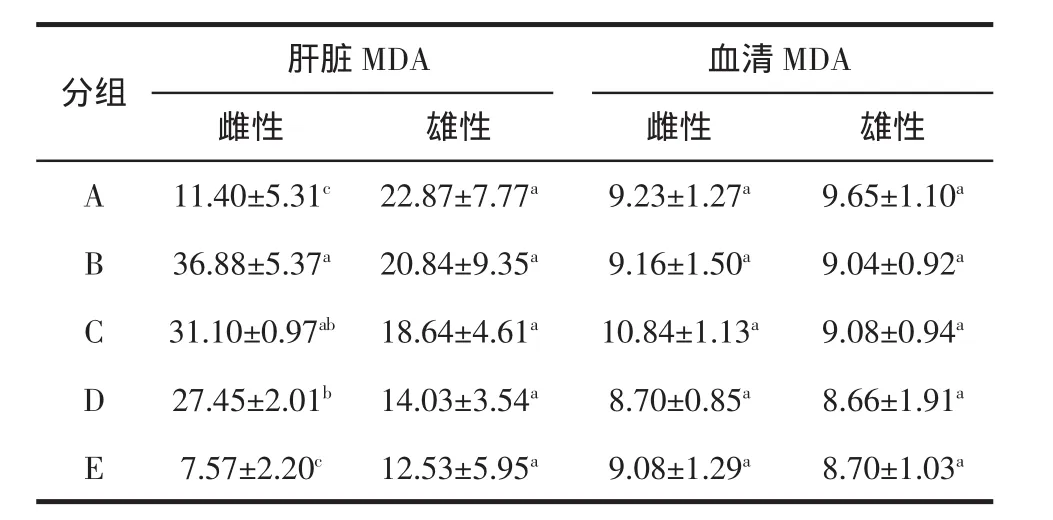
表3 干酪乳清酶解物对小鼠血清与肝脏中丙二醛(MDA)的影响Table 3 Effects of whey hydrolysates on MDA in mice(±s,n=10)
注:A)假衰老组;B)对照组;C)干酪乳清组;D)木瓜蛋白酶乳清水解液;E)碱性蛋白酶乳清水解液;同列数据相同字母上标表示差异不显著(P>5%)。
肝脏MDA 血清MDA分组雌性 雄性 雌性 雄性A 11.40±5.31c 22.87±7.77a 9.23±1.27a 9.65±1.10a B 36.88±5.37a 20.84±9.35a 9.16±1.50a 9.04±0.92a C 31.10±0.97ab 18.64±4.61a 10.84±1.13a 9.08±0.94a D 27.45±2.01b 14.03±3.54a 8.70±0.85a 8.66±1.91a E 7.57±2.20c 12.53±5.95a 9.08±1.29a 8.70±1.03a
碱性蛋白酶雌性组小鼠肝脏中的MDA含量与对照组、乳清组和木瓜酶组小鼠肝脏中的MDA含量都有显著性差异(p<0.05),与假衰老组小鼠肝脏中的MDA含量无显著性差异(p>0.05),而碱性蛋白酶解液小鼠雄性组肝脏中的MDA含量与其它组均无显著性差异(p>0.05)。碱性蛋白酶组血清中的MDA含量与其它组均无显著性差异(p>0.05)。因此,木瓜蛋白酶和碱性蛋白酶水解乳清的产物对雄性小鼠的肝脏和心清中的MDA含量无显著性影响。
3 讨论
GSH-PX的活力作为衡量机体抗氧化性水平的一项生化指标[4-5]。谷胱甘肽过氧化物酶(GSH-PX)是机体内广泛存在的催化过氧化氢分解一种重要的酶。还原型谷胱甘肽(GSH)对过氧化氢的还原反应需要GSH-PX催化,具有保护细胞膜结构、功能完整的作用。本实验干酪乳清酶解液对小鼠的肝脏和血清中的GSH-PX含量有显著的影响,它的抗氧化效果是由GSH-PX来调解的,但不能排除酶的种类和酶解条件的影响,应进行干酷乳清的酶解的优化研究。经90℃,5 min的预处理后,在pH9.0、反应温度50℃、酶底物比0.04,水解2.0 h,Alcalase2.4 L碱性蛋白酶和木瓜蛋白酶的水解度最高。另外,在测定小鼠抗氧化性的实验中,血清中三项指标在实验结束后测定,得到的数据不能准确反应样品的药物短期能力,所以,这个问题应该通过定期对小鼠血清测定,使用静脉埋管取血来克服。
SOD清除超氧阴离子自由基,保护细胞免受损伤,对机体的氧化与抗氧化平衡起着至关重要的作用[6-7]。MDA的量可反映机体内脂质过氧化的程度,细胞损伤的程度可间接的反映[8]。
MDA的测定常常与SOD的测定相互配合,SOD活力的高低反应了机体清除氧自由基的能力,而MDA含量的高低反应机体细胞受自由基攻击的严重程度,通过SOD活力与MDA含量的分析,有助于动物体内抗氧化性的研究。本实验使用木瓜蛋白酶和碱性蛋白酶Alaclase 2.4L,将干酪乳清中的酪蛋白、白蛋白分解产生具有较强抗氧化作用的多肽。本实验中木瓜蛋白酶与碱性蛋白酶水解乳清后的得到的产物可以提高小鼠肝脏和血清中的SOD的含量,与假衰老组的无显著性差异,可能是干酪乳清中含有较多蛋白肽,具有阻碍抗氧化的功能[5-7]。木瓜蛋白酶和碱性蛋白酶水解乳清的产物对雄性小鼠的肝脏和心清中的MDA含量无显著性影响,表明干酪乳清酶解液不能显著降低MDA含量,这一结果还需临床观察进一步验证。
4 结论
研究干酪乳清酶解液对小鼠抗氧化活性的影响。干酪乳清的木瓜蛋白酶和碱性蛋白酶水解液可以提高小鼠肝脏和血清中的SOD的含量,与假衰老组差异不显著。乳清的碱性蛋白酶水解产物提高小鼠肝脏和血清中的GSH-PX的含量,差异性显著。乳清的木瓜蛋白酶和碱性蛋白酶水解产物对雄性小鼠的肝脏和血清中MDA含量影响不著性。用干酪乳清酶解产物喂养小鼠,能明显增强抗氧化活性,效果明显优于乳清。
[1]Kullisaar T,Zilmer M,Mikelssar M,et al.Two antioxidative lactobac illistrains as promi sing probiotics[J].International Journal of Food Microbiology,2002,72:215-224
[2]Kudoh Y,Matsuda S,Igoshi K,et al.Antioxidative peptide from milk fermented with Lactobacillus delbrueckii subsp.Bulgaricus IFO13953[J].Nippon Shokuhin Kagaku Kaishi,2001,48:44-55
[3]蒋与刚,庞伟.乳清蛋白的生物学作用研究进展[J].中国食物与营养,2008,16(10):49-51
[4]Laakso S.Inhibition of lipid peroxidation by casein.Evidence of molecular encapsulation of 4,4-pentadiene fatty acids[J].Biophys Acta,1984,792:11-15
[5]Rival S G,Boeriu C G,Wichers H J.Caseins and casein hydrolysates.2.Antioxidative properties and relevance to lipoxygenase inhibition[J].Jounal of Agricultural and Food Chemistry,2001,49(1):295-302
[6]Saute-Gracla M T,Frankel E N,Rangavajhyala N,et al.Lactoferrin in infant formulas:Effect on oxidation[J].Journal of Agricultural and Food Chemistry,2000,48:4984-4990
[7]Penãa-Ramos E A,Xiong Y L.Antioxidative Activity of Whey Protein hydrolysates in a Liposomal System[J].J Dairy Sci,2001,84:2577-2583
[8]刘志东,郭本恒,王荫榆,等.乳源抗氧化肽的研究进展[J].食品科学,2009,30(1):282-287

