UPLC-MS/MS定性分析黑米中花青苷类物质
韩 豪,李新生,江 海,石绍福,马娇燕,杨智勇,刘水英,王 昕
(1.陕西理工学院生物科学与工程学院,陕西汉中 723000;2.陕西省黑色有机食品工程技术研究中心,陕西汉中 723000;3.陕西省资源生物重点实验室,陕西汉中 723000;4.运城学院生命科学系,陕西汉中 723000)
花青苷类物质又名花色苷,是在自然状态下花青素与各种单糖结合而成的黄酮多酚类化合物。常见的花青苷类物质主要有天竺葵素(花葵素)、矢车菊素、飞燕草素(翠雀素)、芍药素、矮牵牛素和锦葵素六大类[1-6]。黑米的种皮中富含花青苷类物质,具有清除自由基、抗氧化、抑制酶活性、保护血管、抗炎症和抑制肿瘤等多种功效[7-9]。
目前国内外对黑米花青苷的报道多集中在花青苷的提取和稳定性研究上,而对黑米花青苷单一组分分析的研究较少,在之前的研究中仅对黑米中的矢车菊素-3-葡萄糖苷、矢车菊素-3-芸香糖苷和芍药素-3-葡萄糖苷、芍药素-3-阿拉伯糖苷和锦葵素-3-半乳糖苷进行了准确定性[7,10]。因此,本研究采用超高效液相色谱-三重四级杆串联质谱仪(UPLC-MS/MS),建立矢车菊素类、芍药素类、天竺葵素类和锦葵素类这四类共13种花青苷类物质的定性方法,并对黑米(黑帅)中这13种花青苷类物质进行了定性分析。从而为黑米花青苷类化合物单一组分的系统分析、分离纯化和药理活性研究提供了基础数据。
1 材料与方法
1.1 材料与仪器
黑米样品 黑帅,由陕西省水稻研究所提供。
乙腈、甲醇 色谱纯,霍尼韦尔公司;甲酸 色谱纯,天津科密欧化学试剂有限公司;13种标准品 均购置于sigma公司,含量均≥97%,分别为矢车菊素(Cy)、矢车菊素-3-葡萄糖苷(Cy-3-glc),矢车菊素-3-阿拉伯糖苷(Cy-3-ara),矢车菊素-3-芸香糖苷(Cy-3-rut),矢车菊素-3-槐糖苷(Cy-3-soph);天竺葵素-3-葡萄糖苷(Pg-3-glc);锦葵素-3-葡萄糖苷(Mv-3-glc)、锦葵素-3-半乳糖苷(Mv-3-gal);芍药素(Pn)、芍药素-3,5-双葡萄糖苷(Pn-3,5-diglc)、芍药素-3-半乳糖苷(Pn-3-gal)、芍药素-3-葡萄糖苷(Pn-3-glc)、芍药素-3-阿拉伯糖苷(Pn-3-ara)。
ACQUITY TQD超高效液相色谱-三重四极杆串联质谱联用仪 美国waters公司;RE-52A旋转蒸发仪 上海亚荣生化仪器厂;DZF6050真空干燥箱 上海一恒科学仪器有限公司;LC-800离心机 科大创新股份有限公司。
1.2 样品处理
准确称取黑米(黑帅)1.0g,加入100mL石油醚索氏提取两次,提取时间均为3h。样品挥干后,加入100mL乙酸乙酯,置于60℃水浴中至乙酸乙酯挥干,重复操作一次。然后加入6%的甲酸水溶液50mL,在50℃下回流提取6h,重复操作一次,合并上清液,用6%甲酸水溶液定容至100mL,再用0.2μm的针头过滤器过滤,于超高效液相-三重四极杆串联质谱仪测定。
1.3 质谱方法的建立
离子源:电喷雾离子源(ESI);检测模式:多反应监测;扫描方式:正离子扫描;脱溶剂气流量:800L/h;锥孔气流量:50L/h;毛细管电压:3kV;离子源温度:110℃;脱溶剂气温度:400℃。
1.4 色谱条件
色谱柱:ACQUITY UPLC BEH C18柱(2.1mm×50mm,1.7μm);流速 0.3mL/min;柱温 40℃;进样量:10μL。流动相A为乙腈,B为0.6%甲酸水溶液,进行梯度洗脱,梯度洗脱参数如表1所示。
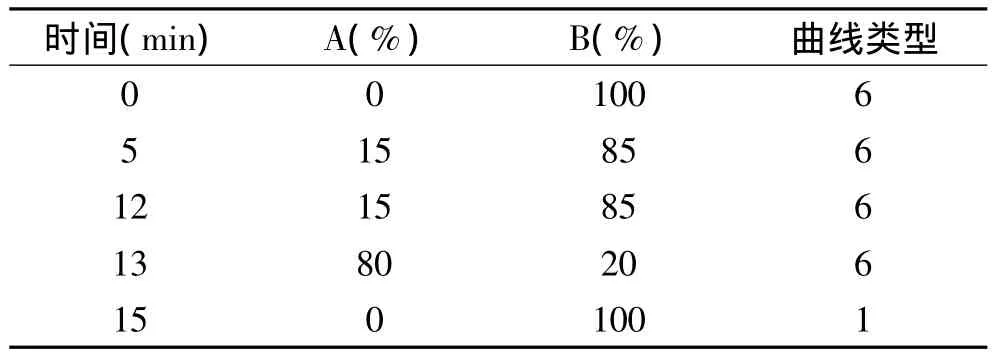
表1 超高效液相色谱条件Table 1 Gradient elution procedure for UPLC seperation
2 结果与分析
2.1 标准品质谱参数的优化
将表2中的13种花青苷类物质标准品用6%的甲酸水溶液溶解后,配制成500~1000μg/mL的标准溶液,然后以直接进样方式分别注入离子源中,在ESI正离子模式下进行母离子全扫描,得到每种花青苷类物质的分子离子峰,以每种花青苷类物质的准分子离子峰为母离子,进行二级质谱扫描,接着采集全扫描的二级质谱图,得到碎片离子信息,对每种花青苷类物质的二级质谱参数如锥孔电压、碰撞能量等进行优化,最后每种花青苷类物质的定性离子产生的离子对强度比例达到最大时为最佳,得到以定性离子、锥孔电压和碰撞电压的相关数据,如表2所示。

表2 花青苷标准品最佳锥孔电压和碰撞电压Table 2 The best cone voltages and collision voltages of anthocyanins standard solution
花青苷类物质是由花青苷苷元与一个或多个糖分子通过糖苷键结合的化合物,其种类繁多,存在多个同分异构体,且极性相近,因此纯化和检测难度较大[2]。目前国内外采用液质联用法对花青苷进行定性分析时,多采用在同一锥孔和碰撞电压下检测化合物的特征离子对,并参考该化合物紫外最大吸收波长[10-11],但是从表 2 中可见,花青苷类化合物最佳的锥孔和碰撞电压差异显著,用同一电压进行二级质谱碰撞时,部分化合物会因电压过大,使得特征子离子被电离成碎片离子,或者因电压过小,无法电离,从而无法检测出特征子离子。本实验采用直接进样方式将标准溶液依次注入离子源中,对每种化合物的锥孔和碰撞电压进行优化,提高了样品检测的灵敏度和准确性。
在适当的锥孔电压和碰撞电压下,花青苷的糖苷键首先断裂,之后花青苷苷元C环开环重排。矢车菊素类花青苷的糖苷键断裂后会检测到m/z 287的特征离子峰,即为矢车菊素类花青苷苷元,加大碰撞电压,可得到m/z 136.9的特征碎片离子峰,即为原儿茶醛(3,4-二羟基苯甲醛)。例如,矢车菊素-3-葡萄糖苷在锥孔电压为32V,碰撞电压为22V时,矢车菊素-3-葡萄糖苷(m/z 449.1)的葡萄糖苷键断裂,得到矢车菊素花青苷苷元(m/z 287)和葡萄糖(m/z 162),而葡萄糖不带电荷在质谱中无法检测出;之后在锥孔电压为32V,碰撞电压为56V时,矢车菊素花青苷苷元(m/z 287)C环开环重排,得到特征子离子为原儿茶醛(m/z 136.9),因此,矢车菊素-3-葡萄糖苷特征定性离子对应为449.1/287和449.1/136.9,其结构裂解图和质谱图分别见图1(A)所示。
芍药素类花青苷的糖苷健断裂后会检测到m/z 301的特征离子峰,即为芍药素类花青苷苷元;加大碰撞电压,可得到m/z 150.9的特征碎片离子峰,即为香草醛(3-甲氧基-4-羟基苯甲醛)。以芍药素-3-半乳糖苷(m/z 463)为例,芍药素-3-半乳糖苷特征定性离子对应为463/301和463/150.9,其结构裂解图和质谱图分别见图1(B)所示。
锦葵素类花青苷的糖苷健断裂后会检测到m/z 331的特征离子峰,即为锦葵素类花青苷苷元;加大碰撞电压,可得到m/z 180.9的特征碎片离子峰,即为丁香醛(3,5-二甲氧基-4羟基苯甲醛)。以锦葵素-3-葡萄糖苷(m/z 493)为例,锦葵素-3-葡萄糖苷特征定性离子对应为493/331和493/180.9,其结构裂解图和质谱图分别见图1(C)所示。
天竺葵素类花青苷的糖苷健断裂后会检测到m/z 271的特征离子峰,即为天竺葵素类花青苷苷元;加大碰撞电压,可得到m/z 120.9的特征碎片离子峰,即为对羟基苯甲醛。以天竺葵素-3-葡萄糖(m/z 433)为例,天竺葵素-3-葡萄糖特征定性离子对应为433/271和433/120.9,其结构裂解图和质谱图分别见图1(D)所示。

图1 花青苷质谱和结构裂解图Fig.1 Mass spectra and proposed fragmentation pathways of anthocyanins
2.2 黑米花青苷类化合物的定性分析
依据花青苷标准品质谱参数,确定了对应的定性离子对、锥孔电压和碰撞电压,通过超高效液相色谱,确定花青苷类物质的保留时间。通过定性离子对、锥孔电压、碰撞电压和保留时间(允许保留时间偏离±0.05min),对黑米中花青苷类物质的组分进行定性分析。
2.2.1 黑米中矢车菊素类花青苷的定性分析 在MRM模式扫描下,通过超高效液相色谱柱进行分离,矢车菊素类花青苷标准溶液保留时间如表3所示,对黑米进行检测可得,黑米中含有矢车菊素-3-槐糖苷、矢车菊素-3-葡萄糖苷、矢车菊素-3-阿拉伯糖苷、矢车菊素-3-芸香糖苷和矢车菊素,共5种矢车菊素类花青苷,如图2所示。孔令瑶等[7]采用液质联用技术与毛细管电泳电化学检测对黑米色素进行定性分析检测出矢车菊素-3-葡萄糖苷,孙妩娟等[12]采用液质联用技术也检测出矢车菊素-3-葡萄糖苷;Abdel-Aal等[10]在黑米中检测出矢车菊素-3-葡萄糖苷、矢车菊素-3-芸香糖苷和2个矢车菊素二糖苷(未准确定性)。因此,矢车菊素-3-槐糖苷、矢车菊素-3-阿拉伯糖苷和矢车菊素这3个矢车菊素类花青苷在黑米花青苷研究中未见报道。

表3 矢车菊素类花青苷标准溶液的保留时间Table 3 Retention time of cyanidins standard

表4 芍药素类花青苷标准溶液的保留时间Table 4 Retention time of peonidins standard
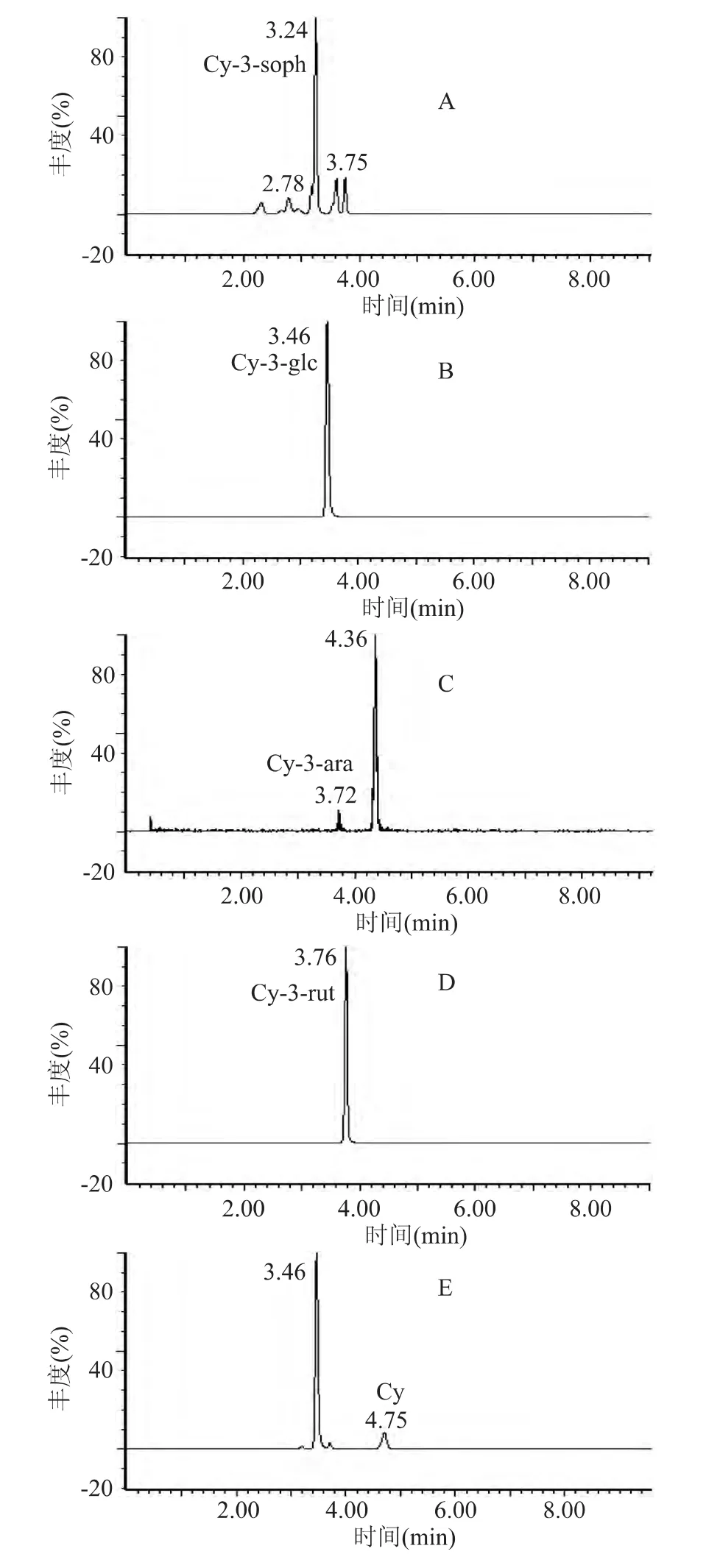
图2 黑米中矢车菊素类花青苷总离子色谱图Fig.2 Total ion current cyanidins of black rice
2.2.2 黑米中芍药素类花青苷的定性分析 在MRM模式扫描下,通过超高效液相色谱柱进行分离,芍药素类花青苷标准溶液保留时间如表4所示,对黑米进行检测可得,黑米中含有芍药素-3,5-双葡萄糖苷、芍药素-3-半乳糖苷、芍药素-3-葡萄糖苷、芍药素-3-阿拉伯糖苷和芍药素,共5种芍药素类花青苷,如图3所示。其中芍药素-3-葡萄糖苷在黑米中已经检测出[7,10,12],芍药素-3,5-双葡萄糖苷、芍药素-3-半乳糖苷、芍药素-3-阿拉伯糖苷和芍药素这4种芍药素类花青苷在黑米花青苷研究中未见报道。
2.2.3 黑米中锦葵素类花青苷的定性分析 在MRM模式扫描下,通过超高效液相色谱柱进行分离,如图4所示,锦葵素-3-半乳糖苷标准溶液保留时间为4.36min,锦葵素类-3-葡萄糖苷保留时间为4.61min,由这2个总离子色谱图可见黑米中锦葵素类花青苷检测出锦葵素-3-半乳糖苷和锦葵素类-3-葡萄糖苷。Sam等[13]在黑米中检测出锦葵素类-3-葡萄糖苷,锦葵素-3-半乳糖苷在黑米花青苷研究中未见报道。
2.2.4 黑米中天竺葵素类花青苷的定性分析 在MRM模式扫描下,通过超高效液相色谱柱进行分离,如图5所示,天竺葵素类-3-葡萄糖苷标准溶液保留时间为3.94min,由总离子色谱图可见黑米中含有天竺葵素类-3-葡萄糖苷。天竺葵素类-3-葡萄糖苷在黑米花青苷研究中已有报道[13]。
3 结论
针对黑米中花青苷结构复杂,液相色谱法无法对极性相近化合物进行分离检测等问题,本研究采用超高效液相色谱-三重四级杆串联质谱仪,并以多反应监测模式,建立了黑米中花青苷类化合物的检测方法,该方法具有简便、准确、高效、选择性强的特点。
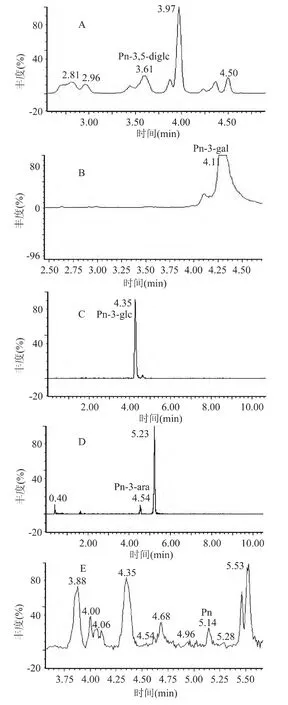
图3 黑米中芍药素类花青苷总离子色谱图Fig.3 Total ion current peonidins of black rice
对黑米中花青苷类物质进行定性分析,结果检测出黑米(黑帅)中的13种花青苷类物质分别为矢车菊素-3-槐糖苷、矢车菊素-3-葡萄糖苷、矢车菊素-3-阿拉伯糖苷、矢车菊素-3-芸香糖苷、矢车菊素、芍药素-3,5-双葡萄糖苷、芍药素-3-半乳糖苷、芍药素-3-葡萄糖苷、芍药素-3-阿拉伯糖苷、芍药素、锦葵素-3-半乳糖苷、锦葵素类-3-葡萄糖苷和天竺葵素类-3-葡萄糖苷。其中,矢车菊素类花青苷是黑米中主要花青苷,葡萄糖是黑米花青苷的主要糖配基,本研究首次检测到黑米中含有矢车菊素-3-槐糖苷、矢车菊素-3-阿拉伯糖苷、矢车菊素、芍药素-3,5-双葡萄糖苷、芍药素-3-半乳糖苷、芍药素-3-阿拉伯糖苷、芍药素和锦葵素类-3-半乳糖苷这8种花青苷。

图4 黑米中锦葵素类花青苷总离子色谱图Fig.4 Total ion current malvidins of black rice
图5 黑米中天竺葵素-3-葡萄糖苷总离子色谱图Fig.5 Total ion current Pg-3-glc of black rice
在此研究基础上,今后可进一步研究黑米不同品种中花青苷类物质的准确定性和定量分析,花青苷类化合物单一组分的分离纯化、药理活性研究和黑米中花青苷类物质的代谢途径等问题。
[1]Abdel-Aal E M,Abou-arab A A,Gamel T H,et al.Fractionation of blue wheat anthocyanin compounds and their contribution to antioxidant properties[J].Journal of Agricultural and Food Chemistry,2008,56:11171-11177.
[2]Castaneda-Ovando A,Pacheco-Hernande M L,Paez-Hernandez,et al.Chemical studies of anthocyanins:a review[J].Food Chemistry,2009,113:859-871.
[3]Kahkonen M P,Heinonen M.Antioxidantactivityof anthocyanins and their aglycons[J].Journal of Agricultural and Food Chemistry,2003,51:628-633.
[4]Zhu H M,Zhao M.Study on Chemical Constituents and Antioxidant Activity of Anthocyanins from Ipomoea batatas L.(purple sweet potato)[J].Chemistry and Industry of Forest Products,2009,29(1):39-45.
[5]Zhao X,Corrales M,Zhang C,et al.Composition and thermal stability of anthocyanins from Chinese purple corn(Zae mays L.)[J].Journal of Agricultural and Food Chemistry,2008,56:10761-10766.
[6]García-Benítez E,Cabello F,Revilla E.Analysis of grape and wine anthocyanins by HPLC-MS[J].Journal of Agricultural and Food Chemistry,2003,51(19):5622-5629.
[7]孔令瑶,汪云,曹玉华,等.黑米色素的组成与结构分析[J].食品与生物技术学报,2008,27(2):25-29.
[8]Hua C,Cai Y,Li W,et al.Anthocyanin characterization and bioactivity assessment of a dark blue grained wheat(Triticum aestivumL.cv.Hedong Wumai)extract[J].Food Chemistry,2007,104:955-961.
[9]Seok H N,Sun P C,Kang M Y,et al.Antioxidative activities of bran extracts from twenty one pigmented rice cultivars[J].Food Chemistry,2006,94:613-620.
[10]Abdel- Aal E S M,Young J C.Rabalski I.Anthocyanin composition in black,blue,pink,purple,and red cereal grains[J].Journal of Agricultural and Food Chemistry,2006,54(13):4696-4704.
[11]敬璞,张晓光,董英.紫玉米花青苷的研究进展[J].林产与化学工业,2010,30(1):103-110.
[12]孙妩娟,靳玲侠,赵蔡斌,等.高效液相色谱-串联质谱联用法对黑米色素的组成和结构分析[J].理化检验-化学分册,2012,48(9):1023-1026.
[13]Sam Y,Kim S J,Chang H I.Sun-Joong,Chang,Hyo-Ih.Isolation of anthocyanin from black rice Heugjinju-byeo)and screening of its antioxidant activities[J].Korean Journal of Microbiology and Biotechnology,2008,36(1):55-60.

