改良法肋软骨全耳廓再造术
李意源 张如鸿 张群 许志成 许枫 李大涛 孙楠 汪诚
外耳廓拥有超过15个解剖学亚单位结构,从后至前分别有耳甲腔复合体、对耳轮-耳轮复合体及外耳轮-耳垂复合体3层复合结构。外耳廓是人体拥有三维立体结构最为复杂的体表器官。因此,全耳再造是整形外科器官再造领域中最具挑战性的手术之一。自1959年Tanzer[1-2]提出,并由Brent[3-4]发展成熟的Ⅳ期全耳再造法后,Nagata[5-6]和Firmin[7]又通过大量实践和改良,将手术缩短为Ⅱ期。目前,应用自体肋软骨的二期耳廓再造术仍是公认的,最可靠的全耳再造方法。2009年起,在基于Nagata的Ⅱ期全耳再造法的实践中,我们对全耳再造术进行了系列的改进,减少了手术并发症,增强了手术效果。
1 资料与方法
1.1 病例资料
本组患者共234例(240耳)。其中,男136例,女98例;年龄6~42岁,平均16.3岁;单侧228例,双侧6例。根据残耳的结构及其手术方法不同[6],将小耳畸形分为腊肠型、耳甲腔型(包括严重收缩耳)、耳垂型和无耳型。
1.2 术前准备
患者头发全部剃除,或仅剃除耳周三横指宽头发。术前需检查确认患者术区无毛囊炎等局部炎症发生。
在Ⅰ期术前,以患者正常侧耳廓为模版,按照常规方法在X线片上标记并制作模片。标记时需轻轻将患者健侧耳廓向后侧及颅侧平展,当患者健侧耳廓颅耳角较大时,此步骤尤为重要(图1)。
1.3 手术方法
患者的手术均分Ⅱ期进行。Ⅰ期手术包括肋软骨耳廓三维支架的雕刻,皮肤的覆盖和耳垂的转位,负压吸引的管理;Ⅱ期手术主要为颅耳角的重建。Ⅱ期手术在Ⅰ期手术6个月后进行。
1.3.1 Ⅰ期手术
1.3.1.1 肋软骨的切取和耳支架雕刻
由于对侧肋软骨区的弧度和外形更适合进行支架的雕刻,故切取患耳对侧第6~8共3根肋软骨。我们采用特殊形状的树脂与羟基磷灰石复合材料,作为Ⅰ期颅耳角重建的支架[8],因此Ⅰ期手术中不需要切取额外的肋软骨。
我们对耳支架的雕刻进行了一些改良,将第6、7肋软骨用于雕刻支架的底板和耳屏对耳屏复合体。当切取的肋软骨厚度超过5 mm时,直接通过在底板上修薄凹陷的亚结构(耳舟、三角窝)以突显凸起的亚结构(对耳轮、对耳轮上脚及对耳轮下脚),通常对于成年患者及肋软骨发育较强壮的未成年患者可采用此方法;当肋软骨厚度小于5 mm时,基底部凸起的亚结构无法通过直接雕刻良好地显现,此时则另取残余软骨雕刻成Y形软骨条,并固定于底板相对位置上,以突出对耳轮、上脚及下脚结构。雕刻时应注意对耳轮上脚较对耳轮及对耳轮下脚低,且其边缘较对耳轮下脚平滑。耳屏对耳屏复合体是由耳屏、耳屏对耳屏间切迹和对耳屏组成,其下方并固定有一U型软骨块,均由雕刻支架底板时残余的软骨雕刻而成。U型软骨块用于维持耳屏对耳屏复合体的三维结构的稳定性,同时可增加耳甲腔的深度。外耳轮则由第8肋雕刻、弯曲形成,第8肋的尾端应长至能插入耳垂中,否则支架与耳垂的衔接处将出现不自然的台阶。当第8肋长度不足时,则需取第9肋进行拼接。通过适当的修薄,第8肋可形成令人满意的外耳轮弧度,将其沿底板外侧的弧度固定,构建外耳轮及耳轮脚。必须注意的是,软骨支架的每一个突出的解剖结构其边缘必须圆钝、光滑,以避免覆盖的皮肤过渡受压而致坏死。软骨支架各结构相互的拼接固定采用钢丝和尼龙缝线,所有钢丝结都置于支架的背面(图1)。

图1 Ⅰ期软骨支架及胶片耳模Fig.1The cartilage framework and radiographic film model
1.3.1.2 皮肤的覆盖和耳垂的转位
为了做到软骨支架被无张力的皮肤覆盖,对于腊肠型及耳垂型小耳畸形,采用W形的耳垂后切口;对于耳甲腔型,则采用位置较高的V形切口;而在基本无残余软骨需剔除的情况下(一些无耳型及耳垂型小耳畸形),可在发际线下方直接作弧形切口(作为包裹软骨支架的皮瓣“口袋”入口)。进行乳突区皮瓣分离时,需特别注意保证皮下血管网的完整性。同时在耳甲腔部位保留一皮下蒂,大小应以不阻碍耳支架顺利旋转到位为标准,宽度尽可能大,以保证皮瓣远端血供。对于某些耳甲腔型的患者,覆盖耳支架的皮肤会有多余,应根据皮瓣的血供,进行综合判断,切除多余的皮肤。所有的残耳软骨均应小心剔除,剔除层次位于软骨膜上。分离的乳突区皮瓣边缘应超过标记的再造耳外缘。应特别注意小心止血,同时防止止血过程中电刀的过度电凝。为了防止漏气,皮瓣处严禁针刺。
1.3.1.3 负压吸引的管理
分别于耳舟和耳甲腔处各置1根引流管,引流管末端打孔。以20 mL针筒进行负压抽吸,针筒活塞以带盖的针头卡紧。保证切口缝合紧密,进行负压抽吸观察并调整引流管位置。负压的大小可通过不同型号针筒调整,手术结束前需检查是否漏气。所有的缝合切口均以金霉素(或红霉素)眼膏覆盖封闭。再造耳无需任何外层敷料包扎,密切观察皮瓣贴附情况及再造耳廓形态,以便随时调整负压而防止渗液积聚或皮瓣坏死。术后每隔30 min更换负压针筒,2 h之后每隔2 h更换1次。通常在术后第3天拔除负压引流,根据患者情况及时调整负压大小及负压关闭的时间。
1.3.2 Ⅱ期手术
由于耳甲腔下段及耳垂的皮肤缺损采用一连接耳垂的三角瓣覆盖,故设计沿再造耳外耳轮旁开5 mm处作切口,紧贴再造耳的深面向耳甲腔方向剥离,分离层面位于软骨支架与筋膜层之间。随后于外耳轮后皮下剥离出足够宽大的耳后筋膜瓣,该筋膜瓣以能无张力完整覆盖软骨支架及骨水泥支架为宜。将再造耳掀起,其背后所有能触及钢丝结的钢丝都应去除。软骨支架背面若有锐角则修至平滑,保证其上的筋膜瓣及皮瓣可平整且无张力覆盖。根据术前测量的健侧耳颅耳角大小选择不同规格的骨水泥支架。将骨水泥支架(羟基磷灰石树脂复合材料)置于耳甲腔后壁支撑再造耳,可形成较理想的再造耳与颅骨间的夹角(目测其大小与健侧基本对称,通常为30°左右)。骨水泥支架耳支架侧和颅骨侧各有一排小孔(小孔距边缘2 mm),通过各小孔以细钢丝固定骨水泥支架。固定骨水泥支架时注意调整再造耳长轴方向使其向后倾斜。接下来,以耳后筋膜瓣覆盖骨水泥支架。乳突区和软骨支架背面的皮肤缺损由患耳同侧头皮区或患耳对侧腹股沟区(由患方于术前谈话时自行选择)切取的全厚游离皮瓣覆盖。完成植皮后,按常规打包加压,头皮内放置负压引流。
1.4 术后处理
Ⅰ期手术后,保持3 d的负压引流,观察皮瓣的血供,常规应用抗生素3 d,术后10 d拆线。为使皮瓣建立良好的血供,术后6个月内应避免受压(尤其睡眠时)。Ⅱ期颅耳角重建术后10 d,打开植皮加压包,同时拆线,为了防止再造颅耳角回缩,配以特定的支架配戴3个月,同样保证术后6个月内避免再造耳受压。必须重视对患者及家属的术后护理宣教,包括耳区的清洗、防止植皮区干燥及睡眠时避免再造耳受压等。
2 结果
所有患者均随访6个月以上,耳廓的位置及三维形态、耳廓皮肤色泽、与健侧耳的对称性等方面均能可达到令人满意的效果。术后最常出现的并发症是Ⅱ期术后耳后植皮区的增生性瘢痕,难以通过手术方法的改良或是术后处理干预的。耳后瘢痕收缩将导致重建的颅耳角不同程度的缩小。其他的并发症,如皮瓣坏死、感染、软骨外露等都极少发生(图2)。
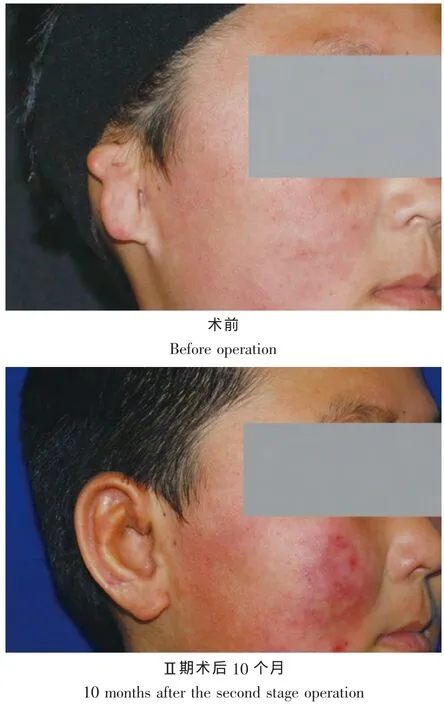
图2 典型病例Fig.2Typical case
根据我们的临床经验,对二期全耳再造法提出了关键的5点改良措施,包括①由于Ⅱ期采用骨水泥支架,而非肋软骨块重建颅耳角,我们常规仅需切取第6~8肋软骨,不需要第9肋,减少了供区损伤,同时也缩短了胸壁瘢痕长度。②对于不同的患者,根据其肋软骨的厚度采取两种不同的支架雕刻方式,这种个性化的雕刻能更好显现再造耳廓的形态。③耳屏对耳屏复合体下方有U型软骨块支撑,维持其三维结构的稳定性,同时又可增加耳甲腔的深度。④Ⅰ期术后对耳舟和耳甲腔同时进行负压吸引及严密观察管理,可保证皮肤与软骨支架紧密贴附,并且防止皮下血肿或渗液积聚而影响形态,另外也避免了油钉固定导致的皮瓣坏死。⑤Ⅱ期使用特定形状的骨水泥支架进行支撑,较肋软骨块能维持更加稳定的颅耳角,并且省去Ⅰ期皮下埋置及Ⅱ期取出肋软骨块的步骤。
3 讨论
耳廓是人体拥有三维立体结构最为精致的体表器官,全耳再造手术一直是整形外科医生的最大挑战之一。自Nagata起,应用自体肋软骨的二期耳廓再造术逐渐成为国际中应用最广泛的耳再造术式。我们进行了大量的临床实践,并进行了系列的改良。
在Ⅰ期手术中,Nagata[6]倾向于切取患耳同侧的第6~9肋软骨作为耳软骨支架,并用于Ⅱ期手术支撑颅耳角的支架来源。而切取的肋软骨越多,术后造成患者胸廓畸形的风险将越大。由于我们Ⅱ期手术支架无需取自肋软骨,常规切取第6~8肋的3根肋软骨即可满足需求,缩短了胸壁切口的长度。
当患者肋软骨发育至足够强壮时,再造耳的各个亚单位结构(耳舟、三角窝、对耳轮及其上下脚)通常直接在底板上雕刻形成。然而,若肋软骨没有足够的厚度,底板上凸起的结构将无法很好地显现,此时需另取残余软骨雕刻对耳轮及其上下脚的复合Y形结构并拼接于底板上。在支架雕刻时,相对于Brent采用雕刻完成所有底板上的结构再现,Nagata更倾向于使用拼接的方法。这种差异是由于高加索人种的肋软骨较亚洲人更为强壮所造成的。我们认为,当患者的肋软骨厚度大于5 mm时,采用直接雕刻的方法较拼接更为适宜。
有文献提出,在底板下方沿耳甲腔边缘另加一块月牙形软骨块,可达到加深耳甲腔的效果[7,9]。然而,我们认为此软骨块放置于底板下方将影响整个支架的稳定性,还会增加皮瓣切缘的张力。根据我们的临床经验,若完全剔除残耳软骨后,乳突区出现较深的凹坑,耳屏对耳屏复合体下方的U形软骨块可通过增加耳屏对耳屏复合体的高度,达到加深耳甲腔的效果。同时,由于耳屏对耳屏复合体是通过软骨条的雕刻并扭曲展现耳屏、耳屏对耳屏间切迹和对耳屏的结构,于其下固定U形软骨块能更好地维持其三维结构的稳定性。
高质量的适宜皮瓣囊袋对于成功的再造耳是非常关键的。因此,针对不同的小耳畸形,应设计其最适宜的切口。耳垂后W形切口非常巧妙地增加了覆盖耳支架的皮瓣面积。Nagata指出,皮下蒂能够有效增加整个皮瓣的血供,保证了覆盖耳屏、耳屏间切迹和对耳屏的皮瓣血运。我们的临床经验是在不影响耳支架旋转的前提下,皮下蒂的宽度应不小于2 mm。
要使得耳支架的精细结构得以体现,除了精良的手术方法、支架雕刻技术外,对再造耳的塑形也是不可忽视的。相对于既往油钉固定的方法[5],Cronin等[10]和Brent[3]采用的术后持续负压吸引装置,在塑形方面有更明显的优势,不仅可使皮肤与软骨支架紧密贴附,防止皮下血肿、渗液的积聚,而且避免了油钉固定导致的皮瓣坏死。支架上下两个层面同时放置引流比只放一处引流的效果更佳[11]。Park[11]认为,成年患者的再造耳术后负压应较强,而儿童则应相对弱。但是,我们的实践得出了相反的结论[12]。成年患者于术后更易出现早期的皮瓣与耳支架的贴合,而早期过度的贴附并不利于随后再造耳形态的自然显现。同时,由于成年人的皮肤弹性相对差,过强的负压吸引可增加再造耳局部皮瓣坏死的风险。而儿童的皮肤更光滑且富有弹性,若没有术后3天足够的负压,则不利于形成皮瓣与支架的贴附。术后再造耳不进行任何的敷料包扎,有利于观察皮瓣贴附情况及再造耳廓的形态,并可随时调整负压。
术后维持稳定的颅耳角一直是二期颅耳角重建术的关键点。Brent[13-14]和Nagata[15]选择肋软骨作为支撑材料,但术后远期常因瘢痕收缩产生的压力,以及不恰当的睡姿导致支撑软骨的吸收,最终表现为重建的颅耳角严重缩小。因此,我们采用不可降解的羟基磷灰石复合树脂材料,制作特定形状与规格的骨水泥,作为Ⅱ期颅耳角重建的支撑材料[8]。该骨水泥支架设计成独特的半月形,上下侧各有一排小孔(小孔距边缘2 mm)。相对肋软骨而言,其作为Ⅱ期颅耳角支撑材料的优越性是显而易见的。由于Ⅱ期手术中能针对性地支撑耳甲腔后壁,经过颅耳角重建后的再造耳,其耳甲腔的深度能进一步增加,使整个耳廓的形态更自然逼真。
值得注意的是,术后瘢痕仍然是目前耳再造手术面临的较大困难。增生性瘢痕、瘢痕疙瘩以及严重的瘢痕挛缩,极大地影响着再造耳的整体效果。严重的瘢痕挛缩和增生,将缩小颅耳角甚至填平整个颅耳沟,即使采用全厚皮瓣覆盖也不能阻止该现象的出现,导致再造耳的外观受到影响,严重者还会影响患者佩戴眼镜。亚洲人出现瘢痕的增生和挛缩较高加索人种概率更高,另外,蒙古人种的颅耳角又较高加索人种更大(尤其是上1/3和下1/3)。而迄今尚无有效的方法控制和处理术后瘢痕。
纵观耳再造的发展历史,初始阶段主要集中在追求轮廓的再现和外耳大小的重建,但缺乏诸多亚单位结构的构建;随后进入关注各个亚单位结构构建的阶段;目前,随着患者认知程度的不断提高、整形外科技术的不断成熟和发展,全耳再造进入了新的发展阶段,①再造耳的各个亚单位结构的构建需要更为逼真,并且各解剖结构之间过渡的应更为自然;②预防、控制及处理瘢痕收缩导致的颅耳角缩小,颅耳沟变浅甚至再造耳变形;③使条件并不理想的患者,如伴发严重半面短小者的再造耳外形趋于完美;④平衡外耳道重建与外耳再造之间存在的矛盾;⑤评估局部皮瓣与扩张法在外耳再造中的利弊;⑥评估肋软骨耳支架和Medpor耳支架的适应证;⑦残余耳软骨培养构建耳支架与组织工程软骨支架构建的研究及临床应用。
[1]Tanzer RC.Total reconstruction of the auricle:The evolution of a plan of treatment[J].Plast Reconstr Surg,1971,47(6):523-533.
[2]Tanzer RC.Microtia-a long-term follow-up of 44 reconstructed auricles[J].Plast Reconstr Surg,1978,61(2):161-166.
[3]Brent B.The correction of microtia with autogenous cartilage graft[J].Plast Reconstr Surg,1980,66(1):1-21.
[4]Brent B.Auricular repair with autogenous rib cartilage grafts:two decades of experience with 600 cases[J].Plast Reconstr Surg,1992,90(3):355-374.
[5]Nagata S.A new method of total reconstruction of the auricle for microtia[J].Plast Reconstr Surg,1993,92(2):187-201.
[6]Nagata S.Modification of the stages in total reconstruction of the auricle[J].Plast Reconstr Surg,1994,93(2):221-266.
[7]Firmin F.Ear reconstruction in cases of typical microtia.Personal experience based on 352 microtic ear corrections[J].Scand J Plast Reconstr Surgery Hand Surg,1998,32(1):35-47.
[8]Zhang Q,Zhang R,Xu F,et al.Firm elevation of the reconstructed auricle with a retroauricular fascial flap wrapping an EH(a mixture of epoxide acrylate malelic and hydroxyapatite)composite wedge[J].J Plast Reconstr Aesthet Surg,2010,63(9):1452-1458.
[9]Osorno G.Autogenous rib cartilage reconstruction of congenital ear defects:report of 110 cases with Brent's technique[J].Plast Reconstr Surg,1999,104(7):1951-1962.
[10]Cronin TD,Greenberg RL,Brauer RO.Follow-up study of Silastic frame for reconstruction of external ear[J].Plast Reconstr Surg,1968,42(6):522-529.
[11]Park DH,Song CH,Han DG,et al.A simple negative suction drain for ear reconstruction[J].Plast Reconstr Surg,1999,103(3):972-975.
[12]吴近芳,陈文馨,李大涛,等.全耳再造一期术后负压引流与再造耳形态的探讨50例[J].组织工程与重建外科,2009,5(4):212-214.
[13]Brent B.Technical advances in ear reconstruction with autogenous rib cartilage grafts:personal experience with 1200 cases[J].Plast Reconstr Surg,1999,104(2):319-334.
[14]Brent B.Microtia repair with rib cartilage grafts:a review of personal experience with 1000 cases[J].Clin Plast Surg,2002,29(2):257-271.
[15]Nagata S.Modification of the stages in total reconstruction of the auricle:Part IV.Ear elevation for the constructed auricle[J].Plast Reconstr Surg,1994,93(2):254-266.

