糖尿病视网膜病变大鼠视网膜动脉平滑肌细胞中钙离子浓度的变化△
邵珺 孙尉 姚勇 王如心 曹葭
【实验研究】
糖尿病视网膜病变大鼠视网膜动脉平滑肌细胞中钙离子浓度的变化△
邵珺 孙尉 姚勇 王如心 曹葭
大电导钙离子激活钾离子通道;视网膜动脉平滑肌细胞;细胞内钙离子浓度
目的 探讨糖尿病视网膜病变SD大鼠视网膜动脉平滑肌细胞中钙离子浓度的变化。方法 取40只正常雄性SD大鼠,采用链脲佐菌素(streptozotocin,STZ)100 mg·kg-1腹腔内注射建立糖尿病大鼠模型,持续6个月后经眼底荧光血管造影证实各大鼠出现糖尿病视网膜病变,作为糖尿病视网膜病变组。同时选择正常SD大鼠40只及单纯形成糖尿病的大鼠40只分别用作正常对照组及单纯糖尿病组。酶消化法分离出视网膜动脉平滑肌细胞,荧光测定仪测定三组大鼠视网膜动脉平滑肌细胞内钙离子浓度,SPSS17.0软件进行分析,以P<0.05为差异有统计学意义。结果 造模8周后,测得正常对照组和单纯糖尿病组大鼠血糖水平分别为(6.77±0.18)mmol·L-1和(31.14±0.75)mmol·L-1,符合成模条件,6个月后糖尿病视网膜病变组大鼠眼底荧光血管造影确定为糖尿病视网膜病变SD大鼠模型。糖尿病视网膜病变大鼠视网膜动脉平滑肌细胞内钙离子浓度(255±10)nmol·L-1较正常对照组(123±11)nmol·L-1和单纯糖尿病组(152±23)nmol·L-1明显增高,三组之间差异具有统计学意义(P<0.05)。结论 糖尿病视网膜病变视网膜动脉平滑肌细胞内钙离子浓度升高可能成为糖尿病视网膜动脉异常收缩及功能异常的重要原因。
[眼科新进展,2014,34(11):1013-1016]
糖尿病视网膜病变(diabetic retinopathy,DR)是糖尿病最常见的微血管并发症之一,是发达国家主要致盲眼病[1-2]。随着人们生活水平的日益提高,我国糖尿病患病率呈逐年升高趋势[3-5],糖尿病相关的眼底并发症也成为我国人群低视力和致盲的重要因素。因此探索DR早期的发病机理,对指导未来制定合理的预防策略意义重大。
最近研究结果显示,DR的视网膜动脉血管的收缩和血流灌注的减少早于DR微血管病变的出现[6-7]。在DR发病初期,视网膜动脉血管内离子通道的异常改变是导致其异常收缩、血流动力学紊乱的主要原因之一[8-9],其中视网膜血管平滑肌细胞大电导钙离子激活钾离子(large conductance Ca2+-activated K+channel,BK)通道的改变尤为重要。
荧光探针Fura-2/AM自1985年问世以来[10],已成为测定细胞内钙离子浓度最常用的化学荧光指示剂。而研究糖尿病发展过程中大鼠视网膜动脉平滑肌细胞(retinal artery smooth muscle cells,RASMC)内钙离子浓度的变化,可以从一个方面反映BK通道功能的改变。因此本研究拟通过测定正常、糖尿病及DR大鼠RASMC中钙离子浓度的变化,初步探索糖尿病发病进程中视网膜动脉异常受损的作用机理。
1 材料与方法
1.1 材料
1.1.1 实验动物和器材 选用8~12周龄、体质量(200±30)g的健康SD大鼠(江苏省血吸虫病防治研究所动物中心提供),雌雄不拘。细胞内钙测定装置由Olympus-IX71倒置显微镜,LAMBDA DG-4细胞内钙离子浓度荧光测定仪、灌流系统、Metaflur软件分析系统(美国Molecular Devices公司)组成;其他仪器有SHZ-82水浴恒温振荡器、SANXIN PHB-3/pH计、FA1604电子天平、Olympus SZX10解剖显微镜、Olympus LG-PS2光源。
1.1.2 试剂和溶液组成 试剂:Ⅱ型胶原酶(Worthington公司生产),牛血清白蛋白、木瓜蛋白酶、二硫苏糖醇、胰蛋白酶抑制剂、弹性蛋白酶、Fura-2/AM、链脲佐菌素(streptozocin,STZ)购自美国Sigma公司,生理盐水溶液(江苏恒瑞医药公司)。溶液组成(单位mmol·L-1):保存液:NaCl 140、KCl 5、CaCl22、D-glucose 5、MgCl21.3、HEPES 10,NaOH调pH至7.3;D-Hanks液(单位g·L-1):NaCl 8、KCl 5、Na2HPO40.13、KH2PO40.06、NaHCO30.35、酚红0.02,用NaHCO3调pH至7.4。STZ溶液:临用前将STZ溶于生理盐水,制成浓度为50 g·L-1STZ溶液。
1.2 实验动物与研究方法
1.2.1 动物模型建立 造模采用最近研究报道的方法[11],取40只正常SD大鼠,体质量200 g左右,采用STZ 100 mg·kg-1腹腔内注射,2周后测定大鼠血糖浓度,如血糖浓度低于3 g·L-1,等剂量STZ再次腹腔内注射,当血糖浓度持续高于3 g·L-1诊断为糖尿病,持续6个月后经眼底荧光血管造影证实出现DR,作为DR组。同时选择正常SD大鼠40只及单纯形成糖尿病的大鼠40只分别用作正常对照组及单纯糖尿病组。
1.2.2 处死动物取眼球 以30 g·L-1戊巴比妥钠3 mL腹腔内注射麻醉[12],颈椎脱臼法处死,用眼科镊及眼科剪取下眼球,放入保存液中,4 ℃冰箱保存。
1.2.3 分离视网膜动脉 将取下的眼球置于琼脂板上固定,在解剖显微镜下调好放大倍数及焦距。左手持眼科显微无齿镊,右手持Alcon 15°刀,沿睫状体扁平部垂直刺入,划开一个约1/4圈的口子。右手换持角膜剪,沿着划开的口子将角膜剪开,取下角膜,完整取出晶状体,暴露玻璃体。调整放大倍数及焦距,在显微镜下找到视网膜动脉,由中央发出呈放射状,用眼科显微无齿镊小心分离出视网膜动脉,尽量剔除周边黏附的玻璃体,将分离出的视网膜动脉置于1 mL EP管中。
1.2.4 消化视网膜动脉 打开水浴恒温振荡器,调节水温至37 ℃,打开振荡开关,放入含有视网膜动脉和消化液的EP管。1号消化液含牛血清白蛋白1 mg及保存液1 mL,2号消化液含木瓜蛋白酶1.5 mg、二硫苏糖醇1 mg及1号消化液1 mL,3号消化液含Ⅱ型胶原酶1 mg、胰蛋白酶抑制剂1 mg、弹性蛋白酶0.25 mg及1号消化液1 mL。按照1、2、3的顺序,每步骤消化20 min,最后将消化后的组织置于含有1 mL保存液的EP管中,4 ℃冰箱保存,4~16 h内使用。
1.2.5 正常及糖尿病大鼠RASMC内钙离子浓度测定 取出分离好的细胞悬液,用微量移液器吹打,吸取200 μL至Olympus-IX71倒置显微镜的细胞池中,再加入D-Hanks液795 μL,约10 min后在显微镜下观察,如果细胞数量适中,状态良好,则加入1 mmol·L-1Fura-2/AM 5 μL,使Fura-2/AM在溶液中的终浓度为5 μmol·L-1,避光30 min。将负载好Fura-2/AM的RASMC溶液用D-Hanks液连续冲洗约10 min,然后在倒置显微镜下,每次选取一个或一个以上RASMC作为靶细胞进行细胞内钙离子浓度测定。
打开LAMBDA DG-4细胞内钙离子浓度荧光测定仪,设定荧光探针Fura-2/AM的激发波长为340 nm和380 nm,发射波长为510 nm。在避光条件下,连续记录单个或多个RASMC的荧光信号强度。将在340 nm和380 nm两个激发波长下的荧光强度吸收信号F340和F380储存在计算机中进行处理和分析,测定时记录静息状态下荧光信号强度比值R(F340/F380)。荧光信号强度比值R的变化代表RASMCs内钙离子浓度的变化,使用公式[Ca2+]i=β×Kd×(R-Rmin)/(Rmax-R)(单位:nmol·L-1)可将荧光信号强度比值换算成细胞内钙离子的浓度[10],式中[Ca2+]i代表细胞内游离钙离子浓度,β是与选定波长有关的比例系数,β=F380 max/F380 min,其中F380 max和F380 min分别代表细胞内钙离子饱和状态下和细胞内钙离子浓度为0 nmol·L-1时的荧光信号强度,即Fura-2与钙离子结合达饱和状态及完全游离时,在380 nm激发光下细胞内荧光强度之比;Kd为Fura-2与Ca2+反应的解离常数,为224 nmol·L-1;R是不同实验条件下测得的荧光信号强度的比值;Rmax为加入10 g·L-1Triton X-100后测得的最大荧光信号强度比值(Rmax=F340 max/F380 max);Rmin为加入10 mmol·L-1乙二胺四乙酸后,测得的最小荧光信号强度比值(Rmin=F340 min/F380 min)。在计算细胞内钙离子浓度之前,应减去没有负载Fura-2之前细胞本身的荧光强度[13-15]。
2 结果
2.1 糖尿病成模情况 造模8周后,测得正常对照组和单纯糖尿病组大鼠血糖水平分别为(6.77±0.18)mmol·L-1和(31.14±0.75)mmol·L-1,单纯糖尿病组大鼠血糖水平显著高于对照组,符合造模要求;正常对照组大鼠体质量较造模前增加75.4%,而糖尿病大鼠体质量比造模前降低了11.3%。糖尿病大鼠持续6个月饲养后经眼底荧光血管造影确定成模(图1)。
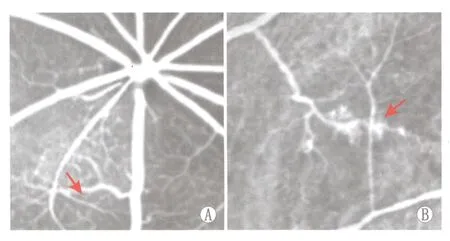
Figure 1 Fundus fluorescein angiography images of normal rats and rats with diabetic retinopathy.A:Fundus fluorescein angiography images of normal SD rat,large vascular walls were smooth,and the walls of small blood vessels were without leakage(arrows position);B:Fundus fluorescein angiography images of SD rats with diabetic retinopathy,the position of the arrow was fluorescence retinal vascular leakage area 正常对照组和DR组SD大鼠眼底荧光造影图。A:正常对照组SD大鼠眼底荧光血管造影图片,大血管壁平滑,小血管壁无渗漏(箭头所示);B:DR组SD大鼠眼底荧光造影图,箭头所指位置为视网膜血管荧光渗漏区
2.2 分离的RASMC 在倒置显微镜下观察急性分离的RASMC,低倍镜下每个视野数量10~15个细胞,大多数RASMC呈蚯蚓状,部分呈短杆状,花生状,形态各异。RASMC轮廓清晰,为存活状态(图2)。
2.3 正常对照组、单纯糖尿病组及DR组大鼠RASMC中钙离子浓度测定 利用Metafluor软件实时输出,DR组大鼠RASMC细胞内钙离子浓度为(255±10)nmol·L-1,正常对照组(123±11)nmol·L-1和单纯糖尿病组(152±23)nmol·L-1,三者比较,差异具有统计学意义(P<0.05)。

Figure 2 RVSMC with earthworm-like(× 200) RASMC呈蚯蚓状(×200)
3 讨论
DR已经成为重要的致盲眼病[1],我国是糖尿病易患国家之一,流行病学调查结果显示,我国糖尿病患病率由10 a前的3.2%上升到目前的6.07%,且仍持续上升,而糖尿病人群中DR平均患病率则高达50%[4-6],预计到2025年我国因DR而致盲的患者将达到320万[7]。因此,探索DR早期预防和治疗的方法显得尤为迫切和重要。DR发病机制复杂,有研究报道,糖尿病时视网膜血流动力学异常早于DR发生,并与其发生发展密切相关。DR病变前期即出现视网膜中央动脉及其分支的异常收缩,导致视网膜血流灌注的减少,视网膜组织缺血缺氧[8]。病变继续发展,在持续高血糖的影响下,视网膜血管功能和结构的完整性受到破坏,血管渗漏增加,视网膜组织缺血缺氧加剧,继发一系列玻璃体视网膜增生性病变,最终导致失明。在上述过程中视网膜血管收缩和血流灌注的减少早于DR微血管病变的出现[7,9]。目前,糖尿病视网膜动脉异常收缩的调控机制尚未明了,故研究糖尿病时视网膜动脉异常收缩的机制对DR的早期预防和治疗具有重要意义。
BK通道是调节血管舒缩的重要离子通道。参与血管张力调节、神经兴奋和神经递质释放等多种重要生理活动。BK通道受细胞跨膜电压和细胞内钙离子浓度的调节,当跨膜电压增加和(或)细胞内钙离子浓度升高时,BK通道开放,钾离子外流,细胞膜复极,血管扩张[16]。正常情况下,由于BK通道激活后钾离子外流,产生超极化,因而抑制电压依赖性钙离子通道开放,使钙离子内流减少,血管平滑肌舒张,故BK通道功能主要是参与血管扩张。视网膜动脉是发自颈内动脉的终末动脉,其收缩与舒张的调节与视网膜病变密切相关。而RASMC是位于视网膜动脉上的血管平滑肌细胞,其细胞内钙离子浓度变化影响了细胞的收缩与舒张,从而影响了视网膜动脉的收缩与舒张。
以往对细胞中钙离子浓度的研究显示细胞内钙超载被认为是多种疾病病理状态中造成细胞异常损伤的共同通路[17-18]。本次在对单纯糖尿病大鼠和DR大鼠RASMC中钙离子浓度的研究中同样发现随着糖尿病病程的发展RASMC中钙离子浓度呈增高趋势,根据测定程序计算出的DR大鼠视网膜RASMC内钙离子浓度较正常对照组和单纯糖尿病组升高,三组钙离子浓度的变化差异具有统计学意义。我们推测,在糖尿病时,RASMC细胞内游离钙离子增加,钙活动增多,因此单纯糖尿病组及DR组的RASMC较正常对照组处于更易收缩的状态,此即为糖尿病时视网膜动脉异常收缩的基础。视网膜动脉的异常收缩会导致视网膜血流灌注的减少,视网膜组织缺血缺氧。病变继续发展,在持续高血糖的影响下,视网膜血管功能和结构的完整性受到破坏,血管渗漏增加,视网膜组织缺血缺氧加剧,继发一系列玻璃体视网膜增殖性病变,最终导致视功能永久性损伤。因此,糖尿病时RASMC内钙离子浓度升高可能是DR的前期改变及重要机制之一。
1 Nakamura Y,Tomidokoro A,Sawaguchi S,Sakai H,Iwase A,Araie M.Prevalence and causes of low vision and blindness in a rural Southwest Island of Japan:the Kumejima study[J].Ophthalmology,2010,117(12):2315-2321.
2 Clark A,Morgan WH,Kain S,Farah H,Armstrong K,Preen D,etal.Diabetic retinopathy and the major causes of vision loss in Aboriginals from remote Western Australia[J].ClinExpOphthalmol,2010,38(5):475-482.
3 Macky TA,Khater N,Al-Zamil MA,El Fishawy H,Soliman MM.Epidemiology of Diabetic Retinopathy in Egypt:A Hospital-Based Study[J].OphthalmicRes,2011,45(2):73-78.
4 Zhang X,Saaddine JB,Chou CF,Cotch MF,Cheng YJ,Geiss LS,etal.Prevalence of diabetic retinopathy in the United States,2005-2008[J].JAMA,2010,304(6):649-656.
5 Li Y,Liao Y,Fan A,Zhang X,Balluz L.Asian American/Pacific Islander paradox in diabetic retinopathy:findings from the Behavioral Risk Factor Surveillance System,2006-2008[J].EthnDis,2010,20(2):111-117.
6 Yang WY.Achieve great success,and blaze a trail:review of clinical and basic research progress of Chinese diabetes in the 21st century[J].ChinMedJ,2009,122(21):2525-2529.
7 Bek T.Lack of correlation between short-term dynamics of diabetic retinopathy lesions and the arterial blood pressure.Graefes[J].ArchClinExpOphthalmol,2011,249(2):267-271.
8 McGahon MK,Dash DP,Arora A,Wall N,Dawicki JM,Simpson DA,etal.Diabetes downregulates large-conductance Ca2+-activated potassium beta 1 channel subunit in retinal arteriolar smooth muscle[J].CircRes,2007,100(5):703-711.
9 McGahon MK,Zhang XH,Scholfield CN,Curtis TM,Mc Geown JG.Selective downregulation of the BK beta1 subunit in diabetic arteriolar myocytes[J].Channels(Austin),2007,1(3):141-143.
10Grynkiewicz G,Poenie M,Tsien RY.A new generation of Ca2+indicators with greatly improved fluorescence properties[J].JBiolChem,1985,260(6):3340-3450.
11Lu T,Zhang DM,Wang XL,He T,Wang RX,Chai Q,etal.Regulation of coronary arterial BK channels by caveolae-mediated angiotensin Ⅱ signaling in diabetes mellitus[J].CircRes,2010,106(6):1164-1173.
12王如兴,李肖蓉,羊镇宇,李库林,郑杰,张常莹,等 大电导钙离子激活钾通道对糖尿病大鼠冠状动脉血管张力的调节[J].中华医学杂志,2010,90(36):2575-2578.
13Zsembery A,Boyce AT,Liang L,Peti-Peterdi J,Bell PD,Schwiebert EM.Sustained calcium entry through P2X nucleotide receptor channels in human airway epithelial cells[J].JBiolChem,2003,278(15):13398-13408.
14Girard T,Treves S,Censier K,Mueller CR,Zorzato F,Urwyler A.Phenotyping malignant hyperthermia susceptibility by measuring halothane-induced changes in myoplasmic calcium concentration in cultured human skeletal muscle cells[J].BrJAnaesth,2002,89(4):571-579.
15Hyrc K,Handran SD,Rothman SM,Goldberg MP.Ionized intracellular calcium concentration predicts excitotoxic neuronal death:observations with low-affinity fluorescent calcium indicators[J].JNeurosci,1997,17(17):6669-6677.
16Hou S,Heinemann SH,Hoshi T.Modulation of BKCa channel gating by endogenous signaling molecules[J].Physiology,2009,24(1):26-35.
17田克印,吴德,杨李,陈玉萍,唐久来.人巨细胞病毒体外感染SD乳鼠海马神经元细胞模型的建立及钙代谢的初步研究[J].中华实用儿科临床杂,2014,29(6):455-458.
18寇天雷,张永亮.红景天苷对大鼠体外培养海马神经元物理缺氧损伤钙离子含量、钙激活中性蛋白酶及钙通道蛋白表达的影响[J].新乡医学院学报,2012,29(4):260-264.
date:Jul 2,2014
Accepted date:Aug 15,2014Foundation item:Natural Science Foundation of Jiangsu Province(No:SBK201222073);Medical Center Joint Research Project(No:YGZX1206)From theDepartmentofOphthalmology,WuxiPeople’sHospitalAffiliatedNanjingMedicalUniversity(SHAO Jun,SUN Wei,YAO Yong,CAO Xia),Wuxi214000,JiangsuProvince,China;HeartCenterofWuxiPeople’sHospitalAffiliatedNanjingMedicalUniversity(WANG Ru-Xin),Wuxi214000,JiangsuProvince,China
Responsible author:YAO Yong,E-mail:pard1@126.com
Changes of calcium concentration in retinal artery smooth muscle cells of rats with diabetic retinopathy
SHAO Jun,SUN Wei,YAO Yong,WANG Ru-Xin,CAO Xia
large conductance Ca2+-actived K+channel;retinal artery smooth muscle cells;intracellular calcium ion concentration
Objective To investigate the changes of calcium concentration in retinal artery smooth muscle cells of rats with diabetic retinopathy.Methods Forty male SD rats were chosen,streptozotocin(100 mg·kg-1)-induced rat diabetic animal models were established successfully by intraperitoneal injection,and fundus fluorescein angiography was used to determine the establishment of diabetic retinopathy after 8 weeks as the diabetic retinopathy group.Another 40 normal SD rats and single DM rats were chosen as the normal group and DM group.Retinal artery smooth muscle cells were isolated by enzyme digestion.Fluorescence microscopy method was applied to determine the three mice retinal artery smooth muscle intracellular calciumion concentration,SPSS 17.0 software was used for analysis.Results After 8 weeks,the blood glucose levels in the control group and DM group were(6.77±0.18)mmol·L-1and(31.14 ±0.75)mmol·L-1,after the same conditions of 6 months,diabetic retinopathy model of SD rat were identified by fundus fluorescein angiography.The calcium concentration in rat retinal artery smooth muscle of the diabetic retinopathy (255±10)nmol·L-1,normal (123±11)nmol·L-1and diabetes group (152±23)nmol·L-1were significantly diffe-rent(P<0.05).Conclusion The increase of calcium concentration in retinal artery smooth muscle cells with diabetic retinopathy may be an important cause of diabetic retinal artery abnormal contraction and dysfunction.
邵珺,孙尉,姚勇,王如心,曹葭.糖尿病视网膜病变大鼠视网膜动脉平滑肌细胞中钙离子浓度的变化[J].眼科新进展,2014,34(11):1013-1016.
10.13389/j.cnki.rao.2014.0281
邵珺,女,1983年10月出生,硕士,主治医师。联系电话:13665138176;E-mail:shaojun1983@hotmail.com
About SHAO Jun:Female,born in October,1983.Master degree.Attending doctor.Tel:13665138176;E-mail:shaojun1983@hotmail.com
2014-07-02
江苏省自然科学基金(编号:SBK201222073);医管中心联合攻关项目(编号:YGZX1206)
214000 江苏省无锡市,南京医科大学附属无锡人民医院眼科(邵珺,孙尉,姚勇,曹葭);214000江苏省无锡市,南京医科大学附属无锡人民医院心脏中心(王如心)
姚勇,E-mail:pard1@126.com
修回日期:2014-08-15
本文编辑:董建军
[Rec Adv Ophthalmol,2014,34(11):1013-1016]

