注射用泮托拉唑钠细菌内毒素检查方法的建立
黄洋 赵志龙
注射用泮托拉唑钠细菌内毒素检查方法的建立
黄洋 赵志龙
目的建立注射用泮托拉唑钠细菌内毒素检查方法。方法按《中国药典》2005 年版二部附录细菌内毒素检查法, 对不同批号的样品进行了干扰试验和细菌内毒素检查。结果注射用泮托拉唑钠水溶液对TAL与细菌内毒素的凝集反应有干扰作用, 经稀释后可排除干扰。结论本品不干扰浓度为2 mg/ml可采用细菌内毒素检查法进行质量控制。
注射用泮托拉唑钠;细菌内毒素;鲎试剂;干扰试验
泮托拉唑钠为质子泵抑制剂, 通过与胃壁细胞的H+-K+-ATP酶系统的两个位点共价结合而抑制胃酸产生的最后步骤。该作用呈剂量依赖性, 并使基础和刺激状态下的胃酸分泌均受抑制。临床用于十二指肠溃疡、胃溃疡、急性胃黏膜病变, 复合性胃溃疡等急性上消化道出血; 根据国家药典委员会关于注射剂质量标准提高专项工作有关精神和“注射剂安全性检查法应用指导原则(修订稿)”的要求, 将“热原”检查法修订为“细菌内毒素检查法”。《中国药典》 2005 年版二部未对其细菌内毒素进行控制, 为保证临床用药安全参照《中国药典》2005 年版二部附录细菌内毒素检查法进行干扰试验研究, 为《中国药典》2010 年版注射用泮托拉唑钠细菌内毒素检查提供了依据。
1 仪器与试药
1.1仪器 HH-1型恒温水浴锅, ZH-2 型自动漩涡混合器。
1.2鲎试剂 湛江博康海洋生物有限公司, 灵敏度:0.5 EU/ml;湛江安度斯生物有限公司, 灵敏度:0.25 EU/ml;福州新北生化工业有限公司, 灵敏度:0.25 EU/ml。
1.3细菌内毒素工作标准品 中国药品生物制品检定所 批号:2006-5 效价:120EU/支。
1.4细菌内毒素检查用水 湛江安度斯生物有限公司。①规格:50 ml ;批号:0510120;②规格:2 ml 批号:0706020。
2 试验方法与结果
2.1供试品细茵内毒素限值的确定 公式:L=K/M M为80 mg/60(kg·h), K为5 EU/(kg·h), 拟定限值L=3.75 EU/mg因此拟定本品内毒素限值为 每1 mg注射用泮托拉唑钠含内毒素的量应<3.75 EU。
2.2供试品有效稀释倍数(MVD)的计算 公式C=λ/L其中L为供试品的细菌内毒素限值3.75 EU/mg, λ为鲎试剂标示灵敏度, 目前市售鲎试剂灵敏度λ通常在0.5~0.06 EU/ ml, 则供试品对应的有效稀释浓度为:C0.5=0.5 EU/ml /3.75 EU/mg = 0.133mg/ml;C0.25=0.25 EU/ml /3.75 EU/mg =0.067 mg/ ml;C0.125=0.125 EU/ml /3.75 EU/mg =0.033 mg/ml;C0.06=0.06 EU/ml /3.75 EU/mg =0.016 mg/ml。
2.3细菌内毒素干扰试验预试验 由于供试品的4 mg/ml稀释液加入鲎试剂后, 溶液显混浊, 所以预试验供试液浓度采用2 mg/ml的浓度, 该浓度加入鲎试剂后溶液澄清。按《中国药典》2005年版二部附录(Ⅺ E)—细菌内毒素检查法检查。阴性对照为细菌内毒素检查用水, 阳性对照为1.0 EU/ml内毒素溶液, 供试品阳性对照为以供试液稀释的1.0 EU/ml内毒素溶液, 结果表明, 注射用泮托拉唑钠在稀释至2 mg/ml时,使用两个厂家的鲎试剂检查均无干扰。
2.4干扰试验 按《中国药典》2005年版附录(Ⅺ E)-细菌内毒素检查法进行干扰试验。将细菌内毒素工作标准品用细菌内毒素检查用水稀释至1.0、0.5、0.25、0.125 EU/ml;根据预试验结果, 确定将供试品稀释至2 mg/ml, 代替细菌内毒素检查用水将细菌内毒素工作标准品稀释至上述浓度, 结果见表1。
正式干扰试验表明:ES均在0.5~2λ, 且Et均在0.5~2 ES;确认注射用泮托拉唑钠的细菌内毒素检查在2 mg/ml以下浓度时进行, 无干扰作用。
2.5细菌内毒素检查 按《中国药典》2005年版二部附录Ⅺ E 细菌内毒素检查法检查。阴性对照为细菌内毒素检查用水, 阳性对照为0.5 EU/ml内毒素溶液, 供试液为0.067 mg/ml的供试品稀释液, 供试品阳性对照为以供试液稀释的0.5 EU/ ml内毒素溶液, 结果见表2。
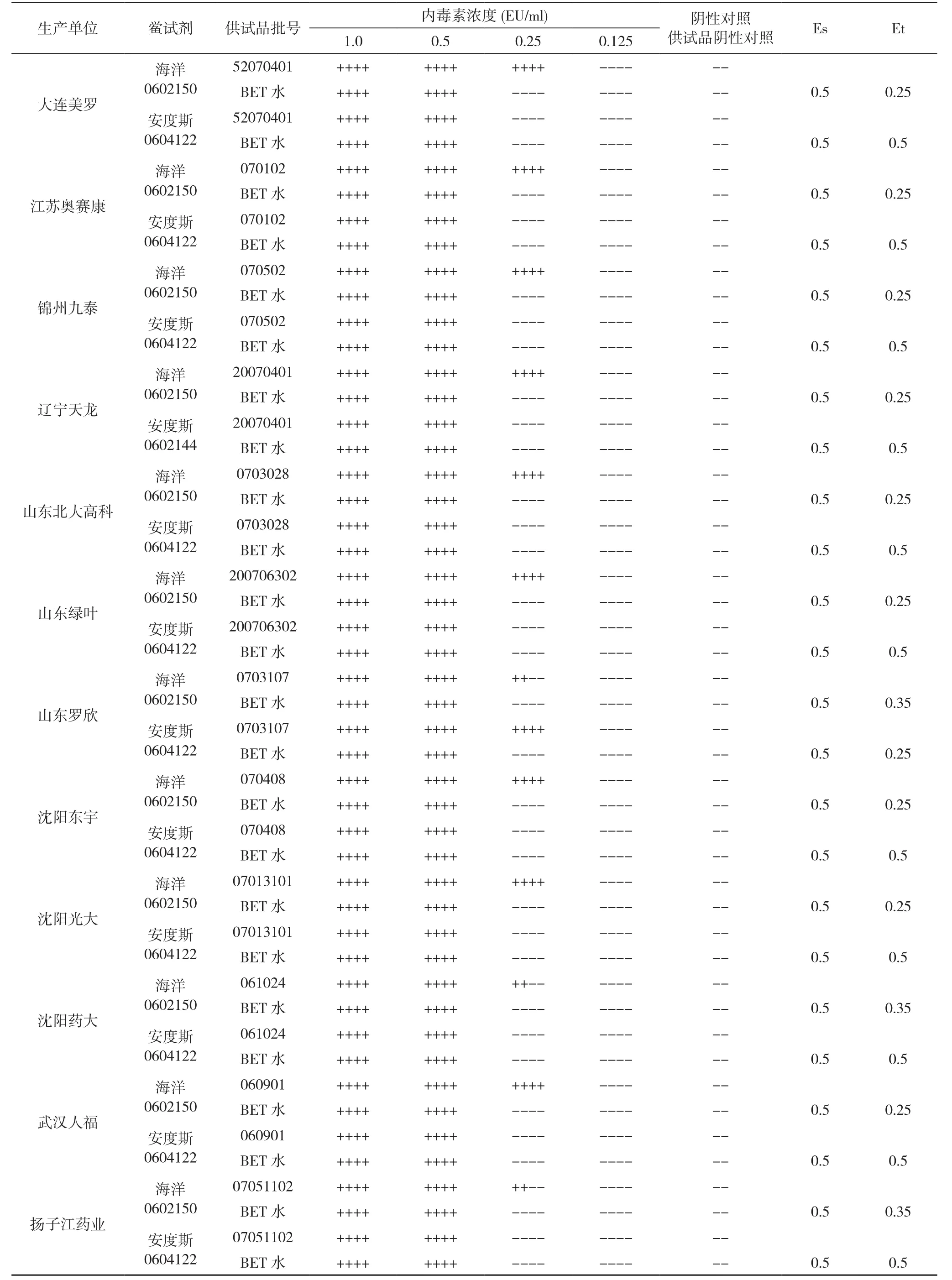
表1注射用泮托拉唑钠干扰试验(λ=0.5 EU/ml)
3 讨论
本品浓度为2 mg/ml或以下浓度时均不干扰细菌内毒素检查;内毒素拟定限值为每1 mg中含细菌内毒素量应<3.75 EU;按此标准检验, 本品细菌内毒素检查均符合规定。注射用泮托拉唑钠临床每次静脉注射最大用量为80 mg。经对12个生产单位20批产品进行干扰试验, 确认本品在2 mg/ml或以下浓度下对细菌内毒素检查无干扰;根据拟定限值对20批样品进行细菌内毒素检查, 结果均符合规定。综合以上结果, 拟将注射用泮托拉唑钠热原检查项修改为细菌内毒素检查, 本品在2 mg/ml浓度下不干扰细菌内毒素检查, 本试验为《中国药典》2010 年版修订时增加注射用泮托拉唑钠细菌内毒素检查项提供了依据。
Establishment of bacterial endotoxin test of pantoprazole sodium for injection
HUANG Yang, ZHAO Zhilong.
Jinzhou Institute for Food and Drug Control, Jinzhou 121000, China
ObjectiveTo establish a method for bacterial endotoxin test of pantoprazole sodium for injection.MethodsAccording to appendix of "Chinese pharmacopoeia" 2005 edition, the interference test and bacterial endotoxin test of different batches of samples were carried out.ResultsThere was interference in the agglutinate reaction between the sample and the relative TAL with pantoprazole Sodium for Injection, and the interference was eliminated after diluted.ConclusionThe noninterference concentration of pantoprazole sodium for injection is 2 mg/ml.The bacterial endotoxin test can be used for the quality control of pantoprazole sodium for injection.
Pantoprazole sodium for injection; Bacterial endotoxin; TAL; Interference test
121000 锦州市食品药品检验所(黄洋);辽宁省食品药品检验所(赵志龙)

