SiO2/Co3O4核壳催化剂对AP热分解的催化性能研究
尹 萍 江晓红 邹 敏 陆路德 汪 信
(软化学与功能材料教育部重点实验室,南京理工大学,南京 210014)
纳米催化剂具有粒径小、比表面积大、表面能高、表面催化活性位多等特点,显示出许多传统催化剂无法比拟的优异特性[1],在工业催化领域具有广阔的研究开发前景,国际上也已经把纳米催化剂作为第四代催化剂进行研究和开发[2]。然而,也正是因为纳米材料表面原子比例高、表面效应显著,在制备和应用过程中纳米粒子极易团聚,比表面积减小,从而影响其催化性能的充分发挥[3]。
高氯酸铵(AP)是固体推进剂中常用的氧化剂,其热分解性质对推进剂的燃烧性能有着重要的影响[4]。添加少量燃速催化剂是提高推进剂燃速的有效方法,常用的燃速催化剂主要是二茂铁衍生物和过渡金属氧化物及其盐类两大类。相对于价格高昂的新型双核二茂铁催化剂,价格相对低廉的过渡金属氧化物类催化剂更受青睐[5]。研究表明,过渡金属氧化物由于具有较好的空电子轨道,容易接受电子对,是促进AP热分解、提高推进剂燃速的优质催化剂,常用的有纳米Co类、纳米氧化铁类、纳米Ni体系等。Co3O4纳米颗粒就是一种优良的纳米过渡金属氧化物催化剂[6],可以降低AP低、高温分解温度,加速AP的热分解过程。但过渡金属纳米催化剂在高温条件下使用时,会出现催化剂比表面积下降,活性位点减少,甚至出现烧结现象,造成催化剂的失活[7]。因此,设计将催化剂制备成核壳式纳米复合物,内核作为载体支撑壳层的催化剂,可以增大比表面积,增加催化剂与反应物间的接触位点,提高催化活性。同时,可以自主选择核与壳的化学成分、改变包覆形式,为纳米催化剂的设计提供了许多可能性。
近年来,不断有文献报道一些核壳式催化剂的制备,但至今未有以SiO2为载体制备SiO2/Co3O4核壳结构纳米催化剂的研究报道。SiO2具有高比表面积、优良的热稳定性及制备简单等优势,本实验采用Stber法[8]制备单分散球形SiO2纳米颗粒,并以此为载体,分别通过液相沉淀法和尿素均匀沉淀法在SiO2球表面沉积Co3O4,制备得到不同包覆形式的SiO2/Co3O4核壳式纳米复合物,利用DSC考察了纯Co3O4纳米颗粒和核壳式SiO2/Co3O4纳米复合物分别对AP热分解的催化效果,着重研究了SiO2/Co3O4的包覆形式对其催化作用的影响。
1 实验部分
1.1 试 剂
高氯酸铵(AP),上海试剂二厂;正硅酸乙酯(TEOS)、Co(NO3)2·6H2O,国药集团化学试剂有限公司;NH3·H2O(25%~28%),上海久亿化学试剂有限公司;无水乙醇、碳酸氢铵,南京化学试剂有限公司;尿素,广东汕头西陇化工厂;PEG,中国医药(集团)上海化学试剂公司。除高氯酸铵为化学纯,其余均为分析纯。
1.2 SiO2核的制备
采用Stöber法制备单分散球形SiO2纳米颗粒。具体操作如下:分别量取100 mL无水乙醇、30 mL去离子水、20 mL氨水(25%~28%)放入三口烧瓶中不断搅拌,直至溶液澄清透明;在搅拌状态下,逐滴滴加30 mL正硅酸乙酯(TEOS),并于30℃条件下恒温反应6 h。将反应所得产物经离心、去离子水和无水乙醇反复洗涤、干燥及研磨后,得到白色粉末,记为1#样品。
1.3 SiO2/Co3O4纳米复合物的制备
1.3.1 液相沉淀法
称取制得的 SiO21.288 g分散于95mL去离子水中,先后加入 0.01 mol Co(NO3)2·6H2O 和 5 mL 50 g·L-1的非离子型表面活性剂[9]PEG 20000溶液,超声分散成悬浮液。将悬浮液转移至三口烧瓶中,搅拌状态下加入 0.021~0.022 mol NH4HCO3,在 40 ℃恒温下搅拌反应3 h。待溶液冷却至室温后,将产物进行离心、去离子水洗涤、干燥,所得产物在350℃下煅烧3.5 h,得到产物记为2#样品。
按以上方法,在不加入SiO2情况下,以相同的加入量制备得到产物,记为4#样品。
1.3.2 尿素均匀沉淀法
称 取 5.093 g 的 Co(NO3)2·6H2O 和 1.523 g 的SiO2溶于100 mL去离子水中,超声分散均匀后,按照一定物质的量比加入尿素 (nCO(NH2)2∶nCo(NO3)2·6H2O=4∶1),并将溶液转移至三口烧瓶中。搅拌状态下,95℃恒温反应3 h。待溶液冷却至室温后,将产物进行离心、去离子水洗涤、干燥,所得产物在350℃下煅烧3.5 h,得到产物记为 3#样品。
1.4 表 征
对制备得到的样品进行结构和成分分析。采用德国Bruker D8 ADVANCE型X射线衍射仪(XRD)分析产物晶相结构,表征条件:Cu Kα 靶(λ=0.154 06 nm),加速电压40 kV,电流 30 mA,数据收集范围15°~80°;采用日本电子(JOEL)JEM-2100 型透射电子显微镜和美国FEI公司Tecnai G2 F30 S-Twin型场发射高分辨透射电镜的STEM,观察产物的形貌和粒径;采用美国赛默非世尔Nicolet iS10傅里叶变换红外光谱仪(FTIR),以及英国Renishaw激光共焦显微拉曼光谱仪(Raman),分析其官能团及成分;采用美国Micromeritics ASAP2020型比表面积分析仪(BET),测试其比表面积及孔径大小。
1.5 催化性能测试
将制得的 1#、2#、3#、4# 样品分别与 AP 以 2∶98的质量比混合,并加入少量无水乙醇进行研磨。待溶剂挥发、干燥后,各称取1 mg左右的混合物,用梅特勒-托利多DSC823e型差式扫描量热仪进行DSC分析测试。测试条件:氮气气氛保护,氮气流速20 mL·min-1,测试范围 50~500 ℃,升温速率为 10 ℃·min-1。
2 结果与讨论
2.1 XRD分析
图 1为 1#、2#、3#、4#样品的 XRD 衍射图。1#样品在22°处有一个宽化的衍射峰,说明制备的SiO2是无定形的非晶结构。3#和4#样品在31.2°、37.4°、38.7°、45.1°、56.1°、59.8°、65.8°以及 77.5°左右出现了衍射峰,分别对应了四氧化三钴的(220)、(311)、(222)、(400)、(422)、(511)、(440)和(533)晶面,这与四氧化三钴的特征晶体峰(JCPDS 76-1802)基本一致[10],证明了四氧化三钴晶体的存在。
对比2#和3#样品的,2#样品未能检测到信号,没有出现衍射峰,可能是由于Co3O4的含量太低;而3#样品出现了四氧化三钴晶体的特征衍射峰,证明了四氧化三钴晶体的存在。

图1 样品的XRD衍射图Fig.1 XRD patterns of samples
2.2 TEM及STEM分析
图 2为 1#、2#、3#、4#样品的 TEM 图。如图所示,1#SiO2是规则的单分散球体,分散性良好,平均粒径约210 nm。4#Co3O4纳米颗粒呈不规则类球状,有团聚现象,平均粒径约为25 nm。
将2#、3#复合物与未包覆的1#SiO2的TEM图对比,明显地看出2#复合物中SiO2球的表面粗糙度增加,3#复合物中有小颗粒随机地分布在SiO2表面。
图3和图4分别是2#、3#的STEM明场和暗场图像。从图中可以看出两种方法制备得到的复合物,其包覆形式完全不同。2#复合物中,Co3O4包裹在SiO2表面形成约为5 nm左右连续的包覆层,将SiO2核完全包裹住,这种包覆形式称为层包覆;而3#复合物中,Co3O4形成小颗粒后随机地分布在SiO2表面,二氧化硅核仍有部分裸露在外,未完全被包覆,这种包覆形式称为粒子包覆。

图2 样品的透射电镜图Fig.2 TEM images of samples

图3 2#样品的(a)TEM;(b)a图方框放大部分图像;(c,d)STEM暗场像;(e)内核SiO2的STEM暗场像,红色部分表示SiO2;(f)外壳Co3O4的STEM暗场像,黄色部分表示Co3O4Fig.3 STEM images of 2#sample(a)TEM;(b)magnificated image of the black frame part;(c,d)DF images;(e)DF image of SiO2core,the red resion indicate SiO2core;(f)DF image of Co3O4shell,the yellow resion indicate Co3O4

图4 3#样品的(a)STEM明场像;(b,c)STEM暗场像;(d)内核SiO2的STEM暗场像,红色部分表示SiO2;(e)外壳Co3O4的STEM暗场像,黄色部分表示Co3O4Fig.4 STEM images of 3#sample(a)BF image;(b,c)DF images;(d)DF image of SiO2core,the red resion indicate SiO2core;(e)DF image of Co3O4shell,the yellow resion indicate Co3O4
2.3 FTIR分析

图5 样品的FTIR谱图Fig.5 FTIR spectra of samples
图 5为 1#、2#、3#、4#样品的红外谱图。4个样品均在3 400和1 600 cm-1左右有2个较宽的峰,分别对应的是颗粒表面吸附水O-H的伸缩振动和弯曲振动[11]。如图所示,1#、2#、3# 样品均在 1 100 和800 cm-1处有峰,分别是Si-O-Si的反对称伸缩振动和对称伸缩振动峰,证明了复合物中二氧化硅的存在[12];1#样品在950 cm-1左右的峰是二氧化硅表面Si-OH的伸缩振动,这是因为未经煅烧的SiO2在空气中吸收水分形成羟基所致[13]。2#、3#和4#样品均在670 cm-1左右出现了Co(Ⅱ)-O的伸缩振动峰,以及560 cm-1左右的Co(Ⅲ)-O伸缩振动峰[14],说明4#为Co3O4,2#和3#均为SiO2/Co3O4复合物。相比较而言,2#、3#复合物的Co-O特征峰较弱,这可能是因为复合物中Co3O4含量较少。
2.4 Raman分析
图 6 为 1#、2#、3#、4# 样品的 Raman 谱图。4#样品的拉曼谱线在 667、610、510、465 和 190 cm-1左右拥有归属于Co3O4的5个拉曼振动模式(A1g+Eg+3T2g)[15];其中,667 cm-1属于 A1g拉曼振动模式,610 cm-1属于T(1)2g拉曼振动模式,510 cm-1属于T(2)2g拉曼振动模式,465 cm-1属于Eg拉曼振动模式,190 cm-1属于T(3)2g拉曼振动模式。2#、3#复合物在相应位置也出现了属于Co3O4的拉曼特征峰,但峰更弱,是由于复合物中的Co3O4含量较低的缘故,这也验证了复合物中Co3O4的存在。1 123 cm-1左右处峰推断是Si-O-Si反对称伸缩振动峰[16],一般地拉曼光谱的峰强与相应物质的含量成正比,由于2#、3#复合物上包覆了Co3O4壳层,激光穿透壳层照射到SiO2核后强度会逐渐衰减,表现为SiO2特征峰强度减小,这也间接说明了SiO2核上有包覆层。

图6 样品的Raman谱图Fig.6 Raman spectra of samples
2.5 BET比表面积分析
对样品进行比表面积及孔径的测定,结果见表1。相对而言,2#和3#复合物的比表面积是1#SiO2的近3倍;2#、3#复合物的比表面积都比纯Co3O4大。3#复合物的孔径接近纯SiO2颗粒的,可能是因为3#复合物中有部分SiO2表面未被Co3O4完全覆盖,SiO2仍有部分裸露在外;而2#复合物的孔径比3#的小了一半,可能是因为2#复合物的SiO2核被Co3O4形成的连续壳层完全包裹着。
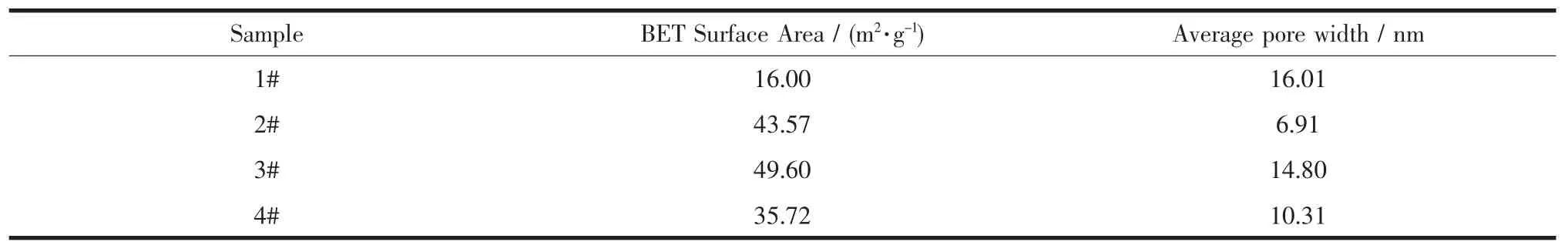
表1 样品的比面积及孔径Table 1 specific surface area and pore width of samples
2.6 产物催化性能及机理研究
2.6.1 产物对AP热分解的催化性能研究
图7所示为各样品与AP的混合物及纯AP的DSC分解曲线。由图可知,纯AP的热分解分为3个阶段[17]:晶型转变过程,AP由斜方晶型向立方晶型转变,约为242℃;低温分解过程(<350℃),分解峰值温度约322℃;高温分解过程(>350℃),分解峰值温度约418℃。SiO2、Co3O4及复合物的加入对AP的晶型转变都没有明显作用,但对低温和高温分解都有不同程度的催化作用。添加1#SiO2对AP的催化作用不明显,但放热量增加了100 J·g-1,这可能是因为SiO2的大尺寸孔道,有利于气相物质的流通和热传导[18]。

图7 纯AP、不同样品与AP混合物的DSC分解曲线Fig.8 DSC curves of AP and AP mixed with different samples
添加4#Co3O4后,明显降低了AP低、高温的热分解温度,并且使得这两部分的热分解合二为一,高温分解温度提前了67℃,放热量也增加了725 J·g-1,说明Co3O4对AP的热分解具有显著的催化作用。
与添加纯Co3O4相比,添加2#SiO2/Co3O4复合物后,发现复合粒子的催化效果比纯四氧化三钴颗粒更好,放热量明显增大了。
虽然复合物中Co3O4的含量较少,但是放热量反而有所增加,这可能是因为SiO2作为内核,支撑其表面的Co3O4颗粒,大幅度地增加了催化剂的比表面积,从而使得起催化作用的Co3O4和反应基质间的有效接触面积增大了。总之,Co3O4包覆SiO2的复合催化剂,不但大幅度减少了Co3O4的使用量,还保证了很好的催化效果。
在AP中添加了不同包覆形式的2#和3#SiO2/Co3O4复合物,对比其热分解曲线,可以看出3#SiO2/Co3O4的催化效果更好,使得AP的高温分解温度提前了110℃,放热量也增加了662 J·g-1。这可能是因为3#催化剂比表面积更大,催化过程中Co3O4与AP的有效接触面积更大;另外3#催化剂的孔径更大,在气-固催化阶段,为气相物质提供进入催化剂内部的通道,有利于活性中心参与反应,增加了催化活性位点;同时有助于气态产物的快速扩散及反应热的快速传导,从而促进AP的热分解反应。
2.6.2 催化机理研究
AP的热分解是固-气多相反应,分为低温分解和高温分解阶段,存在着分解和升华竞争过程[19,20],反应方程式如下:

根据Raevsky和Maneli[21]提出了电子跃迁能带理论,AP的禁带宽度为5.6 eV,是典型的绝缘体物质,因此在低温分解过程中不能保持电子的持续转移。Kuratanil[22]提出,在过渡金属氧化物中只有p型半导体在催化电子转移方面是有效的,而n型半导体是没有效果。Co3O4是p型半导体,具有空穴导电性,可以作为ClO4-和NH4+间电子转移的桥梁,加速电子转移,起到催化AP热分解的作用[23]。首先,Co3O4的空穴具有极强的夺取ClO4-电子的能力,同时将夺取的电子转移到催化剂表面,并将电子转移给NH4+:

AP分解产生的气相物质与固相催化剂是完全接触的,此时催化剂的总比表面积就是发生反应的总接触面积,而颗粒包覆的SiO2/Co3O4复合物,由于有SiO2作为内核,支撑其表面的Co3O4颗粒,此时复合物的比表面积几乎就是Co3O4壳层的比表面积,复合物比表面积增大就意味着壳层Co3O4颗粒的比表面积,催化活性位点增多;同时由于多孔性SiO2颗粒的协同作用,可以加速气态物质的快速扩散以及反应热的快速传导,从而加速AP的热分解。
3 结 论
(1)采用Stöber法制备得到了粒径约为200 nm的SiO2球形纳米颗粒,分散性良好。
(2)用液相沉淀法制备得到层包覆形式的SiO2/Co3O4纳米复合物,Co3O4壳层厚度约为5 nm,比表面积大,具有明显的核壳结构。
(3)用尿素沉淀法制备得到粒子包覆形式的SiO2/Co3O4纳米复合物,Co3O4小颗粒随机分布在SiO2表面,具有高比表面积和大孔径的特点。
(4)Co3O4和SiO2/Co3O4对AP热分解反应都表现出良好的催化活性,其中颗粒包覆形式的SiO2/Co3O4复合物催化活性最好,核与壳层表现出良好的协同催化作用。这种复合物催化剂,不仅可以提高催化性能,还大幅度降低了催化剂用量。
[1]CHEN Qing-Ling(陈庆龄).Modern Chem.Ind.(现代化学),2004,24(7):20-25
[2]FANG Li(范 立),DUAN Tao(段 涛).Guangzhou Chem.Ind.(广州化工),2010,38(12):25-26
[3]YAN Zi-Feng(阎子峰).Nanomet.Catal.Technol.(纳米催化技术).Beijing:Chemical Industry Process,2003.
[4]Aleksandr V D.Propellants,Explos.,Pyrotech.,2005,30:244-249
[5]LI Feng-Sheng(李凤生),YANG Yi(杨毅),MA Zhen-Ye(马振叶),et al.Nanomet.Funct.Composit.Mater.Appl.(纳米功能复合材料),Beijing:National Defence Industry Press,2003.
[6]LIU Jian-Xun(刘建勋),LI Feng-Sheng(李凤生),JIANG Wei(姜炜),et al.J.Solid Roket Technol.(固体火箭技术),2007,30(3):243-247
[7]SHI Li-Hong(石利红),LI Xiao-Feng(李晓峰),LI De-Bao(李德宝),et al.Chin.J.Catal.(催化学报),2010,31(12):1483-1488
[8]Stöber W,Fink A.J.Colloid Interf.Sci.,1968,26:62-69
[9]Yang J H,Sasaki T.Cryst.Growth Des.,2010,10(3):1233-1236
[10]Farhadi S,Safabakhsh J,Zaringhadam P.J.Nanostruct.Chem.,2013,3:69-77
[11]Meng Y D,Chen D,Jiao X L.J.Phys.Chem.B,2006,110:15212-15217
[12]Chakkalakal G L,Alexandre M,Abetz C,et al.Macromol.Chem.Phys.,2012,213:513528.
[13]MENG Yong-De(孟永德).Thesisforthe Doctorate of Shandong University(山东大学博士论文).2007
[14]Farhadi S,Pourzare K,Sadeghinejad S.J.Nanostruct.Chem.,2013,3:16-22
[15]Tripathy S K,Christy M.Mater.Lett.,2008,62:1006-1009
[16]LU Lu-De(陆路德).Quantum Chemistry(量子化学).Beijing:Science Press,1980
[17]Boldyrev V V.Thermochim.Acta,2006,443:1-36
[18]YE Jian(叶剑),ZHANG Rui-Feng(张瑞丰),HOU Lin-Xi(侯琳熙).Chin.J.Environ.Eng.(环境工程学报),2011,5(7):1598-1600
[19]Keenan A G,Siegmund R F.Quart.Rev.Chem.Soc.,1969,23(3):435-452
[20]Rosso L,Tuckerman M E.Solid State Ion,2003,161:219-229
[21]Chaturvedi S,Pragnesh N D.J.Saudi Chem.Soc.,2013,17(2):135-149
[22]ZHANG Bo-Sheng(张柏生).Introd.Powder Burning(火药燃料导论).Nanjing:East China Insttute of Technology,1988.
[23]LIU Jian-Xun(刘建勋),WANG Zuo-Shan(王作山),JIANG Wei(姜炜),et al.Rare Metal Mater.Eng.(稀有金属材料与工程),2007,36(Z3):649-653

